
практика 6 / практика 6
.docДисциплина: СООРУЖЕНИЕ И ЭКСПЛУАТАЦИЯ ГАЗОНЕФТЕПРОВОДОВ И ГАЗОНЕФТЕХРАНИЛИЩ
Раздел: ХРАНЕНИЕ НЕФТИ, ГАЗА И НЕФТЕПРОДУКТОВ
Практическое занятие № 6
вычисление физических характеристик свойств природных газов в зависимости от внешних условий
Указания к выполнению задания
Природный
газ состоит в основном из метана
![]() .
Плотность
.
Плотность
![]() газа зависит от его состава, давления
и температуры. При стандартных
условиях
(
газа зависит от его состава, давления
и температуры. При стандартных
условиях
(![]() = 0,1013 МПа,
= 0,1013 МПа,
![]() = 293 К) плотность природного газа
= 293 К) плотность природного газа
![]() составляет примерно 0,7 кг/м3.
составляет примерно 0,7 кг/м3.
Относительной
плотностью
![]() газа по
воздуху
называется отношение
газа по
воздуху
называется отношение
![]() плотности
плотности
![]() природного газа к плотности
природного газа к плотности
![]() воздуха при одних и тех же (например,
стандартных) условиях. Очевидно, что
для совершенных газов это отношение не
зависит ни от давления, ни от температуры.
В частности, плотность
воздуха при одних и тех же (например,
стандартных) условиях. Очевидно, что
для совершенных газов это отношение не
зависит ни от давления, ни от температуры.
В частности, плотность
![]() природного газа представляется в виде:
природного газа представляется в виде:
![]() ,
,
причем
![]() .
.
Связь
вида
![]() между давлением
между давлением
![]() в газе, его удельным объемом
в газе, его удельным объемом
![]() и абсолютной температурой
и абсолютной температурой
![]() называется уравнением
состояния
газа. При умеренных давлениях и
температурах свойства газов достаточно
хорошо моделируются уравнением состояния
Клапейрона-Менделеева:
называется уравнением
состояния
газа. При умеренных давлениях и
температурах свойства газов достаточно
хорошо моделируются уравнением состояния
Клапейрона-Менделеева:
![]() (101)
(101)
где
![]() - объем газа;
- объем газа;
![]() — его масса;
— его масса;
![]() - молярная масса газа, (кг/кмоль);
- молярная масса газа, (кг/кмоль);
![]() — универсальная газовая постоянная
(
— универсальная газовая постоянная
(![]() ).
Газы, свойства которых моделируются
уравнением Клапейрона-Менделеева,
называют совершенными.
).
Газы, свойства которых моделируются
уравнением Клапейрона-Менделеева,
называют совершенными.
Если
учесть, что удельный объем
![]() газа определяется как
газа определяется как
![]() ,
,
и
![]() - газовая постоянная данного
газа, то уравнение состояния совершенного
газа записывается также в форме:
- газовая постоянная данного
газа, то уравнение состояния совершенного
газа записывается также в форме:
![]() или
или
![]() .
(102)
.
(102)
Газовая
постоянная
![]() метана равна 518,33 Дж/(кг• К), углекислого
газа - 188,95 Дж/(кг • К ), кислорода - 259,8 1
Дж/(кг • К ), воздуха - 287,1 Дж/(кг• К);
метана равна 518,33 Дж/(кг• К), углекислого
газа - 188,95 Дж/(кг • К ), кислорода - 259,8 1
Дж/(кг • К ), воздуха - 287,1 Дж/(кг• К);
![]() .
.
Свойства
реальных природных газов отличаются
от свойств совершенного газа.
Для каждого реального газа имеется
некоторая критическая
температура
![]() такая, что для любого значения
такая, что для любого значения
![]() существует давление
существует давление
![]() ,
при котором происходит фазовый переход
газа в жидкое состояние, а для температур
,
при котором происходит фазовый переход
газа в жидкое состояние, а для температур
![]() такой переход невозможен ни при каких
давлениях. Если
такой переход невозможен ни при каких
давлениях. Если
![]() ,
то существует давление
,
то существует давление
![]() ,
при котором свойства жидкой и газовой
фаз неразличимы. Параметры газа
,
при котором свойства жидкой и газовой
фаз неразличимы. Параметры газа
![]() называется критическими.
Так, например, для метана эти параметры
составляют:
называется критическими.
Так, например, для метана эти параметры
составляют:
![]() .
.
Некоторые постоянные компонентов, составляющих природный газ, приведены в нижеследующей таблице.
Таблица
Постоянные компонентов, составляющих природный газ
|
Газ |
Молярная масса, кг/кмоль |
Плотность по воздуху |
Критическое давление, МПа |
Критическая температура, К |
|
Метан |
16,042 |
0,554 |
4,641 |
190,55 |
|
Этан |
30,068 |
1,049 |
4,913 |
305,50 |
|
Пропан |
44,094 |
1,562 |
4,264 |
369,80 |
|
Изобутан |
58,120 |
2.066 |
3,570 |
407,90 |
|
н - Бутан |
58,120 |
2,091 |
3.796 |
425.17 |
|
н - Пентан |
72,146 |
2,480 |
3,374 |
469,78 |
|
Азот |
28,016 |
0,970 |
3,396 |
126,25 |
|
Кислород |
32,000 |
1,104 |
4,876 |
154,18 |
|
Сероводород |
34,900 |
1,190 |
8,721 |
373.56 |
|
Углекисл.газ |
44,011 |
1,525 |
7,382 |
304,19 |
|
Водород |
2,020 |
0,069 |
1,256 |
33,10 |
|
Гелий |
4,000 |
1,136 |
0,222 |
5,00 |
|
Воздух |
28,966 |
1,000 |
3,780 |
132,46 |
В ряде случаев уравнение состояния реального газа представляют в виде
![]() (103)
(103)
где
![]() - безразмерный коэффициент
сжимаемости
газа (называемый иногда еще коэффициентом
сверхсжимаемости
газа). Очевидно, что для совершенных
газов
- безразмерный коэффициент
сжимаемости
газа (называемый иногда еще коэффициентом
сверхсжимаемости
газа). Очевидно, что для совершенных
газов
![]() .
.
Зависимость
![]() от отношений
от отношений
![]() и
и
![]() ,
называемых приведенным
давлением
и приведенной
температурой,
соответственно, представлена на рис.
1.12.
,
называемых приведенным
давлением
и приведенной
температурой,
соответственно, представлена на рис.
1.12.

Рис.
1.12. Зависимость
![]() от
от
![]() и
и
![]() .
.
Для
природных газов, представляющих собой
метан в смеси с некоторыми другими
компонентами (этан, пропан, бутан,
изо-бутан, пентан, азот, сероводород,
углекислый газ, водород, гелий и т.п.),
коэффициент
![]() сжимаемости может быть рассчитан по
следующей аппроксимационной формуле:
сжимаемости может быть рассчитан по
следующей аппроксимационной формуле:
![]() (104)
(104)
Молярная масса и критические параметры газовой смеси вычисляются по следующим аддитивным формулам:
![]() ;
;![]() ;
;![]() (105)
(105)
где
![]() — объемные доли компонентов, составляющих
газ.
— объемные доли компонентов, составляющих
газ.
Простейшие термодинамические процессы.
Изотермический
процесс:
![]() .
При изотермическом расширении (или
сжатии) совершенного газа от давления
.
При изотермическом расширении (или
сжатии) совершенного газа от давления
![]() до давления
до давления
![]() к газу необходимо подводить (или
соответственно отбирать) тепло:
к газу необходимо подводить (или
соответственно отбирать) тепло:
![]() (106)
(106)
где
![]() — количество тепла, рассчитанное на
единицу массы газа (Дж/кг или кал/кг;
1кал = 4,187 Дж); причем
— количество тепла, рассчитанное на
единицу массы газа (Дж/кг или кал/кг;
1кал = 4,187 Дж); причем
![]() ,
если газ расширяется (
,
если газ расширяется (![]() ),
и
),
и
![]() ,
если газ сжимается (
,
если газ сжимается (![]() )
)
Обратимый
адиабатический
процесс:
![]() .
Имеют место следующие соотношения:
.
Имеют место следующие соотношения:
![]() ,
,![]() (107)
(107)
где
![]() - плотность, давление и температура газа
в начальном состоянии;
- плотность, давление и температура газа
в начальном состоянии;
![]() — те же параметры газа в текущем (или
конечном) состоянии;
— те же параметры газа в текущем (или
конечном) состоянии;
![]() - показатель адиабаты;
- показатель адиабаты;
![]() - теплоемкости газа соответственно при
постоянном давлении и объеме (Дж/(кг К).
Например, для воздуха
- теплоемкости газа соответственно при
постоянном давлении и объеме (Дж/(кг К).
Например, для воздуха
![]() ;
для метана -
;
для метана -
![]() ;
для этана -
;
для этана -
![]() ;
для пропана
;
для пропана
![]() и т.д. Для совершенного газа (
и т.д. Для совершенного газа (![]() )
имеет место формула Майера:
)
имеет место формула Майера:
![]() .
.
Политропическим называется процесс, в котором плотность и давление связаны уравнением:
![]() ,
,
где
![]() ;
;
![]() — показатель политропы. Если в этом
процессе
— показатель политропы. Если в этом
процессе
![]() ,
то
,
то
![]() .
Если процесс политропического сжатия
газа (
.
Если процесс политропического сжатия
газа (![]() )
идет с подводом тепла (
)
идет с подводом тепла (![]() ),
то
),
то
![]() ;
если же он сопровождается отбором тепла
(
;
если же он сопровождается отбором тепла
(![]() ),
то
),
то
![]() .
.
В политропическом процессе плотность, давление и температура газа связаны соотношениями, аналогичными (107):
т-1
![]() ,
,![]() (108)
(108)
Примеры решения задач
Задача 1
Газовая смесь состоит из 99 % метана, 0,5 % этана и 0,5 % азота. Определить молярную массу газовой смеси и значение газовой постоянной.
Решение Задачи 1.
-
Рассчитаем молярную массу по формуле:
![]()
-
Рассчитаем значение газовой постоянной смеси:
![]()
Задача 2
Газовая смесь состоит из 88 % метана, 6 % этана, 4% пропана и 2 % азота. Определить молярную массу газовой смеси и значение ее газовой постоянной.
Решение Задачи 2.
-
Рассчитаем молярную массу по формуле:
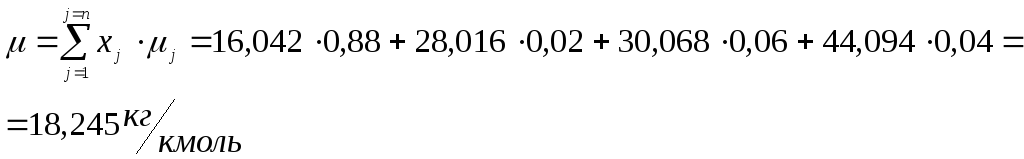
-
Рассчитаем значение газовой постоянной смеси:
![]()
Задача 3
Определить
массу 100 тыс. стандартных (то есть
вычисленных при давлении р = 0,1013 МПа и
температуре Т = 293 К) кубометров природного
газа (![]() = 19,2 кг/кмоль).
= 19,2 кг/кмоль).
Решение Задачи 3.
-
Рассчитаем массу по формуле Менделеева-Клайперона:
![]() →
→![]()
Задача 4
Объем природного газа, измеренный при стандартных условиях, составляет 10 тыс. м3. Каков объем этого газа при нормальных (то есть вычисленных при давлении р = 0,1013 МПа и температуре Т = 273 К) условиях?
Решение Задачи 4.
-
Запишем уравнения Менделеева-Клайперона для нормальных и стандартных условий:
![]()
![]()
-
Совместно решим уравнения (1):
![]()
Задача 5
Природный газ, хранящийся в резервуаре емкостью 20 тыс. м3 при среднем давлении 0,11 МПа, подвержен колебаниям суточной температуры от +8 °С ночью до +20 ˚С днем. Определить амплитуду колебания давления в резервуаре.
Решение Задачи 5.
-
Запишем уравнения Менделеева-Клайперона для дневных и ночных условий:
![]()
![]()
-
Совместно решим уравнения (1):
![]()
-
Известно, что:
![]()
-
Совместно решим уравнения (2) и (3):
![]()
-
Суточные колебания давления составят:
![]()
Задача 6
Газовую полость (или газовый пузырь) подземного хранилища газа (ПХГ) можно приближенно считать прямым цилиндром, имеющим в плане форму прямоугольника со сторонами a = 3770 м, b = 5000 м и высотой h = 15 м. Пористость m пласта (то есть объемная доля пустот в породах, слагающих пласт), составляет 30 %. Насыщенность s пустот газом (то есть объемная доля этих пустот, заполненных газом), равна 0,65; остальная часть пустот заполнена водой. Определить, какой объем газа в стандартных кубических метрах находится в ПХГ, если известны пластовое давление р = 10 МПа и температура Т = 30˚С газа. Известны также постоянные газа: R = 470 Дж/(кг К), ркр = 4,7 МПа, Ткр = 200 К.
Решение Задачи 6.
-
Определим поровый объём газа Vп:
![]()
![]()
-
Определим коэффициент сжимаемости газа Z:

-
Определим плотность газа в пластовых условиях:
![]()
-
Определим массу газа M:
![]()
-
Определим плотность газа при стандартных условиях
 :
:
![]()
-
Определим объём газа, выраженный в стандартных кубических метрах:
![]()
