
- •Якісний аналіз
- •Методи якісного аналізу
- •Хімічні фізико-хімічні Фізичні
- •Класифікація методів якісного аналізу
- •Макрометод мікрометод напівмікрометод
- •Умови проведення аналітичних реакцій
- •Способи виконання аналітичних реакцій
- •Хід аналізу
- •Кислотно – лужна класифікація катіонів
- •Класифікація аніонів
- •Використання неорганічних речовин у медицині
- •Домішки в лікарських препаратах
- •Кількісний аналіз
- •Методи кількісного аналізу хімічні фізико-хімічні фізичні
- •Суть титриметричного аналізу
- •Методи титриметрії
- •Вимоги до хімічних реакцій
- •Способи титрування
- •Види робочих розчинів
- •Вимоги до первинних стандартів
- •Способи відбору проб для титрування
- •Розрахункові формули в титриметричному аналізі
- •Кислотно – основне титрування (метод нейтралізації)
- •2) Протофільні (основні):
- •3) Амфіпротні (амфотерні) :
- •Окисно – відновні реакції
- •Окисно – відновне титрування (оксидиметрія)
- •Перманганатометрія
- •Йодометрія
- •Броматометрія
- •Нітритометрія
- •Методи осадження
- •Аргентометрія
- •Метод Мора
- •Метод Фаянса
- •Тіоцианометрія (метод Фольгарда)
- •Комлексонометрія
- •Інструментальні методи
- •Рефрактометрія
- •Фотометрія
- •Фотоколориметрія
- •Хроматографія
- •Паперова хроматографія
- •Іонообмінна хроматографія
Броматометрія
Суть метода:
– для визначення відновників BrO3– + 6H+ + 6ē → Br– + 3H2O
– для визначення органічних сполук, здатних до бромування (феноли, ароматичні аміни):
1 – виділення з калій бромату вільного брому:
KBrO3 + 5KBr + 6HCl → 3Br2 + 6KCl + 3H2O
2 – бромування органічної сполуки:
ОН ОН
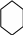

 Br
Br
Br
Br
+3Br2 → + 3HBr
Br
3 – взаємодія надлишку брому з реактивом КІ:
Br2 + 2КІ → 2КBr + І2
4 – титрування еквівалентної кількості йоду робочим розчином натрій
тіосульфату:
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Робочий розчин:
0,1н розчин KBrO3 (калій бромат) – первинний стандарт, але якщо треба перевірити точну концентрацію розчину, використовують метод йодометрії.
Стандартизація робочого розчину KBrO3 (замісникове титрування):
KBrO3 + 6KІ + 6HCl → 3І2 + KBr + 6KCl + 3H2O
реактив замісник
 BrO3–
+ 6H+
+ 6ē → Br–
+ 3H2O
1
BrO3–
+ 6H+
+ 6ē → Br–
+ 3H2O
1
2І– – 2ē → І2 3
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Індикатори:
– для визначення відновників – метиловий червоний або метиловий оранжевий, які руйнуються в точці еквівалентності від зайвої краплі KBrO3, і розчин знебарвлюється;
– для визначення органічних сполук – крохмаль.
Застосування методу броматометрії:
– для визначення відновників – As(III); Sb(III); Fe(III);
– для визначення органічних сполук:
феноли – фенол, тимол, резорцин, саліцилова кислота та саліцилати;
ароматичні аміни – сульфаніламідні препарати.
Нітритометрія
Суть метода:
 +
–
+
–
NH2 N ≡ N Cl
 ׀
׀
׀
׀

+ NaNO2 + 2HCl → + NaCl + 2H2O
Робочий розчин:
0,1н розчин NaNO2 – натрій нітрит
Cтандартний розчин: KMnO4 – калій перманганат
Стандартизація робочого розчину (зворотне та замісникове титрування):
5NaNO2 + 2КMnO4 + 3H2SO4 → 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O
надлишок

 MnO4–
+ 8H+
+ 5ē → Mn2+
+
4H2O
2
MnO4–
+ 8H+
+ 5ē → Mn2+
+
4H2O
2
NO2– + H2O – 2ē → NO3– + 2H+ 5
2KMnO4 + 10КІ + 8H2SO4 → 5І2 + 2MnSO4 + 6K2SO4 + 8H2O
замісник
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Індикатори:
– внутрішній індикатор (додають безпосередньо в розчин) – тропеолін ОО (червоний → жовтий);
– зовнішній індикатор – йодкрохмальний папір (КІ + крохмаль): надлишкова крапля робочого розчину вступає в реакцію з КІ. Внаслідок цієї реакції виділяється йод, який забарвлює папір у синій колір:
2NaNO2 + 2KI + 4HCl → I2 + 2NO + 2KCl + 2NaCl + 2H2O
Застосування методу нітритометрії:
– визначення первинних ароматичних амінів – сульфаніламідні препарати, парацетамол, фенацетин, лідокаїн, анестезин, новокаїн, дикаїн. Якщо аміногрупа блокована, її спочатку піддають гідролізу;
– визначення ароматичних нітросполук (нітрогрупу спочатку відновлюють до аміногрупи) – нітроксолін, левоміцетин.
