
- •7. Ознайомлення з правилами тб.
- •8. Добування та дослідження властивостей галогенопохідних вуглеводнів.
- •5. Ознайомлення з правилами тб.
- •Дослідження властивостей спиртів.
- •Дослідження властивостей гліцерину.
- •Дослідження властивостей фенолу.
- •5. Ознайомлення з правилами тб.
- •6. Дослідження властивостей альдегідів.
- •7. Результати дослідів занести у таблицю:
- •1. Ознайомлення з правилами тб.
- •2. Порівняльна характеристика властивостей органічних та неорганічних
- •3. Дослідження властивостей вищих жирних кислот.
- •4. Дослідження властивостей мурашиної кислоти.
- •5. Результати дослідів занести у таблицю:
- •1. Ознайомлення з правилами тб.
- •2. Дослідження властивостей гідроксикислот та фенолокислот.
- •3. Результати дослідів занести у таблицю:
- •Практична робота №9
- •3. Ознайомлення з правилами тб.
- •5. Дослідження властивостей сахарози.
- •6. Дослідження властивостей крохмалю.
- •7. Результати дослідів занести у таблицю:
- •Практична робота №10
- •4. Ознайомлення з правилами тб.
- •5. Дослідження властивостей триетиламіну.
- •3. Дослідження властивостей амінокислот.
- •4. Дослідження властивостей аніліну.
- •5. Результати дослідів занести у таблицю:
Практична робота №1
Тема: Складання формул та вивчення властивостей
насичених вуглеводнів
Мета: 1. Навчитися складати структурні формули насичених
вуглеводнів.
2. Навчитися давати назви насиченим вуглеводням за
систематичною номенклатурою, виходячи з їх структурних
формул.
3. Навчитися складати рівняння реакцій за участю насичених
вуглеводнів.
4. Навчитися визначити формули органічних сполук за
масовими частками хімічних елементів.
Вихідні знання:
Теорія хімічної будови органічних сполук О.М.Бутлерова, види структурної ізомерії.
Алкани, циклоалкани: визначення, загальні формули, види ізомерії, фізичні властивості.
Електронна будова алканів, особливості будови циклоалканів.
Хімічні властивості метану.
Хімічні властивості етану.
Хімічні властивості пропану.
Хімічні властивості бутану.
Хімічні властивості циклопропану.
Хімічні властивості циклопентану.
Добування метану та етану.
Хід роботи:
Назвати за систематичною номенклатурою наступні насичені вуглеводні:
а
 )
СН3
– СН2
– СН2
СН2
– СН3
б) СН3
– СН – СН – СН2
– СН2
– СН3
)
СН3
– СН2
– СН2
СН2
– СН3
б) СН3
– СН – СН – СН2
– СН2
– СН3

 С
׀
׀
С
׀
׀
СН3 – СН2 – СН2 СН2 – СН3 СН3 СН2 – СН3
в
 )
СН3
– СН2
СН3
– СН – СН3
г) СН3
СН3
)
СН3
– СН2
СН3
– СН – СН3
г) СН3
СН3
׀ ׀ С
СН3 – С – СН3 СН2 СН3 СН3
׀ ׀
СН2 – СН2 – СН2 – СН2
СН3
׀
д) СН3 – СН2 – СН – СН – СН2 – СН2 – СН3 е) СН3 – СН2 – СН – СН – СН3
׀ ׀ ׀
СН2 СН2 – СН2 – СН3 СН3
׀
СН3 СН3
׀
ж) СН3 – СН – СН2 – СН2 – СН3 з) СН3 – СН2 – С – СН2 – СН3
׀ ׀
С2Н5 СН3 – С – СН3
׀
и) Н2С – СН – С3Н7 СН2
׀ ׀ ׀
Н2С – СН2 СН3
к
 )
Н2С
С2Н5
)
Н2С
С2Н5

 С
С
Н2С С3Н7
2. Скласти структурні формули насичених вуглеводнів:
а) 4 – етил – 3 – метилоктан
б) 4 – етил – 3,3 – диметилнонан
в) 3 – етил – 2,3 – диметилгексан
г) 2,2,3,4 – тетраметилгептан
д) 3,3 – діетил – 2,5 – диметилоктан
е) н – гексан
ж) 3 – етил – 4 – ізопропілнонан
з) 1,3 – диметилциклопентан
и) 1,1 – дихлор – 2 – етилциклобутан
к) 3 – етил – 1,3 – диметилциклогексан
3. Здійснити перетворення:
а) СН4 → СН3С1 → С2Н6 → С2Н5С1 → С4Н10
б) бутан → етан → хлоретан → дихлоретан
 в)
алюміній карбід → метан →
нітрометан
в)
алюміній карбід → метан →
нітрометан
 →
хлороформ
→
хлороформ
г) натрій ацетат → метан → ацетилен → вуглекислий газ
4. Познайомитися зі зразком розв’язування задач на виведення формул
органічних речовин за відомими масовими частками хімічних елементів
у молекулі.
М = 2DH2
|
M = 29Dпов
|
M = 44DCO2
|
M = 4DHe
|
M = 22,4ρ
|
DH2 – відносна густина за воднем
Dпов – відносна густина за повітрям
DCO2 – відносна густина за вуглекислим газом
DHe – відносна густина за гелієм
ρ – густина речовини, г/л
Задача Вивести формулу органічної речовини, якщо відомі масові частки елементів, які складають цю молекулу: С – 51,89%, Н – 9,73%, Сl – 38,38%. Відносна густина пари речовини за повітрям дорівнює 3,19.

Дано: Розв’язування:
ω(С) = 51,89% 1. Нехай формула речовини СхНуСlz
ω(Н) = 9,73% У зразку речовини масою 100г:
ω(Сl) = 38,38% m(С) = 51,89г
Dпов = 3,19 m(Н) = 9,73г
ф ормула
–
?
m(Сl)
= 38,38г
ормула
–
?
m(Сl)
= 38,38г
m(С) m(Н) m(Сl)


 Тоді
х : у : z
= : :
Тоді
х : у : z
= : :
Аr(С) Аr(Н) Аr(Сl)
51,89 9,73 38,38
х : у : z = : : = 4,32 : 9,73 : 1,08
12 1 35,5
З усіх чисел вибираємо найменше і ділимо всі числа на найменше:
4.32 9,73 1,08
х : у : z = : : = 4 : 9 : 1
1,08 1,08 1,08
Найпростіша формула С4Н9Сl.
2. Знаходимо молярну масу речовини:
М = 29Dпов = 3,19 ∙ 29 = 92,5 г/моль
3. Знаходимо істину формулу (треба визначити, у скільки разів треба збільшити
індекси в формулі С4Н9Сl):
М 92,5

 n
= = = 1 – збільшувати
індекси не треба.
n
= = = 1 – збільшувати
індекси не треба.
М(С4Н9Сl) 92,5
Відповідь: молекулярна формула С4Н9Сl .
5. Розв’язати задачі:
1 – Органічна речовина містить 84,21% С та 15,79% Н. Відносна густина пари
речовини за повітрям 3,93. Визначити молекулярну формулу речовини.
(Відповідь: С8Н18)
2 – Органічна речовина містить 81,8% С та 18,2% Н. Густина речовини
дорівнює 1,96 г/л. Визначити молекулярну формулу речовини.
(Відповідь: С3Н8)
3 – Органічна речовина містить 85,7% С та 14,3% Н. Відносна густина пари
речовини за воднем 21. Визначити молекулярну формулу речовини.
(Відповідь: С3Н6)
4 – Органічна речовина містить 52,2% С, 13% Н та 34,8% О. Відносна густина
пари речовини за воднем 23. Визначити молекулярну формулу речовини.
(Відповідь: С2Н5ОН)
5 – Органічна речовина містить 37,5% С, 12,5% Н та 50% О. Відносна густина
пари речовини за повітрям 1,1. Визначити молекулярну формулу речовини.
(Відповідь: СН3ОН)
6 – Органічна речовина містить 26,10% С, 4,35% Н та 69,55% О. Відносна
густина пари речовини за воднем 23. Визначити молекулярну формулу
речовини.
(Відповідь: НСООН)
Перевірка якості оволодіння практичними навичками:
О.В.Березан. Органічна хімія.
Варіант 1 № 6,7,8 – стор.27
Варіант 2 № 2,4,5 – стор.28
Варіант 3 № 2,4,5 – стор.29
Варіант 4 № 2,4,5 – стор.31
Варіант 5 № 2,4,5 – стор.32
Практична робота №2
Тема: Складання формул та вивчення властивостей
ненасичених вуглеводнів
Мета: 1. Навчитися складати структурні формули ненасичених
вуглеводнів.
2. Навчитися давати назви ненасиченим вуглеводням за
систематичною номенклатурою, виходячи з їх структурних
формул.
3. Навчитися складати рівняння реакцій за участю ненасичених
вуглеводнів.
4. Розв’язувати розрахункові задачі.
Вихідні знання:
Алкени, алкадієни, алкіни: визначення, загальні формули, види ізомерії.
Електронна будова алкенів.
Хімічні властивості етилену.
Хімічні властивості пропену.
Електронна будова алкадієнів.
Хімічні властивості бутадієну – 1,3.
Хімічні властивості ацетилену.
Хімічні властивості пропіну.
Добування етилену та бутадієну.
Добування ацетилену та пропіну.
Хід роботи:
Назвати за систематичною номенклатурою наступні ненасичені вуглеводні:
а) СН2 = СН – СН – СН3 б) СН3 – СН2 – СН2 – СН – СН = СН2
׀ ׀
СН3 СН3
СН3
в) ׀ г) СН3 – СН2 – СН = СН – СН – СН3
СН3 – С – СН = СН2 ׀
׀ С2Н5
СН3
д) СН ≡ С – СН – СН3 е) СН2 = С = СН – СН – СН3
׀ ׀
СН3 СН3
ж) СН2 = С – СН2 – СН3 з) СН3 – СН – СН2 – С ≡ СН
׀ ׀
СН2 – СН3 С2Н5
и) СН3 к) СН3 – СН2 – СН – С ≡ С – СН3
׀ ׀
СН2 = С – СН – СН = СН2 С2Н5
׀
СН3
2. Скласти структурні формули ненасичених вуглеводнів:
а) 4 – метилпентен – 2
б) 2 – метилбутен – 2
в) 2,4 – диметилгексен – 2
г) 3 – етил – 4,4 – диметилгептен – 2
д) 3 – метилгептадієн – 1,5
е) 3,3 – диметилбутин – 1
ж) 2,3 – диметилгексадієн – 1,3
з) 2,2 – диметилгексин – 3
и) 2,2,5 – триметилгептин – 3
к) 3,4 – дихлор – 3 – етил – 4 – метилпентин – 1
3. Здійснити перетворення:
 а)
пропан етилен хлоретан
бутан
а)
пропан етилен хлоретан
бутан
дихлоретан
б) бутан бутен хлорбутан
дибромбутан
 диброметан
диброметан
в) етанол етилен етан
брометан
 етанол
етанол
 г)
метан
ацетилен етан етилен
хлоретан 1,1 – дихлоретан
г)
метан
ацетилен етан етилен
хлоретан 1,1 – дихлоретан
1,2 – дихлоретан
д) С3Н6Вr2 С3Н6 С3Н8 С3Н7Вr С6Н14 CO2
 бензол
бензол
 е)
кальцій
карбід ацетилен оцтовий альдегід
е)
кальцій
карбід ацетилен оцтовий альдегід
щавлева кислота
4. Розв’язати задачі:
– 4,2 г невідомого алкену приєднує 2,24 л хлору. Встановити формулу алкену.
– 14 г невідомого алкену приєднує 5,6 л водню. Встановити формулу алкену.
– 20 г невідомого алкіну приєднує 2 г водню. Встановити формулу алкіну.
– 10,8 г невідомого алкіну приєднує 14,6 г хлороводню. Встановити формулу
алкіну.
Перевірка якості оволодіння практичними навичками:
О.В.Березан. Органічна хімія.
Варіант 1 № 1,2а,б,4а,10 – стор.54
Варіант 2 № 1,2,4б, 10 – стор.56
Варіант 3 № 1,2,4б, 10 – стор.57
Варіант 4 № 1,2,4б, 10 – стор.58
Варіант 5 № 1,2,4а, 10 – стор.59
Практична робота №3
Тема: Складання формул та вивчення властивостей
ароматичних вуглеводнів
Мета: 1. Навчитися складати структурні формули ароматичних
вуглеводнів.
2. Навчитися давати назви ароматичним вуглеводням за
систематичною номенклатурою, виходячи з їх структурних
формул.
3. Навчитися складати рівняння реакцій за участю ароматичних
вуглеводнів.
4. Розв’язувати розрахункові задачі.
Вихідні знання:
Ароматичність, правило Хюккеля. Загальна формула гомологів бензолу, окремі представники (толуол, етилбензол, пропілбензол, кумол, ксилоли, стирол, тимол).
Електронна будова бензолу.
Хімічні властивості бензолу.
Електронна будова толуолу.
Хімічні властивості толуолу.
Хімічні властивості стиролу.
Правила орієнтації у бензольному ядрі.
Фізичні властивості та добування бензолу.
Добування толуолу.
Добування стиролу.
Хід роботи:
Назвати ароматичні вуглеводні та їх похідні:
С2Н5 С2Н5 СН3 СН3 С2Н5



 ׀
Br
׀
С3Н7
׀
С2Н5
׀
СН3
׀
׀
Br
׀
С3Н7
׀
С2Н5
׀
СН3
׀
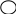
׀ ׀ ׀
С3Н7 СН3 С2Н5
Сl СН3
CH3 СH=CH2 СН3 ׀ СН3 ׀



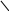
CH3 С2Н5 ׀ H3C СН3
С2Н5
3. Скласти структурні формули ароматичних сполук:
а) о – дибромбензол
б) п – дихлорбензол
в) 2 – метил – 2 – фенілбутан
г) 1 – хлор – 2,6 – диметилбензол
д) 1,3 – динітробензол
е) 2 – хлортолуол
ж) хлорметилбензол
з) 2,4,6 – тринітротолуол
и) 1 – фенілетанол – 1
к) 1,2 – дихлор – 1 – фенілетан
4. Здійснити перетворення:
а) метан → ацетилен → бензол → циклогексан → бензол
б) гексан → бензол → толуол → бензойна кислота
в) натрій ацетат → метан → ацетилен → бензол → нітробензол
г) етан → етилен → ацетилен → бензол → бромбензол
д) октан → етилбензол → стирол → полістирол
5. Познайомитися зі зразком розв’язування задач на виведення формул
органічних речовин за відомою масою, об’ємом або кількістю речовин –
продуктів згоряння.
Задача Вивести формулу органічної речовини, якщо при згорянні її масою 11,8 г утворилось 17,6 г вуглекислого газу, 0,5 моль води та 2,24 л азоту (н.у.) Відносна густина пари речовини за азотом дорівнює 2,11.
Дано: Розв’язування:
m реч
=
11,8 г
1.
Знаходимо
молярну масу речовини:
реч
=
11,8 г
1.
Знаходимо
молярну масу речовини:
m(СО2) = 17,6 г М = 28 D(N2) = 28 ∙ 2,11 = 59 г/моль
υ(H2O) = 0,5 моль m(С) = 51,89г
V(N2) = 2,24 л 2. Складаємо рівняння реакції горіння:
D(N2) = 2,11
ф ормула
–
? 11,8г 17,6
г 0,5 моль 2,24 л
ормула
–
? 11,8г 17,6
г 0,5 моль 2,24 л
CaHbOcNd + O2 = aCO2 + b/2 Н2О + с/2 N2
1 моль а моль b/2 моль с/2 моль
М=59 г/моль М=44г/моль Vm=22,4л/моль
M=59 г m=44a 0,5 b V =11,2c
3. Складаємо пропорції:
11,8 17,6 59 ∙ 17,6

 =
а = = 2
=
а = = 2
59 44а 11,8 ∙ 44
11,8 0,5 59 ∙ 0,5
= b = = 5
59 0,5 b 11,8 ∙ 0,5
11,8 2,24 59 ∙ 2,24
= с = = 1
59 11,2 с 11,8 ∙ 11,2
4. Визначаємо, чи був Оксиген у сполуці:
М(С2Н5N) = 12 ∙ 2 + 1 ∙ 5 + 14 = 43 г/моль
М = 59 г/моль 16 16
5
 9
– 43 = 16 d
= = = 1
9
– 43 = 16 d
= = = 1
Аr(О) 16
Відповідь: C2H5NО
6. Розв’язати задачі:
1 – При спалюванні 1,5 л газу утворилося 4,4 г вуглекислого газу та 2,7 г
води. Маса 1 л цього газу дорівнює 1,34 г/л. Визначити молекулярну
формулу газу. (Відповідь: С2Н6)
2 – При спалюванні 11,4 г органічної речовини утворилося 35,2 г
вуглекислого газу та 16,2 г води. Відносна густина пари речовини за
воднем 57. Визначити молекулярну формулу речовини.
(Відповідь: С8Н18)
3 – При спалюванні 7,2 г органічної речовини утворилося 22 г
вуглекислого газу та 10,8 г води. Відносна густина пари речовини за
воднем 36. Визначити молекулярну формулу речовини.
(Відповідь: С5Н12)
4 – При спалюванні 4,2 г органічної речовини утворилося 13,2 г
вуглекислого газу та 5,4 г води. Відносна густина пари речовини за
повітрям 2.9. Визначити молекулярну формулу речовини.
(Відповідь: С6Н12)
5 – При спалюванні 4,8 г органічної речовини утворилося 3,36 л
вуглекислого газу та 5,4 г води. Відносна густина пари речовини за
воднем 16. Визначити молекулярну формулу речовини.
(Відповідь: СН3ОН)
6 – При спалюванні 2,3 г органічної речовини утворилося 4,4 г
вуглекислого газу та 2,7 г води. Відносна густина пари речовини за
повітрям 1,59. Визначити молекулярну формулу речовини.
(Відповідь: С2Н5ОН)
Перевірка якості оволодіння практичними навичками:
О.В.Березан. Органічна хімія.
Варіант 1 № 9,10б,13 – стор.80
Варіант 2 № 8,10,14 – стор.81
Варіант 3 № 9,13,14 – стор.82
Варіант 4 № 8,11,14 – стор.83
Варіант 5 № 11,12,13 – стор.84
Практична робота №4
Тема: Властивості галогенопохідних вуглеводнів
Мета: 1. Навчитися складати структурні формули галогенопохідних
вуглеводнів і давати їм назви.
2. Навчитися характеризувати властивості галогенопохідних
вуглеводнів.
3. Навчитися добувати хлороформ та йодоформ.
4. Навчитися перевіряти доброякісність хлороформу.
4. Розв’язувати розрахункові задачі.
Вихідні знання:
Галогенопохідні вуглеводнів: визначення, класифікація.
Властивості хлоретану: – лужний гідроліз;
– амоноліз;
– дегідрохлорування;
– реакція Вюрца.
3. Властивості 1,2 – дихлоретану: – лужний гідроліз;
– амоноліз;
– дегідрохлорування;
– дехлорування.
4. Властивості 1,1 – дихлоретану: – лужний гідроліз;
– амоноліз;
– дегідрохлорування.
5. Властивості хлорбензолу: – лужний гідроліз;
– реакція Вюрца – Фіттіга.
6. Добування хлоретану: – з етану;
– з етилену;
– з етанолу.
7. Добування 2 – хлорпропану: – з пропанолу;
– з пропену;
– з ацетону.
8. Лужний гідроліз: – моногалогенопохідних;
– дигалогенопохідних гемінальних;
– дигалогенопохідних віцинальних;
– ароматичних галогенопохідних.
9. Реакції відщеплення атомів галогенів:
– від моногалогенопохідних;
– від дигалогенопохідних гемінальних;
– від дигалогенопохідних віцинальних;
– від дигалогенопохідних ізольованих.
10. Використання галогенопохідних у медицині.
Хід роботи:
1. Скласти структурні формули галогенопохідних вуглеводнів:
а) 1 – йод – 2,2 – диметилпропан;
б) 2 – бром – 2,3 – диметилбутан;
в) 1 – бром – 4 – метил – 2 – етилпентан;
г) 3 – йод – 2,4 – диметилпентан;
д) о – дибромбензол
е) п – дихлорбензол
ж) 1 – хлор – 2,6 – диметилбензол
з) 2 – хлортолуол
и) хлорметилбензол
к) 1,2 – дихлор – 1 – фенілетан
2. Скласти структурні формули ізомерів і назвати їх: С3Н6С12 та С3Н4С12
3. Скласти рівняння реакцій, що відбуваються при дії хлору на вуглеводні:
а) 2 – метилбутан;
б) тетраметилметан.
4. Скласти рівняння реакцій добування 2,4,6 – трибромтолуолу з метану.
5. Здійснити перетворення:
а) 4,4 – диметилпентен – 1 → 3,4 – дихлор – 2,2 – диметилпентан
б) 1 – бром – 3,4 – диметилпентан → 1,2 – дибром – 3,4 – диметилпентан
в) 1,1 – дибромбутан → 2,2 – дибромбутан
6. Розв’язати задачі:
1 – Яку масу тетрахлорметану можна добути з 40 г метану, якщо вихід
продукту реакції становить 80% ?
2 – Визначити масу тетрахлоретану, який можна добути під час хлорування
метану об’ємом 11,2 л молекулярним хлором об’ємом 56 л.
– При пропусканні етилену крізь бромну воду маса склянки з бромом зросла на 14 г. Яка маса диброметану утворилася?
– Яку масу бромної води з масовою часткою брому 1,6 % може знебарвити пропілен об’ємом 1,12 л?
– Визначити об’єм хлору, необхідний для добування 100 кг
гексахлорциклогексану з бензолу.
6 – При хлоруванні 39 г бензолу одержали 0,25 моль хлорбензолу. Визначити вихід продукту реакції.
7. Ознайомлення з правилами тб.
8. Добування та дослідження властивостей галогенопохідних вуглеводнів.
Обладнання:
мікроскоп, предметне скло;
пробірки, штативи, спиртівки;
реактиви: – органічні ( хлоралгідрат (тв), хлороформ, розчин резорцину,
розчин крохмалю, спирт);
– неорганічні ( 1н та 2н NaOH, 0,2н AgNO3, 0,5н КІ, розчин
йоду в КІ).
Дослід 1 Добування хлороформу з хлоралгідрату
У пробірку помістити 3 кристалика хлоралгідрату, 5 крапель розчину NaOH, нагріти. Зразу починають виділятися пари хлороформу, відчувається солодкуватий запах. Записати рівняння реакції.
Дослід 2 Якісна реакція на хлороформ
краплі резорцину, 4 краплі NaOH, 2 краплі хлороформу, нагріти. З’являється червоне забарвлення.
Дослід 3 Визначення доброякісності хлороформу
1 – Відкриття хлороводню:
2 краплі хлороформу, 3 краплі води, 1 краплю AgNO3. Поява білої муті свідчить про наявність хлороводню у хлороформі. Записати рівняння реакції.
2 – Відкриття вільного хлору:
На повітрі хлороформ під впливом світла і кисню частково окислюється з утворенням фосгену та хлороводню:
2СНС13 + О2 → 2СОС12 + 2НС1
Фосген у свою чергу також окислюється, виділяючи вільний хлор:
2СОС12 + О2 → 2С12 + 2СО2
Окислення хлороформу можна запобігти, якщо зберігати його у темних склянках з притертою пробкою.
3 краплі хлороформу, 5 крапель води, 1 крапля КІ, збовтати. Нижній шар хлороформу забарвлюється у рожевий колір (розчин йоду в хлороформі дає рожевий колір). Якщо забарвлення слабо виражене, додати 1 краплю крохмалю. Синій колір підтверджує присутність йоду. Записати рівняння реакції.
Дослід 4 Добування йодоформу з етилового спирту
1 крапля етилового спирту, 3 краплі розчину йоду в КІ, 3 краплі NaOH, нагріти, але не до кипіння. З’являється білувата муть, з якої поступово при охолодженні утворюються кристали йодоформу. Якщо муть розчиняється, додати ще 3 – 4 краплі йоду до теплої реакційної суміші, перемішати. 2 краплі осаду перенести на предметне скло і розглянути під мікроскопом. Кристали йодоформу мають вид шестикутників або шести кінцевих сніжинок.
Перевірка якості оволодіння практичними навичками
Варіант 1
1. Назвати речовину: СН3 – СН – СН – СН2 – СН3
׀ ׀
С1 СН3
2. Скласти структурну формулу 2 – бром – 3 – хлоргептану.
3. Закінчить рівняння реакції:
C2H4Br2 + Br2 →
4. Визначити молекулярну формулу речовини, яка містить 45,85% Карбону, 3,18% Гідрогену та 50,96% Брому. Густина пари речовини за воднем 78,5. Скласти структурну формулу та назвати речовину.
Варіант 2
1. Назвати речовину: СН3 – СН – СН2
׀ ׀
С1 СН3
2. Скласти структурну формулу 2 – хлор – 2,3 – диметилпентану.
3. Закінчить рівняння реакції:
CHBr3 + Br2 →
4. Визначити молекулярну формулу речовини, яка містить 24,24% Карбону, 4,04% Гідрогену та 71,72% Хлору. Густина пари речовини за повітрям 3,41. Скласти структурну формулу та назвати речовину.
Варіант 3
1. Назвати речовину: СН2 – СН – СН – СН3
׀ ׀ ׀
СН2 С1 СН3
׀
СН3
2. Скласти структурну формулу 2,2 – дибромгексану.
3. Закінчить рівняння реакції:
CН3 – СН2 – СН = СН2 + НBr →
4. Визначити молекулярну формулу речовини, яка містить 10,04% Карбону, 0,84% Гідрогену та 89,12% Хлору. Густина пари речовини за воднем 59,75. Назвати речовину.
Варіант 4
1. Назвати речовину: СН3 – СН – СН – СН2 – СН3
׀ ׀
С1 СН2 – СН3
2. Скласти структурну формулу 4 – бром – 4 – метилнонану.
3. Закінчить рівняння реакції:
 hυ
hυ
 +
С12
→
+
С12
→
4. Визначити молекулярну формулу речовини, яка містить 3,05% Карбону, 0,25% Гідрогену та 96,70% Йоду. Густина пари речовини за воднем 197. Назвати речовину.
Варіант 5
1. Назвати речовину: СН3 – СН – СН – СН3
׀ ׀
Br Br
2. Скласти структурну формулу 2 – бром – 4,4 – диметилпентану.
3. Закінчить рівняння реакції:
FeBr3
+ Br 2 →
4. Визначити молекулярну формулу речовини, яка містить 38,4% Карбону, 4,8% Гідрогену та 56,8% Хлору. Густина пари речовини за повітрям 2,155. Скласти структурну формулу та назвати речовину.
Практична робота №5
Тема: Властивості спиртів та фенолів
Мета: 1. Навчитися складати структурні формули спиртів та фенолів
і давати їм назви.
2. Навчитися характеризувати властивості спиртів та фенолів.
3. Дослідити властивості спиртів та фенолів.
4. Навчитися виконувати якісні реакції на спирти та феноли.
Вихідні знання:
Спирти: визначення, класифікація.
Хімічні властивості етанолу.
Хімічні властивості пропанолу – 1.
Хімічні властивості пропанолу – 2.
Добування метанолу та етанолу.
Хімічні властивості гліцерину.
Добування етиленгліколю та гліцерину.
Хімічні властивості фенолу.
Добування фенолу.
Використання спиртів та фенолів у медицині.
Хід роботи:
Назвати за систематичною номенклатурою наступні спирти:
СН3
׀
а) СН3 – СН – С – ОН б) СН3 – СН – СН – СН2 – СН3
׀ ׀ ׀ ׀
СН3 СН3 СН3 ОН
СН3 СН3
׀ ׀
в) СН3 – С – СН2 – ОН г) СН2 – СН – СН – СН3
׀ ׀ ׀
СН3 ОН СН3
д) СН3 – СН – СН2 е) СН2 – СН2 – СН2
׀ ׀ ׀ ׀
ОН ОН ОН ОН
2. Назвати за систематичною номенклатурою наступні феноли:
СН3 ОН




 ОН
НО СН3
׀
׀
СН3
ОН
НО СН3
׀
׀
СН3
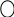
а) б) в) г)

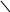

С2Н5 СН3 ОН H3С
3. Скласти структурні формули спиртів та фенолів:
а) 2 – метилгексанол – 2
б) 2, 2 – диметилбутанол –1
в) 2 – метилбутандіол – 1, 2
г) 2 – метилпентанол – 1
д) бутантетрол – 1,2,3,4
е) 2 – фенілгександіол – 1,2
ж) 1 – фенілетанол – 1
з) 5 – етил – 2,4 – диметилфенол
и) 2,6 – диетилфенол
к) 2,6 – дигідрокситолуол
4. Здійснити перетворення:
а) етилен → хлоретан → етанол → етилен → вуглекислий газ
б) етилен → етанол → йодетан → бутан → бутанол – 1
в) кальцій карбід → ацетилен → етилен → етиленгліколь → калій гліколят
г) пропан → пропен → гліцерин → нітрогліцерин
д) фенол → натрій фенолят → фенол → о – хлорфенол
