
- •Особливості органічних сполук
- •Види хімічних формул
- •Теорія хімічної будови органічних речовин о.М.Бутлерова
- •Класифікація органічних сполук
- •Класифікація вуглеводнів
- •Види ізомерії
- •Електронна природа хімічних зв’язків
- •Типи розриву зв’язків
- •Типи реагентів
- •Хімічні властивості метану
- •Добування метану
- •Хімічні властивості етану
- •Хімічні властивості пропану
- •Хімічні властивості н–бутану
- •Хімічні властивості 2 – метилпропану
- •Добування алканів
- •Використання алканів у медицині
- •Хімічні властивості малих циклів
- •Хімічні властивості великих циклів
- •Добування циклоалканів
- •Використання циклоалканів у медицині
- •Хімічні властивості етилену
- •Хімічні властивості пропілену
- •Добування пропілену
- •Алкадієни
- •Хімічні властивості 1,3 – бутадієну
- •Хімічні властивості ізопрену
- •Добування алкадієнів
- •Добування ацетилену
- •Добування ацетилену
- •Добування інших алкінів
- •Розпізнавання алканів, алкенів, алкінів Арени
- •Добування бензолу
- •Добування бензолу
- •Гомологи бензолу
- •Орієнтуюча дія замісників у бензольному кільці
- •Добування толуолу
- •Хімічні властивості стиролу
- •Добування стиролу
- •Добування толуолу
- •Використання аренів у медицині
- •Порівняльна характеристика вуглеводнів
- •Галогенопохідні вуглеводнів
- •Хімічні властивості галогенопохідних
- •Добування галогенопохідних
- •Використання галогенопохідних у медицині
- •Одноатомні насичені спирти
- •Хімічні властивості метанолу
- •Хімічні властивості етанолу
- •Хімічні властивості пропанолу–1
- •Використання Вввввв
- •Добування фенолу
- •Етери ( прості ефіри )
- •Карбонільні сполуки
- •Хімічні властивості альдегідів
- •1. Реакції окислення:
- •2. Реакції карбонільної групи:
- •3. Реакції радикалу:
- •Добування альдегідів
- •Використання альдегідів у медицині
- •Хімічні властивості кетонів
- •2. Реакції карбонільної групи:
- •3. Реакції радикалу:
- •Добування кетонів
- •Хімічні властивості оцтової кислоти
- •Хімічні властивості мурашиної кислоти
- •Похідні карбонових кислот
- •Ненасичені кислоти
- •Ароматичні кислоти
- •Двохосновні карбонові кислоти
- •Гідроксикислоти
- •Оптична ізомерія
- •Окремі представники гідроксикислот
- •Фенолокислоти
- •Препарати саліцилової кислоти
- •Вуглеводи
- •Гексози с6н12о6
- •Добування глюкози – фотосинтез
- •Хімічні властивості глюкози
- •Реакція утворення етерів та естерів:
- •Сахароза
- •Мальтоза
- •Лактоза
- •Крохмаль
- •Целюлоза (клітковина)
- •Використання вуглеводів у медицині
- •Лікарські препарати – похідні ароматичних амінів
- •Сульфаніламідні препарати
- •Амінокислоти
- •Використання амінокислот у медицині
- •Похідні ароматичних амінокислот
- •Аміди кислот
- •Аміди вугільної кислоти
- •Похідні сечовини
- •Діазосполуки
- •Азосполуки
- •Забарвлені речовини та барвники
- •Гетероциклічні сполуки
- •П’ятичленні гетероцикли з одним гетероатомом
- •П’ятичленні гетероцикли з двома гетероатомами
- •Шестичленні гетероцикли з одним гетероатомом
- •Шестичленні гетероцикли з двома гетероатомами
- •Конденсовані гетероцикли
- •Ізопреноїди
- •Лімонен
- •Алкалоїди
- •Виділення алкалоїдів з рослинної сировини
- •1. Екстракція у вигляді солей.
- •2. Екстракція у вигляді основ.
- •Загальноалкалоїдні реакції
- •Класифікація алкалоїдів
Типи розриву зв’язків
гомолітичний розрив (радикальний):


 А
׃
В
→ А · + · В
А
׃
В
→ А · + · В
Утворюються вільні радикали.
hυ
П риклади:
Cl
׃
Cl
Cl
· + · Cl
риклади:
Cl
׃
Cl
Cl
· + · Cl
H H
H ׃C ׃ H + · Cl H ׃C · + H:Cl
H H
гетеролітичний розрив (іонний):
А ׃ В → А+ + : В–
Утворюються іони.
П риклади:
Н
׃Cl
→ Н+
+ : Cl
–
риклади:
Н
׃Cl
→ Н+
+ : Cl
–
Н ׃ОН → Н+ + : ОН–
Типи реагентів
радикали – частинки з неспареним електроном (не мають заряда):
Cl · Н3С·
електрофіли – це позитивні іони та нейтральні частинки, що мають вільну орбіталь:
Н+ NO2+ CH3+
нуклеофіли – це негативні іони або нейтральні молекули, що мають пару електронів на зовнішньому рівні:
Cl – ОН– Н2О: : NН3
Вуглеводні
це органічні сполуки, що складаються тільки з атомів С та Н.
Алкани – це вуглеводні з відкритим ланцюгом, в якому між атомами С тільки одинарні зв’язки, а всі інші валентності насичені атомами Н ( насичені вуглеводні, парафіни, гомологічний ряд метану).
Загальна формула СnH2n+2.
Гомологічний ряд алканів:
СН4 метан
С2Н6 етан СН3 – СН3
С3Н8 пропан СН3 – СН2 – СН3
С4Н10 бутан СН3 – СН2 – СН2 – СН3
С5Н12 пентан
С6Н14 гексан
С7Н16 гептан
С8Н18 октан
С9Н20 нонан
С10Н22 декан
Ізомерія – за вуглецевим скелетом:
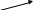 CH3
– CH2
– CH2
– СН3
н–бутан
CH3
– CH2
– CH2
– СН3
н–бутан
С4Н10
СН3 – СН – СН3 2–метилпропан
׀
СН3
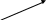 CH3
– CH2
– CH2
– СН2
–
СН3
н–пентан
CH3
– CH2
– CH2
– СН2
–
СН3
н–пентан


 С5Н12
СН3
– СН – СН2
– СН3
2–метилбутан
С5Н12
СН3
– СН – СН2
– СН3
2–метилбутан
׀
СН3
СН3
׀
СН3 – С – СН3 2,2–диметилпропан
׀
СН3
Електронна будова:
тип гібридизації sp3
валентний кут 109°28′
форма молекули тетраедрична
хімічні зв’язки – одинарні, σ – зв’язки
довжина зв’язку С – С 0,154 нм
Фізичні властивості: С1 – С4 гази
С5 – С15 рідини
С16 і більше – тверді
Без кольору та запаху, нерозчинні у воді.
