
- •Особливості органічних сполук
- •Види хімічних формул
- •Теорія хімічної будови органічних речовин о.М.Бутлерова
- •Класифікація органічних сполук
- •Класифікація вуглеводнів
- •Види ізомерії
- •Електронна природа хімічних зв’язків
- •Типи розриву зв’язків
- •Типи реагентів
- •Хімічні властивості метану
- •Добування метану
- •Хімічні властивості етану
- •Хімічні властивості пропану
- •Хімічні властивості н–бутану
- •Хімічні властивості 2 – метилпропану
- •Добування алканів
- •Використання алканів у медицині
- •Хімічні властивості малих циклів
- •Хімічні властивості великих циклів
- •Добування циклоалканів
- •Використання циклоалканів у медицині
- •Хімічні властивості етилену
- •Хімічні властивості пропілену
- •Добування пропілену
- •Алкадієни
- •Хімічні властивості 1,3 – бутадієну
- •Хімічні властивості ізопрену
- •Добування алкадієнів
- •Добування ацетилену
- •Добування ацетилену
- •Добування інших алкінів
- •Розпізнавання алканів, алкенів, алкінів Арени
- •Добування бензолу
- •Добування бензолу
- •Гомологи бензолу
- •Орієнтуюча дія замісників у бензольному кільці
- •Добування толуолу
- •Хімічні властивості стиролу
- •Добування стиролу
- •Добування толуолу
- •Використання аренів у медицині
- •Порівняльна характеристика вуглеводнів
- •Галогенопохідні вуглеводнів
- •Хімічні властивості галогенопохідних
- •Добування галогенопохідних
- •Використання галогенопохідних у медицині
- •Одноатомні насичені спирти
- •Хімічні властивості метанолу
- •Хімічні властивості етанолу
- •Хімічні властивості пропанолу–1
- •Використання Вввввв
- •Добування фенолу
- •Етери ( прості ефіри )
- •Карбонільні сполуки
- •Хімічні властивості альдегідів
- •1. Реакції окислення:
- •2. Реакції карбонільної групи:
- •3. Реакції радикалу:
- •Добування альдегідів
- •Використання альдегідів у медицині
- •Хімічні властивості кетонів
- •2. Реакції карбонільної групи:
- •3. Реакції радикалу:
- •Добування кетонів
- •Хімічні властивості оцтової кислоти
- •Хімічні властивості мурашиної кислоти
- •Похідні карбонових кислот
- •Ненасичені кислоти
- •Ароматичні кислоти
- •Двохосновні карбонові кислоти
- •Гідроксикислоти
- •Оптична ізомерія
- •Окремі представники гідроксикислот
- •Фенолокислоти
- •Препарати саліцилової кислоти
- •Вуглеводи
- •Гексози с6н12о6
- •Добування глюкози – фотосинтез
- •Хімічні властивості глюкози
- •Реакція утворення етерів та естерів:
- •Сахароза
- •Мальтоза
- •Лактоза
- •Крохмаль
- •Целюлоза (клітковина)
- •Використання вуглеводів у медицині
- •Лікарські препарати – похідні ароматичних амінів
- •Сульфаніламідні препарати
- •Амінокислоти
- •Використання амінокислот у медицині
- •Похідні ароматичних амінокислот
- •Аміди кислот
- •Аміди вугільної кислоти
- •Похідні сечовини
- •Діазосполуки
- •Азосполуки
- •Забарвлені речовини та барвники
- •Гетероциклічні сполуки
- •П’ятичленні гетероцикли з одним гетероатомом
- •П’ятичленні гетероцикли з двома гетероатомами
- •Шестичленні гетероцикли з одним гетероатомом
- •Шестичленні гетероцикли з двома гетероатомами
- •Конденсовані гетероцикли
- •Ізопреноїди
- •Лімонен
- •Алкалоїди
- •Виділення алкалоїдів з рослинної сировини
- •1. Екстракція у вигляді солей.
- •2. Екстракція у вигляді основ.
- •Загальноалкалоїдні реакції
- •Класифікація алкалоїдів
Гетероциклічні сполуки
це ароматичні сполуки, у циклах яких крім атомів С є атоми інших елементів (N, S, O).
Класифікація гетероциклів:
1 – за величиною циклу – трьохчленні;
– чотирьохчленні;
– п’ятичленні;
– шестичленні;
2 – за видом гетероатому – нітрогеновмісні;
– оксигеновмісні;
– сульфуровмісні.
Ароматичність:
За правилом Хюккеля 4 · 1 + 2 = 6 електронів
Н


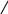

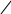
 НС – СН
НС – СН С
НС – СН
НС – СН С
• • • • •


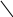
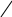 НС•
•СН
НС•
•СН НС• •СН
НС•
•СН
НС•
•СН НС• •СН
•• •• ׀ ׀

 N
O
HC•
•CH
N
O
HC•
•CH
H •
N
Кислотно – основні властивості нітрогеновмісних гетероциклів:
1 – кислотні властивості (пірольний N)
Пірольний N – це атом N, що надає в ароматичну систему пару електронів і
утворює з іншими атомами тільки σ – зв’язки (містить Н).

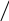
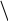
+ NaOH → + H2O
N N
H Na
2 – основні властивості (піридиновий N)
Піридиновий N – це атом N, що надає в ароматичну систему один
електрон, а пара електронів залишається вільною (не містить Н).



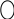
+ HCl → Cl–
N N+
H
П’ятичленні гетероцикли з одним гетероатомом

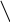
О S N
H
фуран тіофен пірол
Добування – синтез Юр’єва:
+ H2S

+ H2O
O S



 +
NH3
+ H2S
+
NH3
+ H2S
+ H2O + NH3
N
H
Фуран

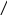

1 – відновлення: + 2Н2 → тетрагідрофуран
О О
2 – заміщення: + Cl2 → + HCl
Cl
О О
Реакції заміщення відбуваються в 2 – положенні, утворюється 2 – хлорфуран.
+ [ HNO3 ] → + H2O
NO2
О О
+ [ H2SO4 ] → + H2O
SO3H
О О
Використання у медицині:
Ядро нітрофурану міститься в молекулах багатьох бактерицидних препаратів нітрофуранового ряду. Загальна формула фурациліну та фуразолідону:
О2N – – CH = R
О
Тіофен
1 – відновлення: + 2Н2 → тетрагідротіофен
S S
2 – заміщення: + Cl2 → + HCl
Cl
S S
+ HNO3 → + H2O
NO2
S S
+ H2SO4 → + H2O
SO3H
S S
Використання у медицині:
Похідні тіофену містяться у препараті іхтіол, що використовується для лікування шкірних хвороб.
Пірол
+H2 +H2
1 – відновлення: → →
N N N
H H H
піролін піролідин
2 – заміщення: + Cl2 → + HCl
Cl
N N
H H
+ [ HNO3 ] → + H2O
NO2
N N
H H
+ [ H2SO4 ] → + H2O
SO3H
N N
H H
3 – кислотні властивості:
+ NaOH → + H2O
N N
H Na натрій піролід
Використання у медицині:
Ядра піролу та продуктів його відновлення входять до складу хлорофілу, гемоглобіну, вітаміну В12.
У присутності сильних мінеральних кислот фуран та пірол руйнуються. Ця особливість получила назву ацидофобність (або кислотобоязнь). Враховуючи це нітрування та сульфування цих гетероциклів проводять не самими кислотами, а їх продуктами:
HNO3 → CH3COONO2 ацетилнітрат
H2SO4 → C5H5NSO3 піридинсульфат
Індол


За хімічними властивостями схожий на пірол.


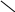
N
H
1 – відновлення:
+ Н2 →

N
N Н 2,3 – дигідроіндол
H
2 – заміщення (утворюються 3 – похідні):
Cl (NO2; SO3H)
N
H
3 – кислотні властивості:
+ NaOH →
N
N Na натрій індолід
H
Використання у медицині:
Ядро індолу входить до складу алкалоїдів:
Резерпін – знижує кров’яний тиск та діє заспокійливо на центральну нервову систему. Використовується для лікування гіпертонічної хвороби та психічних розладів.
Стрихнін – збуджує нервову систему, тонізує скелетну мускулатуру, м’язи серця. Використовується як тонізуючий засіб.
