
- •Особливості органічних сполук
- •Види хімічних формул
- •Теорія хімічної будови органічних речовин о.М.Бутлерова
- •Класифікація органічних сполук
- •Класифікація вуглеводнів
- •Види ізомерії
- •Електронна природа хімічних зв’язків
- •Типи розриву зв’язків
- •Типи реагентів
- •Хімічні властивості метану
- •Добування метану
- •Хімічні властивості етану
- •Хімічні властивості пропану
- •Хімічні властивості н–бутану
- •Хімічні властивості 2 – метилпропану
- •Добування алканів
- •Використання алканів у медицині
- •Хімічні властивості малих циклів
- •Хімічні властивості великих циклів
- •Добування циклоалканів
- •Використання циклоалканів у медицині
- •Хімічні властивості етилену
- •Хімічні властивості пропілену
- •Добування пропілену
- •Алкадієни
- •Хімічні властивості 1,3 – бутадієну
- •Хімічні властивості ізопрену
- •Добування алкадієнів
- •Добування ацетилену
- •Добування ацетилену
- •Добування інших алкінів
- •Розпізнавання алканів, алкенів, алкінів Арени
- •Добування бензолу
- •Добування бензолу
- •Гомологи бензолу
- •Орієнтуюча дія замісників у бензольному кільці
- •Добування толуолу
- •Хімічні властивості стиролу
- •Добування стиролу
- •Добування толуолу
- •Використання аренів у медицині
- •Порівняльна характеристика вуглеводнів
- •Галогенопохідні вуглеводнів
- •Хімічні властивості галогенопохідних
- •Добування галогенопохідних
- •Використання галогенопохідних у медицині
- •Одноатомні насичені спирти
- •Хімічні властивості метанолу
- •Хімічні властивості етанолу
- •Хімічні властивості пропанолу–1
- •Використання Вввввв
- •Добування фенолу
- •Етери ( прості ефіри )
- •Карбонільні сполуки
- •Хімічні властивості альдегідів
- •1. Реакції окислення:
- •2. Реакції карбонільної групи:
- •3. Реакції радикалу:
- •Добування альдегідів
- •Використання альдегідів у медицині
- •Хімічні властивості кетонів
- •2. Реакції карбонільної групи:
- •3. Реакції радикалу:
- •Добування кетонів
- •Хімічні властивості оцтової кислоти
- •Хімічні властивості мурашиної кислоти
- •Похідні карбонових кислот
- •Ненасичені кислоти
- •Ароматичні кислоти
- •Двохосновні карбонові кислоти
- •Гідроксикислоти
- •Оптична ізомерія
- •Окремі представники гідроксикислот
- •Фенолокислоти
- •Препарати саліцилової кислоти
- •Вуглеводи
- •Гексози с6н12о6
- •Добування глюкози – фотосинтез
- •Хімічні властивості глюкози
- •Реакція утворення етерів та естерів:
- •Сахароза
- •Мальтоза
- •Лактоза
- •Крохмаль
- •Целюлоза (клітковина)
- •Використання вуглеводів у медицині
- •Лікарські препарати – похідні ароматичних амінів
- •Сульфаніламідні препарати
- •Амінокислоти
- •Використання амінокислот у медицині
- •Похідні ароматичних амінокислот
- •Аміди кислот
- •Аміди вугільної кислоти
- •Похідні сечовини
- •Діазосполуки
- •Азосполуки
- •Забарвлені речовини та барвники
- •Гетероциклічні сполуки
- •П’ятичленні гетероцикли з одним гетероатомом
- •П’ятичленні гетероцикли з двома гетероатомами
- •Шестичленні гетероцикли з одним гетероатомом
- •Шестичленні гетероцикли з двома гетероатомами
- •Конденсовані гетероцикли
- •Ізопреноїди
- •Лімонен
- •Алкалоїди
- •Виділення алкалоїдів з рослинної сировини
- •1. Екстракція у вигляді солей.
- •2. Екстракція у вигляді основ.
- •Загальноалкалоїдні реакції
- •Класифікація алкалоїдів
Азосполуки
– N
=
N
–
це ароматичні сполуки, що містять азогрупу:
В основі азосполук міститься ядро азобензолу:
– N = N –
Азосполуки є барвниками:
CH3
– N = N – – N
CH3
диметиламіноазобензол
(жовтий барвник)
– N = N – – ОН
гідроксиазобензол
(оранжевий барвник)
Забарвлені речовини та барвники
Хромофори – це групи атомів, що зумовлюють забарвлення речовини:
сильні хромофори – N = N – азогрупа
– N = O нітрозогрупа
Наявність в молекулі хоча б однієї такої групи робить речовину забарвленою.
с лабкі хромофори С = О карбоніл
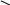
С = С етеніл
Наявність однієї групи не дає речовині кольору (наприклад, ацетон та етилен – безбарвні). Але декілька груп роблять речовину кольоровою. Наприклад, хінон (жовтого кольору) містить 4 групи – два карбоніла та два етеніла:
 СН
= СН
СН
= СН
О = С С = О або О = = О
СН = СН
Але не кожна забарвлена речовина може бути барвником, а лише в тому випадку, якщо вона закріплюється на матеріалі (волокні, шкірі, гумі). Щоб забарвлена речовина була барвником, вона повинна, крім хромофорів, містити ауксохроми.
Ауксохроми – це групи атомів, які самі по собі (у відсутності хромофорів) не здатні викликати забарвлення, але у присутності хромофорів посилюють їх дію або змінюють відтінок кольору:
CH3
 основні
ауксохроми –
NH2
– N
основні
ауксохроми –
NH2
– N
. CH3
аміногрупа диметиламіногрупа
кислотні ауксохроми – ОН гідроксогрупа
– СООН карбоксильна група
– SO3H сульфогрупа
Якщо переважають основні групи, то барвник називають основним барвником; якщо кислотні – кислотним барвником.
Відтінок кольору азобарвників сильно змінюється залежно від реакції середовища. Це дозволяє використовувати їх як кислотно – лужні індикатори.
Метиловий оранжевий
CH3 H+
HO3S – – N = N – – N
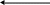 CH3
CH3
жовте забарвлення OH–
+ CH3
HO3S – – N – N = = N
׀ CH3
Н
червоне забарвлення
Зміна кольору пов’язана з тим, що одна хромофорна група (азогрупа – N = N –) зникає, але з’являється інша – хіноїдне ядро. Ця реакція оборотна: при додаванні лугу метиловий оранжевий знов стає жовтим.
