
- •Особливості органічних сполук
- •Види хімічних формул
- •Теорія хімічної будови органічних речовин о.М.Бутлерова
- •Класифікація органічних сполук
- •Класифікація вуглеводнів
- •Види ізомерії
- •Електронна природа хімічних зв’язків
- •Типи розриву зв’язків
- •Типи реагентів
- •Хімічні властивості метану
- •Добування метану
- •Хімічні властивості етану
- •Хімічні властивості пропану
- •Хімічні властивості н–бутану
- •Хімічні властивості 2 – метилпропану
- •Добування алканів
- •Використання алканів у медицині
- •Хімічні властивості малих циклів
- •Хімічні властивості великих циклів
- •Добування циклоалканів
- •Використання циклоалканів у медицині
- •Хімічні властивості етилену
- •Хімічні властивості пропілену
- •Добування пропілену
- •Алкадієни
- •Хімічні властивості 1,3 – бутадієну
- •Хімічні властивості ізопрену
- •Добування алкадієнів
- •Добування ацетилену
- •Добування ацетилену
- •Добування інших алкінів
- •Розпізнавання алканів, алкенів, алкінів Арени
- •Добування бензолу
- •Добування бензолу
- •Гомологи бензолу
- •Орієнтуюча дія замісників у бензольному кільці
- •Добування толуолу
- •Хімічні властивості стиролу
- •Добування стиролу
- •Добування толуолу
- •Використання аренів у медицині
- •Порівняльна характеристика вуглеводнів
- •Галогенопохідні вуглеводнів
- •Хімічні властивості галогенопохідних
- •Добування галогенопохідних
- •Використання галогенопохідних у медицині
- •Одноатомні насичені спирти
- •Хімічні властивості метанолу
- •Хімічні властивості етанолу
- •Хімічні властивості пропанолу–1
- •Використання Вввввв
- •Добування фенолу
- •Етери ( прості ефіри )
- •Карбонільні сполуки
- •Хімічні властивості альдегідів
- •1. Реакції окислення:
- •2. Реакції карбонільної групи:
- •3. Реакції радикалу:
- •Добування альдегідів
- •Використання альдегідів у медицині
- •Хімічні властивості кетонів
- •2. Реакції карбонільної групи:
- •3. Реакції радикалу:
- •Добування кетонів
- •Хімічні властивості оцтової кислоти
- •Хімічні властивості мурашиної кислоти
- •Похідні карбонових кислот
- •Ненасичені кислоти
- •Ароматичні кислоти
- •Двохосновні карбонові кислоти
- •Гідроксикислоти
- •Оптична ізомерія
- •Окремі представники гідроксикислот
- •Фенолокислоти
- •Препарати саліцилової кислоти
- •Вуглеводи
- •Гексози с6н12о6
- •Добування глюкози – фотосинтез
- •Хімічні властивості глюкози
- •Реакція утворення етерів та естерів:
- •Сахароза
- •Мальтоза
- •Лактоза
- •Крохмаль
- •Целюлоза (клітковина)
- •Використання вуглеводів у медицині
- •Лікарські препарати – похідні ароматичних амінів
- •Сульфаніламідні препарати
- •Амінокислоти
- •Використання амінокислот у медицині
- •Похідні ароматичних амінокислот
- •Аміди кислот
- •Аміди вугільної кислоти
- •Похідні сечовини
- •Діазосполуки
- •Азосполуки
- •Забарвлені речовини та барвники
- •Гетероциклічні сполуки
- •П’ятичленні гетероцикли з одним гетероатомом
- •П’ятичленні гетероцикли з двома гетероатомами
- •Шестичленні гетероцикли з одним гетероатомом
- •Шестичленні гетероцикли з двома гетероатомами
- •Конденсовані гетероцикли
- •Ізопреноїди
- •Лімонен
- •Алкалоїди
- •Виділення алкалоїдів з рослинної сировини
- •1. Екстракція у вигляді солей.
- •2. Екстракція у вигляді основ.
- •Загальноалкалоїдні реакції
- •Класифікація алкалоїдів
Використання амінокислот у медицині
γ – Аміномасляна кислота (ГАМК, аміналон) – для лікування нервово – психічних захворювань, при ослабленні пам’яті, порушенні мозкового кровообігу:
NH2 – CH2 – CH2 – CH2 – COOH
ε – Амінокапронова кислота – кровоспинний засіб:
NH2 – CH2 – CH2 – CH2 – СН2 – СН2 – COOH
Глютамінова кислота – для лікування психічних захворювань:
НООС – СН2 – СН2 – СН – СООН
׀
NH2
S – вмісні амінокислоти – для профілактики та лікування променевої хвороби:
HS – CH2 – CH – COOH CH3 – S – CH2 – CH2 – CH – COOH
׀ ׀
NH2 NH2
цистеїн метіонін
Похідні ароматичних амінокислот
NH2
׀
׀ COOH
пара – амінобензойна кислота
NH2 NH2
׀ ׀
 ׀
׀ C2H5
׀
׀ C2H5
COO – C2H5 COO – CH2 – CH2 – N
C2H5
анестезин новокаїн
Мають анестезуючу дію.
Білки
це природні біополімери, що складаються з α – амінокислот.
Будова білків:
Первинна структура – це певна послідовність амінокислот, зв’язаних
пептидними зв’язками. Первинна будова руйнується
тільки в результаті гідролізу білків.
Вторинна структура – це спіральна форма поліпептидних ланцюгів,
що утворюється в результаті дії міжмолекулярних
водневих зв’язків.
Третинна структура – це скручування спіралі в клубок, що утворюється за рахунок водневих зв’язків, дисульфідних містків (між радикалами цистеїну) та гідрофобної взаємодії (між неполярними радикалами амінокислот – валіну, лейцину, ізолейцину, фенілаланіну, триптофану).
Четвертинна структура – це біологічні комплекси декількох асоційованих
білків (наприклад, молекула гемоглобіну складається з
4 субодиниць, кожна з яких має три попередні
структури).
Властивості білків:
Форма молекули: – глобулярна (білки крові);
– фібрилярна (білки м’язів, волосся, кісток тощо).
Заряд молекули –залежить від співвідношення позитивно та негативно заряджених полярних амінокислот та від середовища, в якому знаходиться білок:



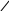
 + OH–
OH–
+ OH–
OH–
R


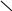 R
R → R
R
R → R
+ H+ → H+
позитивний заряд негативний заряд
Ізоелектрична точка (рІ) – це таке значення рН розчину, при якому білок втрачає свій заряд.
Розчинність – визначається наявністю двох факторів: водної оболонки та заряду молекули.
Оборотне осадження – це втрата розчинності:
висолювання – руйнування водневої оболонки під дією концентрованих розчинів солей лужних металів та амонію;
зміна рН розчину до рІ – втрата заряду білкової молекули.
Після усунення факторів, що призвели до осадження білка, він знов стає розчинним.
Необоротне осадження (денатурація) – руйнування у білків вторинної, третинної та четвертинної структури під дією нагрівання, радіації, сильних кислот і лугів, солей важких металів.
Гідроліз – розклад білків до амінокислот. Відбувається в організмі під дією ферментів – протеаз: пепсин, трипсин, хімотрипсин.
Кольорові реакції:
біуретова реакція – якісна реакція на пептидні зв’язки. Під дією лугу та кількох крапель розчину CuSO4 утворюється характерне фіолетове забарвлення;
ксантопротеїнова реакція – якісна реакція на ароматичні амінокислоти. При дії на білок концентрованої нітратної кислоти виникає жовте забарвлення, яке при додаванні лугу змінюється на оранжеве.
Біологічна роль білків:
Структурна функція – білки є будівельним матеріалом клітини.
Транспортна функція – гемоглобін переносить кисень та вуглекислий газ, ліпопротеїди – жири, трансферази – залізо тощо.
Енергетична функція – при розкладі білків виділяється енергія, але організм використовує білки як джерело енергії тільки при недостачі жирів та вуглеводів.
Захисна функція – на дію хвороботворних мікроорганізмів організм відповідає утворенням антитіл, які за своєю природою є білками.
Каталітична функція – всі реакції в організмі відбуваються за участю ферментів.
Регуляторна функція – деякі гормони є білками (інсулін, гормони гіпофізу).
Використання білкових речовин у медицині:
Інсулін – знижує рівень глюкози, використовується при цукровому діабеті.
Окситоцин – викликає скорочення гладкої мускулатури, особливо мускулатури матки. Використовується в акушерстві та гінекології.
Антибіотики граміцидин, поліміксин – мають здатність убивати або вибірково пригнічувати ріст збудників захворювань.
