
- •Особливості органічних сполук
- •Види хімічних формул
- •Теорія хімічної будови органічних речовин о.М.Бутлерова
- •Класифікація органічних сполук
- •Класифікація вуглеводнів
- •Види ізомерії
- •Електронна природа хімічних зв’язків
- •Типи розриву зв’язків
- •Типи реагентів
- •Хімічні властивості метану
- •Добування метану
- •Хімічні властивості етану
- •Хімічні властивості пропану
- •Хімічні властивості н–бутану
- •Хімічні властивості 2 – метилпропану
- •Добування алканів
- •Використання алканів у медицині
- •Хімічні властивості малих циклів
- •Хімічні властивості великих циклів
- •Добування циклоалканів
- •Використання циклоалканів у медицині
- •Хімічні властивості етилену
- •Хімічні властивості пропілену
- •Добування пропілену
- •Алкадієни
- •Хімічні властивості 1,3 – бутадієну
- •Хімічні властивості ізопрену
- •Добування алкадієнів
- •Добування ацетилену
- •Добування ацетилену
- •Добування інших алкінів
- •Розпізнавання алканів, алкенів, алкінів Арени
- •Добування бензолу
- •Добування бензолу
- •Гомологи бензолу
- •Орієнтуюча дія замісників у бензольному кільці
- •Добування толуолу
- •Хімічні властивості стиролу
- •Добування стиролу
- •Добування толуолу
- •Використання аренів у медицині
- •Порівняльна характеристика вуглеводнів
- •Галогенопохідні вуглеводнів
- •Хімічні властивості галогенопохідних
- •Добування галогенопохідних
- •Використання галогенопохідних у медицині
- •Одноатомні насичені спирти
- •Хімічні властивості метанолу
- •Хімічні властивості етанолу
- •Хімічні властивості пропанолу–1
- •Використання Вввввв
- •Добування фенолу
- •Етери ( прості ефіри )
- •Карбонільні сполуки
- •Хімічні властивості альдегідів
- •1. Реакції окислення:
- •2. Реакції карбонільної групи:
- •3. Реакції радикалу:
- •Добування альдегідів
- •Використання альдегідів у медицині
- •Хімічні властивості кетонів
- •2. Реакції карбонільної групи:
- •3. Реакції радикалу:
- •Добування кетонів
- •Хімічні властивості оцтової кислоти
- •Хімічні властивості мурашиної кислоти
- •Похідні карбонових кислот
- •Ненасичені кислоти
- •Ароматичні кислоти
- •Двохосновні карбонові кислоти
- •Гідроксикислоти
- •Оптична ізомерія
- •Окремі представники гідроксикислот
- •Фенолокислоти
- •Препарати саліцилової кислоти
- •Вуглеводи
- •Гексози с6н12о6
- •Добування глюкози – фотосинтез
- •Хімічні властивості глюкози
- •Реакція утворення етерів та естерів:
- •Сахароза
- •Мальтоза
- •Лактоза
- •Крохмаль
- •Целюлоза (клітковина)
- •Використання вуглеводів у медицині
- •Лікарські препарати – похідні ароматичних амінів
- •Сульфаніламідні препарати
- •Амінокислоти
- •Використання амінокислот у медицині
- •Похідні ароматичних амінокислот
- •Аміди кислот
- •Аміди вугільної кислоти
- •Похідні сечовини
- •Діазосполуки
- •Азосполуки
- •Забарвлені речовини та барвники
- •Гетероциклічні сполуки
- •П’ятичленні гетероцикли з одним гетероатомом
- •П’ятичленні гетероцикли з двома гетероатомами
- •Шестичленні гетероцикли з одним гетероатомом
- •Шестичленні гетероцикли з двома гетероатомами
- •Конденсовані гетероцикли
- •Ізопреноїди
- •Лімонен
- •Алкалоїди
- •Виділення алкалоїдів з рослинної сировини
- •1. Екстракція у вигляді солей.
- •2. Екстракція у вигляді основ.
- •Загальноалкалоїдні реакції
- •Класифікація алкалоїдів
Використання вуглеводів у медицині
Глюкоза є енергетичним „паливом” для організму. Це необхідний компонент крові, її вміст у крові людини становить 80 – 100 мг в 100 мл. Коли вміст глюкози у крові стає більше 180 мг, порушується вуглеводний обмін, виникає цукровий діабет.
У зв’язку з тим, що глюкоза легко і швидко засвоюється, її застосовують як засіб посиленого харчування, а також для виготовлення лікувальних препаратів і при консервуванні крові.
Фруктоза – найкращий вид цукру для хворих атеросклерозом, при порушенні в організмі обміну жирів.
Сахароза – використовується для виготовлення сиропів, мікстур для дітей.
Лактоза – відрізняється від решти цукрів відсутністю гігроскопічності й тому використовується для приготування порошків. Входить до складу сумішей для дитячого дієтичного харчування.
Сорбіт: – замінник цукру для хворих на цукровий діабет;
стимулятор виділення жовчі при дуодентальному зондуванні.
Глюконат кальцію – джерело кальцію в організмі. Також використовують як антиалергічний та кровоспинний засіб.
Крохмаль – для виготовлення мазей, присипок.
Колоксилін – для виготовлення рентгенівської плівки.
Колодій – для закріплення пов’язок.
Аміни
це похідні аміаку, в якому 1, 2 або 3 атома Н заміщені на радикали:
первинні аміни R – NH2
вторинні аміни R – NH – R
третинні аміни R – N – R
׀
R
Номенклатура амінів:
СН3 – NH2 метиламін СН3 – СН2 – СН – СН3
С2Н5 – NH2 етиламін ׀
С3Н7 – NH2 пропіламін NH2 2 – амінобутан
СН3 – NH – СН3 диметиламін
СН3 – NH – С2Н5 етилметиламін (радикали називають в алфавітному порядку)
Добування амінів: +HNO3 +3H2
первинні аміни: СН4 → СН3 – NО2 → СН3 – NH2
–H2O –2H2O
+Cl2 +NH3
СН4 → СН3 – Cl → СН3 – NH2
–HCl –HCl
вторинні аміни: СН3 – NH2 + Cl – CH3 → СН3 – NH – СН3 + HCl
третинні аміни: СН3 – NH – СН3 + Cl – CH3 → СН3 – N – СН3 + HCl
׀
СН3
Порівняльна характеристика основності аміаку та амінів:
Аміак виявляє основні властивості за рахунок неподіленої пари електронів атома N:
Н Н
:
Н – N: + H+ → H – N H+
׀
H
Аміни виявляють більш сильні основні властивості під впливом радикалів:
Н Н СН3
׀ ׀ ↓
СН3 → N: СН3 → N: СН3 → N:
׀ ↑ ↑
H CH3 CH3
А роматичні
аміни виявляють більш слабкі основні
властивості, тому що пара електронів
взаємодіє з π – хмарою бензольного
кільця:
роматичні
аміни виявляють більш слабкі основні
властивості, тому що пара електронів
взаємодіє з π – хмарою бензольного
кільця:
Н

 ׀
׀
– N:
׀
Н
Фізичні властивості:
Метил – та етиламіни – газоподібні, інші аміни та анілін – рідкі з характерним запахом аміаку. Вищі аміни – тверді.
Х імічні
властивості ациклічних амінів:
імічні
властивості ациклічних амінів:
горіння:
4СН3NH2 + 9O2 → 4CO2 + 10H2O + 2N2
взаємодія з водою:
СН3NH2 + НОН → [СН3NH3]OH гідроксид метиламонію
взаємодія з неорганічними кислотами:
СН3NH2 + НCl → [СН3NH3]Cl хлорид метиламонію
алкілування:
СН3NH2 + CH3Cl → CH3 – NH – CH3 + HCl
а цилювання: О О
СН3NH2 + СН3 – С → СН3 – С + Н2О
ОН NH – СН3 метиламід оцтової
кислоти
взаємодія з HNO2:
первинні аміни СН3NH2 + HNO2 → CH3OH + N2 + H2O
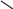 вторинні
аміни R
R
вторинні
аміни R
R
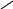 NH
+ HO
– N
= O
→ N
– N
= O
+ H2O
NH
+ HO
– N
= O
→ N
– N
= O
+ H2O
R R
третинні аміни – не взаємодіють
Х імічні властивості аніліну:
горіння:
4С6Н5NH2 + 31O2 → 24CO2 + 14H2O + 2N2
з водою не взаємодіє (більш слабкі основні властивості)
взаємодія з неорганічними кислотами:
С6Н5NH2 + НCl → [С6Н5NH3]Cl хлорид феніламонію
алкілування:
С6Н5NH2 + CH3Cl → C6H5 – NH – CH3 + HCl
а цилювання: О О
С6Н5NH2 + СН3 – С → СН3 – С + Н2О
ОН NH – С6Н5 ацетанілід
взаємодія з HNO2 – утворюються діазосполуки:
 + –
+ –
NH2 N ≡ N Cl
 ׀
׀
׀
׀
+ NaNO2 + 2HCl → + NaCl + 2H2O
діазоній хлорид
Ця реакція лежить в основі нітритометрії – метод кількісного аналізу для визначення первинних ароматичних амінів.
реакції бензольного кільця ( аміногрупа – орієнтант І роду)
галогенування:
NH2 NH2
׀ Br ׀ Br


+ 3Br2 → + 3HBr
׀
Br
Реакція бромування лежить в основі кількісного визначення первинних
ароматичних амінів.
нітрування:
NH2 NH2
׀ ׀
+ HNO3 → + H2O
׀
NO2
сульфування:
NH2 NH2
׀ ׀
+ H2SO4 → + H2O
׀
SO3H
сульфанілова кислота – є основою
сульфаніламідних препаратів
Добування аніліну:
NO2 NH2
Р еакція Зініна: ׀ ׀
+ 3H2 → + 2H2O
Амоноліз: Cl NH2
׀ ׀
+ NH3 → + HCl
