
- •Особливості органічних сполук
- •Види хімічних формул
- •Теорія хімічної будови органічних речовин о.М.Бутлерова
- •Класифікація органічних сполук
- •Класифікація вуглеводнів
- •Види ізомерії
- •Електронна природа хімічних зв’язків
- •Типи розриву зв’язків
- •Типи реагентів
- •Хімічні властивості метану
- •Добування метану
- •Хімічні властивості етану
- •Хімічні властивості пропану
- •Хімічні властивості н–бутану
- •Хімічні властивості 2 – метилпропану
- •Добування алканів
- •Використання алканів у медицині
- •Хімічні властивості малих циклів
- •Хімічні властивості великих циклів
- •Добування циклоалканів
- •Використання циклоалканів у медицині
- •Хімічні властивості етилену
- •Хімічні властивості пропілену
- •Добування пропілену
- •Алкадієни
- •Хімічні властивості 1,3 – бутадієну
- •Хімічні властивості ізопрену
- •Добування алкадієнів
- •Добування ацетилену
- •Добування ацетилену
- •Добування інших алкінів
- •Розпізнавання алканів, алкенів, алкінів Арени
- •Добування бензолу
- •Добування бензолу
- •Гомологи бензолу
- •Орієнтуюча дія замісників у бензольному кільці
- •Добування толуолу
- •Хімічні властивості стиролу
- •Добування стиролу
- •Добування толуолу
- •Використання аренів у медицині
- •Порівняльна характеристика вуглеводнів
- •Галогенопохідні вуглеводнів
- •Хімічні властивості галогенопохідних
- •Добування галогенопохідних
- •Використання галогенопохідних у медицині
- •Одноатомні насичені спирти
- •Хімічні властивості метанолу
- •Хімічні властивості етанолу
- •Хімічні властивості пропанолу–1
- •Використання Вввввв
- •Добування фенолу
- •Етери ( прості ефіри )
- •Карбонільні сполуки
- •Хімічні властивості альдегідів
- •1. Реакції окислення:
- •2. Реакції карбонільної групи:
- •3. Реакції радикалу:
- •Добування альдегідів
- •Використання альдегідів у медицині
- •Хімічні властивості кетонів
- •2. Реакції карбонільної групи:
- •3. Реакції радикалу:
- •Добування кетонів
- •Хімічні властивості оцтової кислоти
- •Хімічні властивості мурашиної кислоти
- •Похідні карбонових кислот
- •Ненасичені кислоти
- •Ароматичні кислоти
- •Двохосновні карбонові кислоти
- •Гідроксикислоти
- •Оптична ізомерія
- •Окремі представники гідроксикислот
- •Фенолокислоти
- •Препарати саліцилової кислоти
- •Вуглеводи
- •Гексози с6н12о6
- •Добування глюкози – фотосинтез
- •Хімічні властивості глюкози
- •Реакція утворення етерів та естерів:
- •Сахароза
- •Мальтоза
- •Лактоза
- •Крохмаль
- •Целюлоза (клітковина)
- •Використання вуглеводів у медицині
- •Лікарські препарати – похідні ароматичних амінів
- •Сульфаніламідні препарати
- •Амінокислоти
- •Використання амінокислот у медицині
- •Похідні ароматичних амінокислот
- •Аміди кислот
- •Аміди вугільної кислоти
- •Похідні сечовини
- •Діазосполуки
- •Азосполуки
- •Забарвлені речовини та барвники
- •Гетероциклічні сполуки
- •П’ятичленні гетероцикли з одним гетероатомом
- •П’ятичленні гетероцикли з двома гетероатомами
- •Шестичленні гетероцикли з одним гетероатомом
- •Шестичленні гетероцикли з двома гетероатомами
- •Конденсовані гетероцикли
- •Ізопреноїди
- •Лімонен
- •Алкалоїди
- •Виділення алкалоїдів з рослинної сировини
- •1. Екстракція у вигляді солей.
- •2. Екстракція у вигляді основ.
- •Загальноалкалоїдні реакції
- •Класифікація алкалоїдів
Фенолокислоти
це ароматичні сполуки, що містять у бензольному кільці дві функціональні групи ОН та СООН.
Фенолокислоти виявляють властивості карбонових кислот, фенолів та ароматичних сполук. Так, при дії лугів реагують обидві функціональні групи:


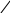 СООН
COONa
СООН
COONa
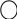 +
2NaOH
→ + 2H2O
+
2NaOH
→ + 2H2O
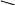
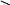 ОН
ONa
ОН
ONa
Але при дії на фенолокислоти карбонатів реагує тільки карбоксильна група, фенольний гідроксил, що має більш слабкі кислотні властивості, не витісняє карбонатну кислоту:
СООН COONa
+ Na2СO3 → + СО2 ↑ + H2O
2 2
ОН OН
Фенолокислоти здатні нітруватися, сульфуватися, галогенуватися з заміщенням атомів Н у бензольному кільці.
СООН
ОН


 Саліцилова
кислота
Саліцилова
кислота
Солі – саліцилати

Якісна реакція – реакція на фенол:
 СООН
COOH
СООН
COOH

 +
FeCl3
→ + HCl
+
FeCl3
→ + HCl
OH OFeCl2
фіолетове забарвлення
Саліцилова кислота має антисептичну, жарознижуючу та протиревматичну дію, але вона подразнює слизові оболонки органів травлення, тому в медицині використовують її солі та ефіри.
Препарати саліцилової кислоти
Натрій саліцілат – протиревматичний засіб (внутрішньо):
СООН COONa
+ Na2СO3 → + СО2 ↑ + H2O
2 2
ОН OН
Метилсаліцилат – протиревматичний засіб (зовнішньо у вигляді мазей):
СООН COOСН3
+ СН3OН → + H2O
ОН OН
Саліциламід – протиревматичний засіб (внутрішньо):
СООН CONН2
+ NН3 → + H2O
ОН OН
Фенілсаліцилат – антисептик при кишкових захворюваннях, легко гідролізується з утворенням саліцилової кислоти та фенолу, які мають антисептичну дію:

 СООН
COO
–
СООН
COO
–
+ OН – → + H2O
ОН OН
фенілсаліцилат ОН

 СОО
– СООН
СОО
– СООН
+ НОН → +
 ОН
ОН
ОН
ОН
Ацетилсаліцилова кислота (аспірин) – жарознижуючий, анальгезуючий, протиревматичний засіб:
СООН COOН
+ СН3 СОOН → + H2O
ОН O – СО – СН3
НО
СООН
НО
׀
ОН
Галова кислота – входить до складу дубільних
речовин. Головною складовою частиною дубільних
речовин є таніни, що представляють собою
глікозиди галової кислоти.
Водні розчини таніну здатні осаджувати білки. На
цій властивості базується дубільна дія таніну та
його використання як кровоспинного засобу.
Естери це
похідні карбонових кислот, у яких група
ОН заміщена залишком спирту.
Загальна формула
Номенклатура
O Н
– C
мурашино–етиловий
естер або
O
– С2Н5
етиловий естер мурашиної кислоти
O СН3
– C
оцтово–метиловий естер
або
O
– СН3
метиловий естер оцтової кислоти
Ізомерія: структурна
O
О
С2Н5
– C
та СН3
– C
O
– СН3
О – С2Н5
міжкласова
O
О
С2Н5
– C
та С3Н7
– C
O
– СН3
ОН
Хімічні
властивості:
О гідроліз
СН3
– С + НОН → СН3СООН
+ С2Н5ОН
О
– С2Н5
лужний
гідроліз О
СН3
– С + NaОН
→ СН3СООNa
+ С2Н5ОН
О
– С2Н5 амоноліз
О
О
СН3
– С + NН3
→ СН3
–
С + С2Н5ОН
О
– С2Н5
NН2 переестерифікація
О
О
СН3
– С + СН3ОН
→ СН3
–
С + С2Н5ОН
О
– С2Н5
О – СН3
Добування
– реакція естерифікації:
H2SO4
О
СН3СООН
+ С2Н5ОН
→
СН3
– С + Н2О
О
– С2Н5
O R
– C
O
– R









Вищі
жирні кислоти
це
карбонові кислоти лінійної будови, що
містять більше 15 атомів С і
входять
до складу жирів:
С15Н31СООН
– пальмітинова кислота
СН3
– (СН2)14
– СООН
С17Н35СООН
– стеаринова кислота
СН3
– (СН2)16
– СООН
С17Н33СООН
– олеїнова кислота
СН3
– (СН2)7
– СН = СН – (СН2)7
– СООН
Насичені
ВЖК
Ненасичені
ВЖК
пальмітинова стеаринова олеїнова
Радикал
неактивний.
Радикал легко
окислюється та приєднує різні
речовини за місцем подвійного
зв’язку.
Висока температура
плавлення – тверді.
Низька температура
плавлення – рідкі.
Входять до
складу тваринних жирів (твердих).
Входять до
складу рослинних жирів (рідких).
Властивості
стеаринової кислоти:
2С17Н35СООН
+ 2Na
= 2С17Н35СООNa
+ H2↑
С17Н35СООН
+ NaOH
= С17Н35СООNa
+ H2O
С17Н35СООН
+ C2H5OH
= С17Н35СООC2H5
+ H2O
Особливості
олеїнової кислоти: гідрогенізація СН3
– (СН2)7
– СН = СН – (СН2)7
– СООН + H2
→ СН3
– (СН2)16
– СООН знебарвлення
бромної води СН3
– (СН2)7
– СН = СН – (СН2)7
– СООН + Br2
→
СН3
– (СН2)7
– СН – СН – (СН2)7
– СООН
Br
Br окислення
KMnO4 СН3
– (СН2)7
– СН = СН – (СН2)7
– СООН + [O]
+ HOH
→
СН3
– (СН2)7
– СН – СН – (СН2)7
– СООН
׀
׀
OH
OH
Солі ВЖК
С15Н31СООН
+ NaOH
= С15Н31СООNa
+ H2O
2С17Н35СООН
+ СaO
= (С17Н35СОО)2Сa
+ H2O розчинні
солі (Na,
K)
– називаються
мило:
тверде
– солі Na
рідке – солі К нерозчинні
солі.
Мило погано
милиться у твердій воді:
2С15Н31СООNa
+ CaCl2
= (С15Н31СОО)2Ca↓
+ 2NaCl
Препарат
лінетол
– це суміш ненасичених ВЖК, використовується
при лікуванні гіпертонії, атеросклерозу,
опіків, променевої хвороби.

Жири
це естери спирту гліцерину та вищих жирних кислот.
Класифікація жирів:
з

 а
складом
прості
а
складом
прості
змішані
з
 а
фізичними властивостями
тверді
а
фізичними властивостями
тверді
рідкі (олії)
з

 а
походженням
тваринні
а
походженням
тваринні
рослинні
Хімічні властивості:
гідроліз
СН2 – О – СО – С15Н31 СН2 – ОН
СН – О – СО – С15Н31 + 3НОН → СН – ОН + 3С15Н31СООН
СН2 – О – СО – С15Н31 СН2 – ОН
лужний гідроліз (омилення)
СН2 – О – СО – С15Н31 СН2 – ОН
СН – О – СО – С15Н31 + 3NaОН → СН – ОН + 3С15Н31СООNa
СН2 – О – СО – С15Н31 СН2 – ОН мило
гідрогенізація рідких жирів
СН2 – О – СО – С17Н33 СН2 – О – СО – С17Н35
СН – О – СО – С17Н33 + 3Н2 → СН – О – СО – С17Н35
СН2 – О – СО – С17Н33 СН2 – О – СО – С17Н35
Добування жирів:
СН2 – ОН СН2 – О – СО – С15Н31
СН – ОН + 3С15Н31СООН → СН – О – СО – С15Н31 + 3Н2О
СН2 – ОН СН2 – О – СО – С15Н31
Біологічна роль жирів:
енергетична функція;
поживна функція;
захисна функція;
терморегуляція.
Воски
це естери вищіх карбонових кислот та вищіх спиртів.
Воски поділяють на тваринні (спермацет, бджолиний віск, ланолін) та рослинні (воски з листів рослин). Температура плавлення восків зростає зі зростанням карбонових радикалів кислот та спиртів. У зв'язку з цим воски бувають м’які та тверді.
М’які воски:
ланолін – виробляється шкірними залозами вівець. Використовують як основу лікарських мазей.
спермацет – добувають з голови кашалоту. Використовують як основу лікарських мазей.
Тверді воски:
бджолиний віск – добувають з бджолиних сотів. Використовують як основу лікарських мазей та косметичних препаратів.
