
- •Особливості органічних сполук
- •Види хімічних формул
- •Теорія хімічної будови органічних речовин о.М.Бутлерова
- •Класифікація органічних сполук
- •Класифікація вуглеводнів
- •Види ізомерії
- •Електронна природа хімічних зв’язків
- •Типи розриву зв’язків
- •Типи реагентів
- •Хімічні властивості метану
- •Добування метану
- •Хімічні властивості етану
- •Хімічні властивості пропану
- •Хімічні властивості н–бутану
- •Хімічні властивості 2 – метилпропану
- •Добування алканів
- •Використання алканів у медицині
- •Хімічні властивості малих циклів
- •Хімічні властивості великих циклів
- •Добування циклоалканів
- •Використання циклоалканів у медицині
- •Хімічні властивості етилену
- •Хімічні властивості пропілену
- •Добування пропілену
- •Алкадієни
- •Хімічні властивості 1,3 – бутадієну
- •Хімічні властивості ізопрену
- •Добування алкадієнів
- •Добування ацетилену
- •Добування ацетилену
- •Добування інших алкінів
- •Розпізнавання алканів, алкенів, алкінів Арени
- •Добування бензолу
- •Добування бензолу
- •Гомологи бензолу
- •Орієнтуюча дія замісників у бензольному кільці
- •Добування толуолу
- •Хімічні властивості стиролу
- •Добування стиролу
- •Добування толуолу
- •Використання аренів у медицині
- •Порівняльна характеристика вуглеводнів
- •Галогенопохідні вуглеводнів
- •Хімічні властивості галогенопохідних
- •Добування галогенопохідних
- •Використання галогенопохідних у медицині
- •Одноатомні насичені спирти
- •Хімічні властивості метанолу
- •Хімічні властивості етанолу
- •Хімічні властивості пропанолу–1
- •Використання Вввввв
- •Добування фенолу
- •Етери ( прості ефіри )
- •Карбонільні сполуки
- •Хімічні властивості альдегідів
- •1. Реакції окислення:
- •2. Реакції карбонільної групи:
- •3. Реакції радикалу:
- •Добування альдегідів
- •Використання альдегідів у медицині
- •Хімічні властивості кетонів
- •2. Реакції карбонільної групи:
- •3. Реакції радикалу:
- •Добування кетонів
- •Хімічні властивості оцтової кислоти
- •Хімічні властивості мурашиної кислоти
- •Похідні карбонових кислот
- •Ненасичені кислоти
- •Ароматичні кислоти
- •Двохосновні карбонові кислоти
- •Гідроксикислоти
- •Оптична ізомерія
- •Окремі представники гідроксикислот
- •Фенолокислоти
- •Препарати саліцилової кислоти
- •Вуглеводи
- •Гексози с6н12о6
- •Добування глюкози – фотосинтез
- •Хімічні властивості глюкози
- •Реакція утворення етерів та естерів:
- •Сахароза
- •Мальтоза
- •Лактоза
- •Крохмаль
- •Целюлоза (клітковина)
- •Використання вуглеводів у медицині
- •Лікарські препарати – похідні ароматичних амінів
- •Сульфаніламідні препарати
- •Амінокислоти
- •Використання амінокислот у медицині
- •Похідні ароматичних амінокислот
- •Аміди кислот
- •Аміди вугільної кислоти
- •Похідні сечовини
- •Діазосполуки
- •Азосполуки
- •Забарвлені речовини та барвники
- •Гетероциклічні сполуки
- •П’ятичленні гетероцикли з одним гетероатомом
- •П’ятичленні гетероцикли з двома гетероатомами
- •Шестичленні гетероцикли з одним гетероатомом
- •Шестичленні гетероцикли з двома гетероатомами
- •Конденсовані гетероцикли
- •Ізопреноїди
- •Лімонен
- •Алкалоїди
- •Виділення алкалоїдів з рослинної сировини
- •1. Екстракція у вигляді солей.
- •2. Екстракція у вигляді основ.
- •Загальноалкалоїдні реакції
- •Класифікація алкалоїдів
Гідроксикислоти
це гетерофункціональні сполуки, що містять функціональні групи ОН та СООН.
Залежно від взаємного розташування ОН і СООН розрізняють α –, β – і γ – кислоти: α β γ
СН3 – СН2 – СН – СООН СН3 – СН – СН2 – СООН СН2 – СН2 – СН2 – СООН
׀ ׀ ׀
ОН ОН ОН
Гідроксикислоти виявляють властивості карбонових кислот та спиртів. Вони сильніші, ніж карбонові кислоти, що пояснюється взаємним впливом функціональних груп одна на одну. Однак, чим більше відстань між групами, тим менше їх взаємний вплив.
Характерними реакціями гідроксикислот є їх відношення до нагрівання:
α – гідроксикислоти
у присутності мінеральних кислот виділяється мурашина кислота:
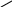 Н+
, t°
О
Н+
, t°
О
СН3 – СН – СООН → СН3 – С + НСООН
׀ Н
ОН
при нагріванні без кислот утворюються лактиди:
Н 3С
О
3С
О

 СН
– С Н3С
О
СН
– С Н3С
О
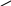 НО
ОН t°
СН – С
НО
ОН t°
СН – С
 → О
О + Н2О
→ О
О + Н2О


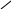
 НО
ОН С – СН
НО
ОН С – СН
С – СН О СН3
О СН3 лактид молочної кислоти
β – гідроксикислоти – при нагріванні утворюються ненасичені кислоти:
t°
СН3 – СН – СН2 – СООН → СН3 – СН = СН – СООН + Н2О
׀
ОН
γ – гідроксикислоти – при нагріванні утворюються лактони:
 О
О
О
О

 СН2
– С СН2
– С
СН2
– С СН2
– С
ОН t°
 →
О
+ Н2О
→
О
+ Н2О
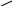 ОН
ОН
СН2 – СН2 СН2 – СН2
лактон молочної кислоти
Важливою особливістю гідроксикислот є наявність в їх молекулі одного або декількох асиметричних атомів Карбону, що призводить до існування оптичних ізомерів.
Оптична ізомерія
це вид просторової ізомерії, що характеризується різним розташуванням у просторі чотирьох різних груп навколо асиметричного атома Карбону і тим, що ці ізомери схожі один на одного як предмет і його дзеркальне відображення:
СООН СООН
׀ ׀
Н – С*– ОН НО – С*– Н
׀ ׀
СН3 СН3
D – молочна кислота L – молочна кислота
Оптично активні речовини повертають площину поляризованого світла на певний кут. Оптичні ізомери мають однакові фізичні та хімічні властивості, але відрізняються знаком повороту площини поляризації: один повертає вправо, другий вліво на один і той же кут, за яким можна ідентифікувати оптично активну речовину.
Якщо в молекулі декілька асиметричних атомів С, то кількість оптичних ізомерів дорівнює 2n, де n – число асиметричних атомів (для молочної кислоти 21 = 2 ізомери):
винна кислота (n = 2) – 22 = 4 ізомери:
СООН СООН СООН СООН
׀ ׀ ׀ ׀
Н – С – ОН НО – С – Н НО – С – Н Н – С – ОН
׀ ׀ ׀ ׀
Н – С – ОН НО – С – Н Н – С – ОН НО – С – Н
׀ ׀ ׀ ׀
СООН СООН СООН СООН






енантіомери енантіомери
Енантіомери – це дзеркальні ізомери.
Діастереомери – це стереомери, що не являються енантіомерами між собою:
1 – 3, 1 – 4, 2 – 3, 2 – 4
Природне світло – це електромагнітні хвилі. Воно не є плоскополяризованим, тобто хвилі коливаються в різних напрямках та площинах. Але якщо промінь світла пропустити крізь призму Ніколя, то воно стає плоскополяризованим:






призма Ніколя
(поляризатор)
 Якщо
промінь поляризованого світла пропустити
крізь оптично активну речовину,
спостерігається поворот площини
поляризації світлової хвилі. Кут повороту
вимірюють за допомогою поляриметра:
Якщо
промінь поляризованого світла пропустити
крізь оптично активну речовину,
спостерігається поворот площини
поляризації світлової хвилі. Кут повороту
вимірюють за допомогою поляриметра:




поляризатор кювета з оптично
активною речовиною поляриметр
Сполуки, які складаються з рівних кількостей оптичних антиподів, є оптично неактивними і називаються рацематами.
В живих організмах майже всі органічні сполуки – оптично активні. В організмі синтезується лише один з двох можливих ізомерів, наприклад, D – глюкоза, L – амінокислоти.
