
- •Особливості органічних сполук
- •Види хімічних формул
- •Теорія хімічної будови органічних речовин о.М.Бутлерова
- •Класифікація органічних сполук
- •Класифікація вуглеводнів
- •Види ізомерії
- •Електронна природа хімічних зв’язків
- •Типи розриву зв’язків
- •Типи реагентів
- •Хімічні властивості метану
- •Добування метану
- •Хімічні властивості етану
- •Хімічні властивості пропану
- •Хімічні властивості н–бутану
- •Хімічні властивості 2 – метилпропану
- •Добування алканів
- •Використання алканів у медицині
- •Хімічні властивості малих циклів
- •Хімічні властивості великих циклів
- •Добування циклоалканів
- •Використання циклоалканів у медицині
- •Хімічні властивості етилену
- •Хімічні властивості пропілену
- •Добування пропілену
- •Алкадієни
- •Хімічні властивості 1,3 – бутадієну
- •Хімічні властивості ізопрену
- •Добування алкадієнів
- •Добування ацетилену
- •Добування ацетилену
- •Добування інших алкінів
- •Розпізнавання алканів, алкенів, алкінів Арени
- •Добування бензолу
- •Добування бензолу
- •Гомологи бензолу
- •Орієнтуюча дія замісників у бензольному кільці
- •Добування толуолу
- •Хімічні властивості стиролу
- •Добування стиролу
- •Добування толуолу
- •Використання аренів у медицині
- •Порівняльна характеристика вуглеводнів
- •Галогенопохідні вуглеводнів
- •Хімічні властивості галогенопохідних
- •Добування галогенопохідних
- •Використання галогенопохідних у медицині
- •Одноатомні насичені спирти
- •Хімічні властивості метанолу
- •Хімічні властивості етанолу
- •Хімічні властивості пропанолу–1
- •Використання Вввввв
- •Добування фенолу
- •Етери ( прості ефіри )
- •Карбонільні сполуки
- •Хімічні властивості альдегідів
- •1. Реакції окислення:
- •2. Реакції карбонільної групи:
- •3. Реакції радикалу:
- •Добування альдегідів
- •Використання альдегідів у медицині
- •Хімічні властивості кетонів
- •2. Реакції карбонільної групи:
- •3. Реакції радикалу:
- •Добування кетонів
- •Хімічні властивості оцтової кислоти
- •Хімічні властивості мурашиної кислоти
- •Похідні карбонових кислот
- •Ненасичені кислоти
- •Ароматичні кислоти
- •Двохосновні карбонові кислоти
- •Гідроксикислоти
- •Оптична ізомерія
- •Окремі представники гідроксикислот
- •Фенолокислоти
- •Препарати саліцилової кислоти
- •Вуглеводи
- •Гексози с6н12о6
- •Добування глюкози – фотосинтез
- •Хімічні властивості глюкози
- •Реакція утворення етерів та естерів:
- •Сахароза
- •Мальтоза
- •Лактоза
- •Крохмаль
- •Целюлоза (клітковина)
- •Використання вуглеводів у медицині
- •Лікарські препарати – похідні ароматичних амінів
- •Сульфаніламідні препарати
- •Амінокислоти
- •Використання амінокислот у медицині
- •Похідні ароматичних амінокислот
- •Аміди кислот
- •Аміди вугільної кислоти
- •Похідні сечовини
- •Діазосполуки
- •Азосполуки
- •Забарвлені речовини та барвники
- •Гетероциклічні сполуки
- •П’ятичленні гетероцикли з одним гетероатомом
- •П’ятичленні гетероцикли з двома гетероатомами
- •Шестичленні гетероцикли з одним гетероатомом
- •Шестичленні гетероцикли з двома гетероатомами
- •Конденсовані гетероцикли
- •Ізопреноїди
- •Лімонен
- •Алкалоїди
- •Виділення алкалоїдів з рослинної сировини
- •1. Екстракція у вигляді солей.
- •2. Екстракція у вигляді основ.
- •Загальноалкалоїдні реакції
- •Класифікація алкалоїдів
Двохосновні карбонові кислоти
Фізичні властивості:
Рідких дикарбонових кислот немає. Це пов’язано з наявністю двох карбоксильних груп, тобто більшою кількістю водневих зв’язків. Вони всі тверді, добре розчинні у воді.
Хімічні властивості:
Дикарбонові кислоти – більш сильні, ніж монокарбонові. Чим коротший радикал, тим сила кислоти більша. Для дикарбонових кислот характерні всі властивості монокарбонових кислот, але на відміну від одноосновних можуть давати повні та неповні похідні.
СООН ׀ СООН
Щавлева (оксалатна) кислота
Солі – оксалати
Розкладається при нагріванні:
СООН
׀ → СО2↑ + СО↑ + Н2О↑
СООН
Якісна реакція: Н2С2О4 + Са2+ → СаС2О4↓ + Н+
білий осад
Використання: в якісному аналізі для відкриття іонів кальцію.
Біологічна роль: оксалати відкладаються в нирках при нирково-кам’яній хворобі.
СООН ׀ СН2 ׀ СООН
СООН ׀ СН2 ׀ СН2 ׀ СООН
Малонова кислота Янтарна кислота
Солі – малонати Солі – сукцинати
Починаючи з янтарної
кислоти, дикарбонові
кислоти при нагріванні
утворюють внутрішні
Розкладається при нагріванні: ангідриди:
 О
О
О
О
СООН СН2 – С СН2 – С
 ׀
ОН
→ ׀
О
+ Н2О
׀
ОН
→ ׀
О
+ Н2О
СН2 → СО2↑ + СН3СООН ОН СН2 – С
׀ СН2 – С О
СООН О янтарний
ангідрид
СООН ׀ СН ׀׀ СН ׀ СООН
Етилендикарбонова кислота
(бутандіова)
Має два геометричних ізомери:
Н
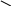
 СООН Н СООН
СООН Н СООН
С С
׀׀ ׀׀
С С
Н СООН НООС Н
малеїнова кислота фумарова кислота
(цис – ізомер) (транс – ізомер)
Приєднання за подвійним зв’язком:
СООН COOH
׀ ׀
СН + Br2 → CH – Br
׀׀ ׀
CH CH – Br
׀ ׀
COOH COOH
Окислення:
СООН COOH
׀ ׀
СН + [O] + HOH → CH – OH
׀׀ ׀
CH CH – OH
׀ ׀
COOH COOH
Малеїнова кислота утворює внутрішній ангідрид:
О О
СН – С СН – С
ОН → ׀׀ О + Н2О
ОН СН – С
СН – С О
О малеїновий ангідрид
Якісні реакції – знебарвлення бромної води та розчину калій перманганату.
С6Н4(СООН)2
Фталеві кислоти СООН СООН

М

 ають
три ізомери: СООН
ають
три ізомери: СООН

 СООН
СООН
СООН
СООН
о– фталева м – фталева СООН
кислота кислота п – фталева
кислота
Орто – фталева кислота утворює внутрішній ангідрид:
 О
О
О
О

 С
С
С
С

 ОН
ОН
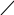 →
О +
Н2О
→
О +
Н2О
 ОН
ОН
С С фталевий ангідрид
О О
Фталевий ангідрид конденсується з фенолом і утворює фенолфталеїн:


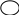
 Н
– – ОН
– ОН
Н
– – ОН
– ОН


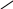
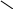
О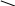
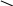
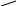 = С С = О +
→ О = С С
= С С = О +
→ О = С С
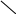 О
О
О
О
– ОН
Н – – ОН
+ Н2О
Використання фенолфталеїну:
індикатор для кислотно – основного титрування;
проносний засіб (пурген).
