
- •Особливості органічних сполук
- •Види хімічних формул
- •Теорія хімічної будови органічних речовин о.М.Бутлерова
- •Класифікація органічних сполук
- •Класифікація вуглеводнів
- •Види ізомерії
- •Електронна природа хімічних зв’язків
- •Типи розриву зв’язків
- •Типи реагентів
- •Хімічні властивості метану
- •Добування метану
- •Хімічні властивості етану
- •Хімічні властивості пропану
- •Хімічні властивості н–бутану
- •Хімічні властивості 2 – метилпропану
- •Добування алканів
- •Використання алканів у медицині
- •Хімічні властивості малих циклів
- •Хімічні властивості великих циклів
- •Добування циклоалканів
- •Використання циклоалканів у медицині
- •Хімічні властивості етилену
- •Хімічні властивості пропілену
- •Добування пропілену
- •Алкадієни
- •Хімічні властивості 1,3 – бутадієну
- •Хімічні властивості ізопрену
- •Добування алкадієнів
- •Добування ацетилену
- •Добування ацетилену
- •Добування інших алкінів
- •Розпізнавання алканів, алкенів, алкінів Арени
- •Добування бензолу
- •Добування бензолу
- •Гомологи бензолу
- •Орієнтуюча дія замісників у бензольному кільці
- •Добування толуолу
- •Хімічні властивості стиролу
- •Добування стиролу
- •Добування толуолу
- •Використання аренів у медицині
- •Порівняльна характеристика вуглеводнів
- •Галогенопохідні вуглеводнів
- •Хімічні властивості галогенопохідних
- •Добування галогенопохідних
- •Використання галогенопохідних у медицині
- •Одноатомні насичені спирти
- •Хімічні властивості метанолу
- •Хімічні властивості етанолу
- •Хімічні властивості пропанолу–1
- •Використання Вввввв
- •Добування фенолу
- •Етери ( прості ефіри )
- •Карбонільні сполуки
- •Хімічні властивості альдегідів
- •1. Реакції окислення:
- •2. Реакції карбонільної групи:
- •3. Реакції радикалу:
- •Добування альдегідів
- •Використання альдегідів у медицині
- •Хімічні властивості кетонів
- •2. Реакції карбонільної групи:
- •3. Реакції радикалу:
- •Добування кетонів
- •Хімічні властивості оцтової кислоти
- •Хімічні властивості мурашиної кислоти
- •Похідні карбонових кислот
- •Ненасичені кислоти
- •Ароматичні кислоти
- •Двохосновні карбонові кислоти
- •Гідроксикислоти
- •Оптична ізомерія
- •Окремі представники гідроксикислот
- •Фенолокислоти
- •Препарати саліцилової кислоти
- •Вуглеводи
- •Гексози с6н12о6
- •Добування глюкози – фотосинтез
- •Хімічні властивості глюкози
- •Реакція утворення етерів та естерів:
- •Сахароза
- •Мальтоза
- •Лактоза
- •Крохмаль
- •Целюлоза (клітковина)
- •Використання вуглеводів у медицині
- •Лікарські препарати – похідні ароматичних амінів
- •Сульфаніламідні препарати
- •Амінокислоти
- •Використання амінокислот у медицині
- •Похідні ароматичних амінокислот
- •Аміди кислот
- •Аміди вугільної кислоти
- •Похідні сечовини
- •Діазосполуки
- •Азосполуки
- •Забарвлені речовини та барвники
- •Гетероциклічні сполуки
- •П’ятичленні гетероцикли з одним гетероатомом
- •П’ятичленні гетероцикли з двома гетероатомами
- •Шестичленні гетероцикли з одним гетероатомом
- •Шестичленні гетероцикли з двома гетероатомами
- •Конденсовані гетероцикли
- •Ізопреноїди
- •Лімонен
- •Алкалоїди
- •Виділення алкалоїдів з рослинної сировини
- •1. Екстракція у вигляді солей.
- •2. Екстракція у вигляді основ.
- •Загальноалкалоїдні реакції
- •Класифікація алкалоїдів
Етери ( прості ефіри )
це органічні сполуки, в молекулах яких два вуглеводневих радикали зв’язані атомом Оксигену: R – O – R
Якщо радикали однакові, то етер називають симетричним; якщо різні –
несиметричним (змішаним):
СН3 – О – СН3 диметиловий етер
С2Н5 – О – С2Н5 діетиловий етер
СН3 – О – С2Н5 етилметиловий етер
Загальна формула СnH2n+2O
Ізомерія: – за вуглецевим скелетом;
міжкласова ізомерія (зі спиртами).
Фізичні властивості:
Нижчі етери – гази або легко леткі рідини з характерним запахом, легко займаються, у воді нерозчинні, але самі є хорошими органічними розчинниками. У суміші з повітрям вибуховонебезпечні.
Хімічні властивості:
Хімічна активність етерів невелика, зв’язки С – О міцні й розриваються важко.
1 – розкладання етерів під дією йодоводню при нагріванні – йод з’єднується з
меншим радикалом:
СН3 – О – С2Н5 + НІ → СН3І + С2Н5ОН
HCl та HBr не розкладають етери.
2 – розкладання етерів під дією концентрованої сульфатної кислоти:
СН3 – О – С2Н5 + НО – SO3H → СН3 – O – SO3H + С2Н5ОН
складний ефір –
метилсульфатна кислота
Добування:
1 – міжмолекулярна дегідратація спиртів
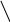 CH3OH
H2SO4
CH3OH
H2SO4
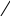 СН3
– О – СН3
+ H2O
СН3
– О – СН3
+ H2O
CH3OH до 140°С
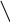
CH3OH H2SO4
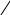 СН3
– О – С2Н5
+ H2O
СН3
– О – С2Н5
+ H2O
C2H5OH до 140°С
2 – з алкоголяту та галагенопохідного
C2H5 – ONa + I – CH3 → С2Н5 – О – СН3 + NaI
Використання у медицині:
Діетиловий етер (сірчаний ефір) – інгаляційний наркоз.
Карбонільні сполуки
це органічні сполуки, що містять функціональну групу – карбонільну:

 C
= O
C
= O
O
R
– C
H
Кетони містять карбонільну групу, зв'язану з двома радикалами. Функціональна група знаходиться в середині вуглецевого скелету:
R – C – R
׀׀
O
Альдегіди та кетони – ізомери між собою ( міжкласова ізомерія). Їх загальна формула: CnH2nO
Н –
C
мурашиний альдегід
Н
формальдегід
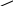 O
метаналь
O
метаналь
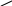
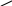 O
етаналь
O
етаналь
СН3 – C оцтовий альдегід
O
Н
׀׀
ацетон
O
О
С3Н7
– C
бутаналь СН3
– С – СН2
– СН3
бутанон С2Н5
–
C
пропаналь СН3
– С – СН3
пропанон
С2Н5
–
C
пропаналь СН3
– С – СН3
пропанон
Н ׀׀
О
O
С4Н9
– C
пентаналь СН3
– С – СН2
– СН2
–
СН3
пентанон – 2
О
СН3 – СН2 – С – СН2 – СН3 пентанон – 3
׀׀
суфікс –аль О
суфікс –он
Ізомерія: – за вуглецевим скелетом;
міжкласова ізомерія.
Електронна будова:
C = O
Подібність до алкенів: – тип гібридизації sp2
– валентний кут 120°
– форма молекули площинна
Відмінність від алкенів: у молекулах алкенів подвійний зв’язок С = С неполярний, а в карбонільних сполуках С = О полярний:
δ+ δ–
С => О
Чим більш полярний зв’язок, тим він більш реакційно здатний.
Порівняльна характеристика альдегідів та кетонів

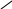 δ+ О
δ–
δ+
О
δ–
δ+
δ+ О
δ–
δ+
О
δ–
δ+

 Н
–
С R
→ C
R
→ C ← R
Н
–
С R
→ C
R
→ C ← R
Н H О
Альдегіди більш активні, ніж кетони.
Серед альдегідів найбільш активний – формальдегід.
Фізичні властивості
Альдегіди та кетони, за винятком формальдегіду, рідкі або тверді речовини, мають характерний запах. Нижчі представники добре розчинні у воді.
