
- •Особливості органічних сполук
- •Види хімічних формул
- •Теорія хімічної будови органічних речовин о.М.Бутлерова
- •Класифікація органічних сполук
- •Класифікація вуглеводнів
- •Види ізомерії
- •Електронна природа хімічних зв’язків
- •Типи розриву зв’язків
- •Типи реагентів
- •Хімічні властивості метану
- •Добування метану
- •Хімічні властивості етану
- •Хімічні властивості пропану
- •Хімічні властивості н–бутану
- •Хімічні властивості 2 – метилпропану
- •Добування алканів
- •Використання алканів у медицині
- •Хімічні властивості малих циклів
- •Хімічні властивості великих циклів
- •Добування циклоалканів
- •Використання циклоалканів у медицині
- •Хімічні властивості етилену
- •Хімічні властивості пропілену
- •Добування пропілену
- •Алкадієни
- •Хімічні властивості 1,3 – бутадієну
- •Хімічні властивості ізопрену
- •Добування алкадієнів
- •Добування ацетилену
- •Добування ацетилену
- •Добування інших алкінів
- •Розпізнавання алканів, алкенів, алкінів Арени
- •Добування бензолу
- •Добування бензолу
- •Гомологи бензолу
- •Орієнтуюча дія замісників у бензольному кільці
- •Добування толуолу
- •Хімічні властивості стиролу
- •Добування стиролу
- •Добування толуолу
- •Використання аренів у медицині
- •Порівняльна характеристика вуглеводнів
- •Галогенопохідні вуглеводнів
- •Хімічні властивості галогенопохідних
- •Добування галогенопохідних
- •Використання галогенопохідних у медицині
- •Одноатомні насичені спирти
- •Хімічні властивості метанолу
- •Хімічні властивості етанолу
- •Хімічні властивості пропанолу–1
- •Використання Вввввв
- •Добування фенолу
- •Етери ( прості ефіри )
- •Карбонільні сполуки
- •Хімічні властивості альдегідів
- •1. Реакції окислення:
- •2. Реакції карбонільної групи:
- •3. Реакції радикалу:
- •Добування альдегідів
- •Використання альдегідів у медицині
- •Хімічні властивості кетонів
- •2. Реакції карбонільної групи:
- •3. Реакції радикалу:
- •Добування кетонів
- •Хімічні властивості оцтової кислоти
- •Хімічні властивості мурашиної кислоти
- •Похідні карбонових кислот
- •Ненасичені кислоти
- •Ароматичні кислоти
- •Двохосновні карбонові кислоти
- •Гідроксикислоти
- •Оптична ізомерія
- •Окремі представники гідроксикислот
- •Фенолокислоти
- •Препарати саліцилової кислоти
- •Вуглеводи
- •Гексози с6н12о6
- •Добування глюкози – фотосинтез
- •Хімічні властивості глюкози
- •Реакція утворення етерів та естерів:
- •Сахароза
- •Мальтоза
- •Лактоза
- •Крохмаль
- •Целюлоза (клітковина)
- •Використання вуглеводів у медицині
- •Лікарські препарати – похідні ароматичних амінів
- •Сульфаніламідні препарати
- •Амінокислоти
- •Використання амінокислот у медицині
- •Похідні ароматичних амінокислот
- •Аміди кислот
- •Аміди вугільної кислоти
- •Похідні сечовини
- •Діазосполуки
- •Азосполуки
- •Забарвлені речовини та барвники
- •Гетероциклічні сполуки
- •П’ятичленні гетероцикли з одним гетероатомом
- •П’ятичленні гетероцикли з двома гетероатомами
- •Шестичленні гетероцикли з одним гетероатомом
- •Шестичленні гетероцикли з двома гетероатомами
- •Конденсовані гетероцикли
- •Ізопреноїди
- •Лімонен
- •Алкалоїди
- •Виділення алкалоїдів з рослинної сировини
- •1. Екстракція у вигляді солей.
- •2. Екстракція у вигляді основ.
- •Загальноалкалоїдні реакції
- •Класифікація алкалоїдів
Гомологи бензолу
Загальна формула СnH2n–6
 СН3
С2Н5
СН3
СН3
СН3
Н3С
– СН – СН3
СН3
С2Н5
СН3
СН3
СН3
Н3С
– СН – СН3

 СН3
СН3
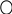
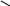 СН3
СН3
толуол етилбензол кумол
(метилбензол) о–ксилол м–ксилол СН3 (ізопропілбензол)
п–ксилол
Орієнтуюча дія замісників у бензольному кільці
Електронна π – хмара в молекулі бензолу симетрична, тому всі атоми С рівноцінні. Введення в молекулу бензолу замісника порушує симетрію π – системи, призводячи до перерозподілу електронної густини у кільці. В результаті реакційна здатність бензольного кільця змінюється, в ньому з’являються частково заряджені центри, які й визначають місце введення у бензольне кільце наступного замісника.
Електронодонорні замісники підвищують електронну густину спряженої системи, оказуючи на неї активуючу дію, особливо в орто – і пара – положеннях, де створюються центри з частковим негативним зарядом:
R
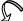 ↓
↓

 δ–
В
орто – і пара – положеннях
δ–
В
орто – і пара – положеннях
 δ–
легко
відбувається атака
δ–
легко
відбувається атака
електрофільних агентів, що
що призводить до реакцій
 заміщення.
заміщення.
δ–
Електроноакцепторні замісники відтягують на себе електронну густину спряженої системи, оказуючи на неї дезактивуючу дію, особливо в орто – і пара – положеннях, де створюються центри з частковим позитивним зарядом:
R
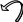 ↑ В
мета – положеннях можлива
↑ В
мета – положеннях можлива
δ+ атака нуклеофільних агентів,
 δ+
що
призводить до реакцій
δ+
що
призводить до реакцій
заміщення.
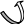
δ+
Замісники І роду (електронодонорні, орто – і пара – орієнтанти) |
Замісники ІІ роду (електроноакцепторні, мета – орієнтанти) |
– СН3 – С2Н5 – С3Н7 та ін.
|
H
OH O ׀׀
׀׀ O |

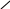
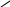 O
O ітрогрупа
– N
ітрогрупа
– N O
O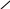
 O
O арбонільна
група
– C
арбонільна
група
– C
 O
O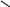 арбоксильна
група
– C
арбоксильна
група
– C