
Розділ 1 КЛАСИФІКАЦІЯ І КРИСТАЛІЧНА БУДОВА МЕТАЛІВ
2.1.1. Класифікація металів
В основі прийнятої в технічній літературі класифікації металів є деякі їх спільні фізико-хімічні властивості, зокрема температура топлення, густина, електропровідність, корозійна тривкість, радіоактивність тощо. Дуже часто визначальними характеристиками при виборі металів як конструкційних матеріалів для конкретних робочих умов є їх температура топлення і густина.
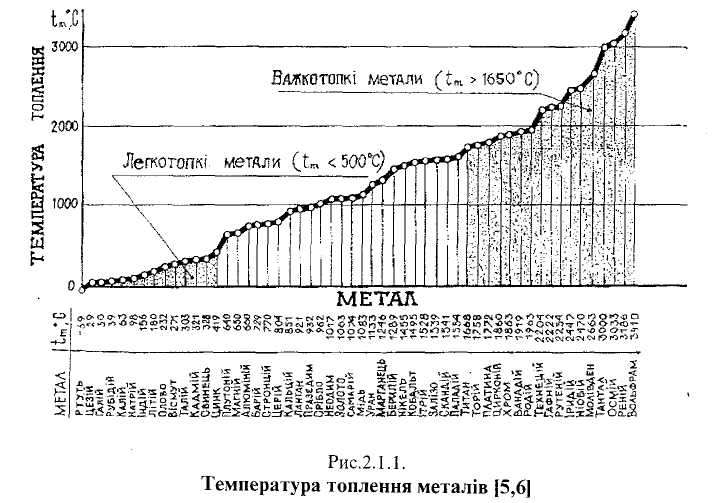
За температурою топлення (fj метали поділяють на легкотопкі (t <500°C)
^ажкотопкі (/„>1650 °С) [7, с 11]. До легкотопких належать такі метали як
и (рис.2.1.1), калій, натрій, літій, олово, свинець, цинк та інші. їх використав ують
я виготовлення припоїв, бабітів і деяких легкотопких стопів. Важкотопкі
метали (титан, хром, ванадій, цирконій, молібден, ніобій, тантал, вольфрам) широко застосовують у металургії сталі як легувальні елементи, а також для виготовлення на їх основі спеціальних стопів з високою температурою топлення Густина (у) металу виступає на перший план у випадку виготовлення стопів для авіації, для космічної техніки і для наземних транспортних засобів. Залежно від густини розрізняють легкі (у < 5 ■ 103 кг/м3) і важкі (у > 10 ■ 103 кг/м3) метали [7, с.11]. Найлегший серед металів літій (у - 530 кг/м3, рис.2.1.2), найважчий осмій (у- 22 500 кг/м3).
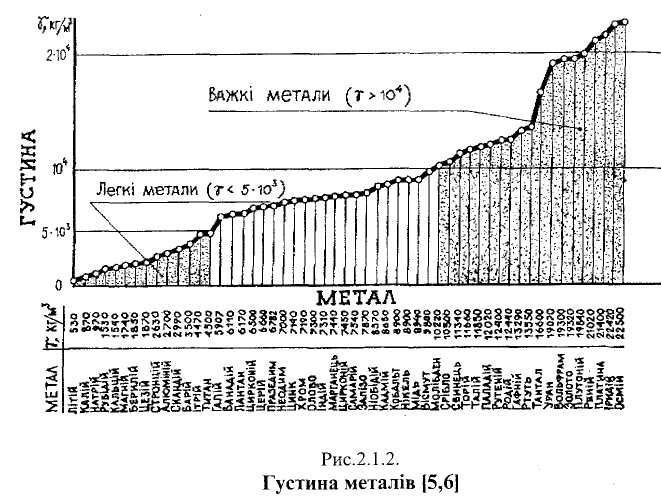
Шляхетні метали (золото, срібло, платина, осмій, іридій, паладій, рутеній і родій) корозійнотривкі, пластичні, мають гарний зовнішній вигляд. Вони знайшли застосування у ювелірній та в приладобудівній промисловості. В земній корі ці метали перебувають переважно у вільному стані.
Радіоактивні метали (уран, торій, паладій, плутоній, полоній, францій, радій, актиній) використовують для ядерних технологій, а також в контрольно-вимірювальних приладах.
2.1.2. Електронна будова атома та періодична система елементів
Характерні фізичні, хімічні та механічні властивості, які відрізняють метали від інших елементів, визначаються електронною будовою їх атомів. Число^
онів у електрично нейтральному атомі будь-якого елемента дорівнює його ЄЛЄК ковому номеру в періодичній системі Дмитра Менделєєва. Електрони атома П°Р гувають на строго визначених енергетичних рівнях (орбітах), що відповідають повним квантовим числам п (п = 1,2, 3,4,5, 6,1).
г°; Енергетичні рівні в свою чергу поділяються на підрівні (орбіталі), які поз-іоться буквами s, p, d\f. Максимальна кількість електронів на підрівнях
на . 5 2, р — 6, d — 10, /— 14. Зі збільшенням величини и збільшується
■дстань електрона від ядра, а отже, підвищується його енергія.
Зростання енергії електронів і послідовність заповнення ними енергетичних рівнів (и = 1, 2, 3, 4, 5, 6, 7) та підрівнів (s, p, d,J) відбувається за такою схемою:
1j->2s—>2p—>3.s—>3p—>4s—>3rf->4p—>5s^>4</—>5p—>6s—Ц/—>5rf—>6p^7j—>5/—>6d.
Користуючись цією схемою і знаючи порядковий номер елемента, можна побудувати електронну модель атома. В цій моделі числами 1, 2, 3, 4, 5, 6, 7 позначають енергетичні рівні, буквами s,p, d,f—енергетичні підрівні, а число електронів у підрівні пишуть у вигляді степеня. Наприклад, електронна модель натрію (№ 11) це
Ь^гр'З*1,
тобто на першому енергетичному рівні перебуває два електрони, що займають підрівень Is, на другому рівні—вісім електронів, що займають підрівні 2.$ (два електрони) і 2р (шість електронів), на третьому рівні—один електрон (підрівень 3s). Саме розподіл електронів на енергетичних рівнях і підрівнях є причиною періодичних змін валентності елементів і їх властивостей зі збільшенням атомного номера.
2.1.3. Типи міжатомних зв'язків у твердих тілах
Тип зв'язку міме елементарними частинками в твердому тілі (кристалі) визначається електронною будовою атомів, які взаємодіють. Найважливіші зв'язки: іонний, ковалентний і металевий. Тип зв'язку істотно впливає на властивості матеріалу.
Іонний зв'язок виникає між:різнорідними атомами, наприклад натрію іхЛору, °дин з яких віддає свій валентний електрон і перетворюється у позитивно заряджений іон (Na*), а інший приймає електрон і стає негативно зарядженим юном (СІ'). Отже, іонний зв'язок обумовлюється електростатичною взаємоді-єк> протилежно заряджених іонів. Такий зв'язок типовий для неорганічних сполук. У більшості випадків іонні кристали — діелектрики.
Ковалентний зв'язок створюється за рахунок об'єднання валентних
еукпгронів сусідніх атомів у одному енергетичному рівні (зовнішній орбіті).
0 єднані електрони належать водночас обом атомам і перебувають на спільній
°Рбіті. Ці електрони мають протилежно скеровані спіни і взаємодіють як два
електромагніти. Ковалентний зв'язок утворюють як однорідні атоми (кремній, вуглець в кристалічній гратці алмазу), так і різнорідні (залізо — вуглець у хімічній сполуці Fe3C, алюміній — азот у хімічній сполуці A1N). Ковалентний зв'язок дуже міцний. Багато кристалів з таким зв'язком відзначаються високою температурою топлення, значною твердістю (карбіди, нітриди) і суттєвою зносотривкістю.
Металевий зв'язок реалізується за рахунок електростатичної взаємодії міме позитивно зарядженими іонами та негативно зарядженими вільними електронами. Валентні електрони атомів металу порівняно легко втрачають зв'язок зі своїми ядрами, утворюючи т. зв. електронний газ. Металевий зв'язок не скерований в одному напрямку. Добра електро- і теплопровідність металів забезпечується вільними електронами.
2.1.4. Кристалічна будова металів
Кристалічна будова характеризується закономірним, геометрично правильним розташуванням атомів (іонів) у просторі.
Атоми (іони) металу перебувають на такій регулярній відстані між собою, при якій енергія взаємодії позитивно і негативно заряджених частинок мінімальна. Якщо через центри атомів кристалу провести лінії, то отримаємо просторову ґратку, а якщо через ряди атомів провести площини, то утвориться безліч однакових елементарних геометричних фігур. Виділимо в просторовій ґратці кристалу такий об'єм, що дає уявлення про будову всього кристалу і назвемо цей об'єм елементарною кристалічною коміркою.
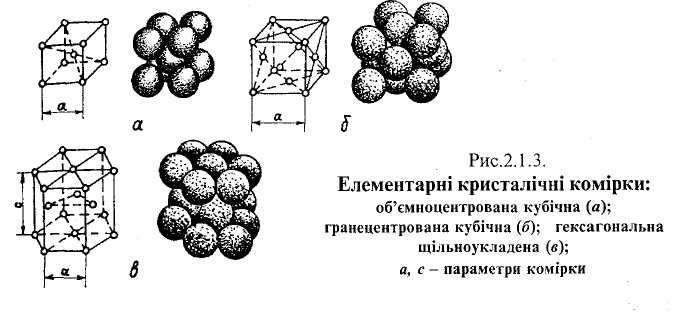
Отже, елементарною кристалічною коміркою називається такий найменший об'єм, який дає нам уявлення про взаємне розташування атомів у всьому кристалі. Переважна більшість металів має одну з перелічених нижче елементарних кристалічних комірок:
кубічну об'ємноцентровану;
кубічну гранецентровану;
гексагональну щільноукладену.
Кристалічну комірку зображають вузлами (точками), що відповідають положенню центрів атомів у стані спокою, сполучених уявними прямими лініями.
В елементарній кристалічній комірці об'ємноцентрований куб (ОЦК) вісім атомів розташовано на перетині ребер куба (рис.2.1.3, а) і один— на перетині його діагоналей. Названу будову (ОЦК) мають метали: калій, натрій, /3-титан. /J-цирконій, тантал, вольфрам, ванадій, а-залізо, хром та інші.
Елементарну кристалічну комірку характеризують: параметр, число атомів, що припадає на одну елементарну комірку, коефіцієнт компактності та коордй" наційне число.
Параметр кристалічної комірки — величина, яка визначає її лінійні розміри-Очевидно, що для кубічної комірки параметром є довжина ребра куба а, яка вимірюється в нанометрах (нм). Один нанометр 1 нм = ID"9!»!. Для металів з кубічної" елементарною коміркою значення а знаходиться в межах 0,2.. .0,6 нм.
Число атомів, що припадає на одну елементарну комірку, для випадку Об'ємноцентрованого куба можна визначити так. Кожен атом, розташований на перетині ребер куба, належить одночасно 8 елементарним коміркам. Таких атомів у комірці вісім. Атом, що є в центрі комірки, належить тільки їй. Тому число атомів, яке припадає на одну елементарну комірку ОЦК, становить (1/8) -8+1=2.
Коефіцієнт компактності комірки визначають як відношення об'єму, зайнятого атомами в межах куба, до об'єму куба. При розрахунках атоми розглядають як жорсткі кулі, що дотикаються між собою. У випадку об'ємно-центрованого куба ця величина становить 0,68.
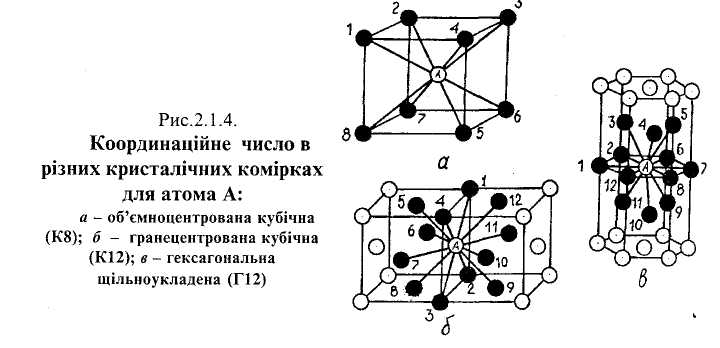
Координаційне число — це кількість атомів, розташованих на найближчих і однакових відстанях від будь-якого атома в ґратці. Атом А (рис.2.1.4,а), що в Центрі куба, перебуває на найближчій і однаковій відстані від атомів 1...8, розташованих на перетині його ребер, тобто координаційне число цієї ґратки Дорівнює 8, або К8. Що менше координаційне число, то менший коефіцієнт компактності комірки.
Елементарна кристалічна комірка гранецентрований куб (ГЦК) має вісім атомів на перетині ребер (рис.2.1.3,б) і шість атомів— на перетині діагоналей граней куба. Таку будову мають: свинець, нікель, срібло, золото, платина, У-залізо та інші метали.
Число атомів, що припадає на одну елементарну комірку гранецентрованого куба, буде (1/8) • 8 + (1/2) • 6 = 4. В цьому випадку число один вносять атоми, які є На перетині ребер і число три — атоми, які є в центрі граней, оскільки кожен з атомів в центрі граней належить одночасно двом сусіднім коміркам.
Коефіцієнт компактності комірки для ГЦК становить 0,74, координаційне ис.іо-—К12 (атоми і... 12 (рис. 2.1.4,6) є на найменшій і однаковій відстані від тома А, який перебуває в центрі грані, тобто це атоми 1...4, розташовані на еРетині ребер куба, атоми 5...8 і 9...12 в центрі граней сусідніх комірок).
* гексагональній щільноукладеній комірці (ГЩК) атоми розташовані в
Параметрами гексагональноїщільноукладеноїкомірки є її висота с і довжина а грані при с/а = 1,633. На одну елементарну гексагональну щільноукладену комірку припадає шість атомів—два із 12 атомів, що є в кутах основ [(1/6) ■ 12 = 2], один, що є в центрі двох основ [( 1/2 ) • 2 = 1] і три атоми між основами призми.
Коефіцієнт компактності комірки становить 0,74, координаційне число — 12 (Г12). На найменшій і однаковій відстані від атома А (рис.2.1.4,в), який є в центрі спільної основи сусідніх шестигранних призм, перебувають атоми 1... 12. Серед них атоми 1, 2, 6, 7, 8, 12 у вершинах шестикутника і атоми 3,4,5 та 9,10,11 у середній площині сусідніх призм.
2.1.5. Кристалографічні позначення атомних площин
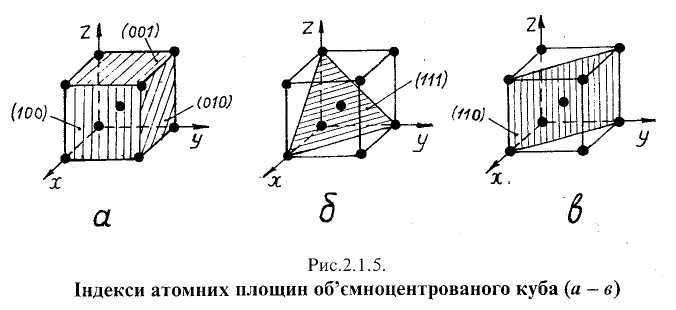
Розташування площин, що проходять через центри атомів просторових Ґраток, враховують у випадках, коли обговорюють властивості кристалів. Щоб визначити положення атомної площини відносно ґратки, проводять впродовж ребер будь -якої елементарної комірки осі координат з початком у спільному вузлі й фіксують точки перетину т, п,р даної площини відповідно з осями х, у, Z- За одиницю вимірювання вздовж осей приймають параметр елементарної кристалічної комірки. Числовими величинами, що визначають орієнтацію даної площини (чи системи паралельних площин) відносно вибраних осей, є індекси Міллера h, k, I — цілі раціональні числа, обернені довжинам відрізків, що відсікаються цією площиною на осях координат. На осі х відсікається відрізок h - Ут, на осі у — відрізок k = 1/иі на осі z—відрізок/= Ур. Якщо площина відсікає на осі від'ємний відрізок, то над відповідним індексом ставлять знак мінус. Індекси площини записують у круглих дужках без розділових знаків, наприклад (100), (010).
Для комірки, зображеної на рис.2.1.5,а, індексам Міллера (100) відповідають відрізки 1, <*>, оо, тобто 1/1 - 1; 1/°°= 0; 1/°°= 0. Розглядаючи різні атомні площини, що проходять через ОЦК комірку, можна дійти висновку, що щільність укладки атомів в площині (110)—рис.2.1.5, в більша, ніж в площинах (100), (010) і (001). Доведено, що опір переміщенню однієї частини кристалу відносно іншої під час пластичної деформації є найменшим у площинах щільної укладки атомів (ігпощинах ковзання). Площиною ковзання в ОЦК гратці є (110) і в ГЦК ґратці — (111). Оскільки в різних площинах просторової ґратки атоми розташовані на різних відстанях між собою, властивості кристалу в таких площинах різні.
Відмінність властивостей окремо взятого кристалу (.монокристалу) в різних кристалографічних напрямках називають анізотропією. Реальні метали — це полікристали, які складаються із величезної кількості анізотропних, але різно орієнтованих кристаликів—зерен, з огляду на що властивості таких металів у всіх напрямках статистично усереднені, а тому однакові (ізотропні). Іноді невпорядкована орієнтація зерен набуває більшої чи меншої впорядкованості, зокрема, внаслідок великої холодної пластичної деформації і поліристалічний метал стає анізотропним. Анізотропію необхідно брати до уваги при силових розрахунках певних елементів конструкції.
2.1.6. Дефекти кристалічної будови
Реальні кристали на відміну від ідеальних мають багато різних дефектів. ''ід дефектом розуміють зону кристалу, де порушено правильне розташування шполйв. За геометричною ознакою дефекти кристалічної будови поділяють на:
■ точкові;
лінійні;
поверхневі;
■ об'ємні.
65
2.1.6.1. Точкові дефекти
Точкові дефекти (нульвимірні) дуже малі в усіх трьох вимірах у просторі: їх розміри не перевищують декількох параметрів кристалічної комірки. До таких дефектів належать вакансії, міжвузлові атоми, атоми домішок тощо.
Вакансією називається порожнє місце в кристалі, де мав би перебувати атом (рис.2.1.б,а). Утворення вакансії за механізмом Шотткі бачимо на.рис.2.1. 7. Оскільки атоми коливаються навколо положення рівноваги, то окремий атом, наприклад, атом / з вищою ніж середня енергією, покидає вузол кристалічної ґратки й потрапляє на поверхню кристалу або на границю між зернами. На місці, де перебував атом 1, утворилась вакансія (рис.2.1.7,а), яку заповнює згодом атом 2 (рис.2.1.7,б), а потім атом 3 (рис.2.1.7,в). В результаті відбувається міграція вакансії в глибину кристалу.
Кожній температурі відповідає своя рівноважна концентрація вакансій. Що вища температура кристалу, то більше в ньому вакансій і частіше вони переходять від вузла до вузла. При температурі, близькій до температури топлення металу, кількість вакансій становить близько 1 % від числа атомів у кристалі. Пересичення вакансіями може наступити внаслідок раптового охолодження під час гартування, пластичної деформації або опромінення металу нейтронами. З часом пересиченість вакансіями зменшується за рахунок їх виходу на поверхню кристалу чи на границі зерен. Вакансії сприяють перебігу дифузійних процесів. Зі збільшенням кількості вакансій зменшується густина, електро- і теплопровідність кристалу.
Міжвузловим вважається атом, що вийшов із положення рівноваги і зайняв простір між: вузлами (рис.2.1.6,6). На його місці утворилась вакансія (на рисунку не показана). Перехід атомів у міжвузлове положення викликає опромінення нейтронами і значно менший вплив мають теплові коливання атомів.
Атоми домішок є навіть у найчистішому металі. Вони або заміщають атоми 66
основного металу у вузлах кристалічної ґратки (рис. 2.1.6, в) або розташовуються між вузлами (як на рис.2.1.6, б).
У близькому оточенні точкових дефектів кристалічна гратка викривляється (рис.2.1.6). Такі спотворення суттєво не позначаються на механічних властивостях металу, зате вони позначаються на деяких його фізичних властивостях, наприклад, на електроопорі.
2.1.6.2. Лінійні дефекти
Лінійні порушення будови кристалу мають малі розміри в двох вимірах і велику довжину в третьому. Дуже важливими серед лінійних дефектів є крайові та гвинтові дислокації. їх назва походить від латинського слова dislocation, що в перекладі означає розміщення.
Крайова дислокація — це лінія АВ (рис. 2.1.8, б) на краю зайвої атомної півпло-щини ABEG в кристалі. Одним із способів утворення крайової дислокації є зсув частини атомів кристалу відносно іншої частини атомів на ділянці площини ковзання ABCD (рис.2.1.8,а) під дією прикладеної сили F. Внаслідок такого зсуву у верхній частині кристалу маємо на одну атомну площину більше (рис.2.1.8,6), ніж у нижній. Зайва площина ABEG, яка перпендикулярна до напрямку зсуву, називається екстраплощиною. Вона не має продовження у нижній частині кристалу. Екстраплощина ніби розклинює кристал, зближаючи атоми над дислокацією і розсуваючи їх під нею. Тому в невеликій спотвореній зоні —ядрі дислокації — міжатомні відстані менші або більші від нормальних, а поза межами ядра вони нормальні. Крайова дислокація АВ простягається на багато тисяч міжатомних відстаней. Пересування дислокації під дією сили може відбуватись доти, поки вона не вийде на поверхню кристалу, де утвориться сходинка (рис.2.1.8,в). Якщо екстраплощина є у верхній частині кристалу, то дислокація умовно вважається позитивною і позначається знаком _1_, а якщо екстраплощина лежить у нижній його частині, то — негативною і позначається Т.
Дислокації можуть взаємодіяти як між собою, так і з іншими дефектами. Оскільки над дислокацією існує локальна зона пружних деформацій стиснення, то сусідні дислокації з однаковим знаком взаємно відштовхуються, а з протилежним знаком — взаємно притягаються. При цьому дислокації з різними знаками, рухаючись на зустріч в одній площині ковзання, можуть взаємно знищуватись (анігілювати), утворюючи з двох півплощин одну повну площину.
67
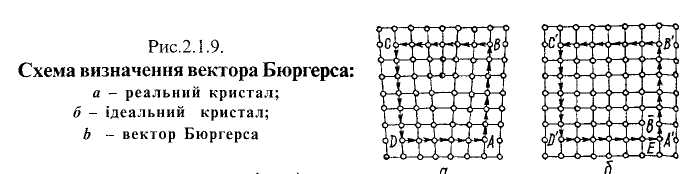

Спотворення кристалу в ядрі дислокації оцінюють вектором Бюргерса. Для знаходження вектора Бюргерса розглянемо два кристали: один—недосконалий із крайовою дислокацією (рис. 2Л.9д)\ другий досконалий без дислокації (рис.2.1.9, б). Навколо крайової дислокації за межами спотвореного ядра, тобто в тих вузлах, де спотворень практично немає, проведемо від вузла А (рис.2.1.9,а) контур у вигляді вертикальних і горизонтальних відрізків АВ, ВС, CD і DA, що з'єднують сусідні вузли ґратки. Він замкнеться на відрізку DA, який складається не з шести, а з п'яти міжатомних відстаней. Якщо такий самий шлях від вузла до вузла пройти в досконалому кристалі, то відрізок D'A' помістить в собі шість міжатомних відстаней. Різниця довжин відрізка D'A' контура в досконалому кристалі і відрізка DA контура в криспіалі з крайовою дислокацією називається вектором Бюргерса й позначається буквою Ь. Вектор Бюргерса дорівнює одній міжатомній відстані й у випадку крайової дислокації перпендикулярний до лінії дислокації АВ (рис.2.1.8, б)
Кількісною характеристикою дислокаційної структури є густина дислокацій д яка дорівнює відношенню сумарної довжини дислокацій 'Zldo об'єму кристалу v:
Р=|^ сг.і.1)
Густина дислокацій помітно впливає на механічні властивості: з її збільшенням зростає міцність і знижується пластичність металів.
Дислокації виникають під час кристалізації, пластичної деформації, фазових перетворень. Швидкість дифузії вздовж дислокацій значно вища, ніж в кристалах без дислокацій.
Гвинтова дислокація є лінією АВ (рис.2.1.10), що нею обмежена площина Q, якщ відбувся зсув сусідніх частин кристалу на одну міжатомну відстань в напрямку дії сил F. При цьому паралельні атомні площини в безпосередній близькості від лінії дислокації АВ трасформуються у гвинтову поверхню. В ядрі дислокації атоми зсунуті з положень рівноваги. Гвинтові дислокації, на відм'нУ від лінійних, не притягують вакансій і міжвузлових атомів. Гвинтова дислокація вважається правою, якщо хід її гвинтової поверхні такий, як у правої різі і лівою, якщо хід— яку лівої різі.
Теорія дислокацій вперше була застосована в 30-х роках 20-го століття для пояснення процесу пластичної деформації в кристалічних тілах і для врахування величезної невідповідності між теоретичною і практичною міцністю металів.
