
Физика / 5
.docxКонтрольный блок 5
Теоретические вопросы:
-
Что такое теплоемкость?
-
Какой процесс называется адиабатным?
-
Что такое внутренняя энергия?
-
Какой газ называют идеальным?
Тест:
-
Чему равна удельная теплоемкость (Суд.) ?
-
С=
 (ΔТ- изменение температуры, ΔQ-изменение
количества тепла, m-масса)
(ΔТ- изменение температуры, ΔQ-изменение
количества тепла, m-масса)
-
С=
 (n-количество
моль)
(n-количество
моль) -
С= М*С (М- молярная масса)
-
С=
 (dV-
изменение объема, dT-
изменение температуры)
(dV-
изменение объема, dT-
изменение температуры)
2. Первое начало термодинамики в общем виде:
-
Q= A (А-работа)
-
Q= ∆U (∆U- изменение внутренне энергии)
-
А= ∆U (∆U- изменение внутренне энергии)
-
Q= A+ ∆U (∆U- изменение внутренне энергии, А-работа)
3. Чему равна молярная теплоемкость?
-
С=
 (dV-
изменение объема, dT-
изменение температуры)
(dV-
изменение объема, dT-
изменение температуры)
-
С=
 (ΔТ- изменение температуры, ΔQ-изменение
количества тепла, m-масса)
(ΔТ- изменение температуры, ΔQ-изменение
количества тепла, m-масса)
-
С=
 (n-количество
моль)
(n-количество
моль)
-
С=
 (dT-
изменение температуры, dQ-
изменение количества тепла)
(dT-
изменение температуры, dQ-
изменение количества тепла)
4. Как называется процесс, при постоянной температуре?
-
изохорным
-
адиабатным
-
изобарным
-
изотермическим
5. Чему равен показатель адиабаты γ?
-
γ=
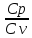 (Ср- теплоемкость при постоянном
давлении, Сv-теплоемкость
при постоянном объеме)
(Ср- теплоемкость при постоянном
давлении, Сv-теплоемкость
при постоянном объеме)
-
γ=
 (Ср- теплоемкость при постоянном
давлении, Сv-теплоемкость
при постоянном объеме)
(Ср- теплоемкость при постоянном
давлении, Сv-теплоемкость
при постоянном объеме)
-
γ= Ср – Сv (Ср- теплоемкость при постоянном давлении, Сv-теплоемкость при постоянном объеме)
-
γ= Сv - Ср (Ср- теплоемкость при постоянном давлении, Сv-теплоемкость при постоянном объеме)
6. Как выглядит уравнение Пуассона?
-
PVγ = const (Р-давление, V-объем)
-
PV= const (Р-давление, V-объем)
-
RT= const (R-газовая постоянная, Т-температура)
-
VT= const (V-объем, Т-температура)
7. Первое начало термодинамики для изохорного процесса?
-
Q= T (Т-температура)
-
Q= A (А-работа)
-
Q=∆U (∆U- изменение внутренне энергии)
-
Q=0
8. Формула внутренней энергии?
-
U= PV (Р-давление, V-объем)
-
U=RT (R-газовая постоянная, Т-температура)
-
U= VT (V-объем, Т-температура)
-
U=
 PV
(Р-давление, V-объем)
PV
(Р-давление, V-объем)
9. Первое начало термодинамики для изотермического процесса?
-
Q= A (А-работа)
-
Q=T (Т-температура)
-
Q= ∆U (∆U- изменение внутренне энергии)
-
Q= A+ ∆U (∆U- изменение внутренне энергии, А-работа)
10. Первое начало термодинамики для адиабатного процесса?
-
Q=0
-
Q= ∆U (∆U- изменение внутренне энергии)
-
Q= A (А-работа)
-
Q=T (Т-температура)
Задачи:
№1.
Какова
внутренняя энергия 15 моль одноатомного
газа при температуре 28˚С
?

Дано: СИ
Т= 28˚С
N= 15 моль
∆U-?
Решение: Переведем температуру из градусов в кельвины.
28˚С+ 273= 301 К
Внутреннюю энергию одноатомного газа можно найти по формуле:
U=
 nRT
(n-количество
моль, R-
газовая постоянная, Т- температура)
nRT
(n-количество
моль, R-
газовая постоянная, Т- температура)
U
=
 *15*8.31*301=
56279 Дж
*15*8.31*301=
56279 Дж
Ответ: 56279 Дж
№2.
При
увеличении давления в 1,5 раза объем газа
уменьшился на 30 мл. Найдите первоначальный
объем.


Дано: СИ
∆V = 30 мл
Р2=1,5*Р1
V1-?
Решение: Для решения задачи используем закон Бойля- Мариотта, связывающий первоначальные Р1 и V1 и конечные Р2 и V2:
Р1*V1 = Р2*V2 (Р- давление, V- объем)
Согласно условию задачи: Р2=1,5*Р1 и ∆V=V1 – V2 = 30 мл.
Таким образом получаем: Р1*V1 = 1,5*Р1* (V1 - ∆V)
V1 = 3*∆V= 3*30=90 мл.
Ответ: V1 = 90 мл.
