
- •5.Задачи обогащения и способы обогащения.
- •6.Пирометаллургические процессы при переработки рудного сырья:
- •7.Химический и минералогический состав медных руд и концентратов
- •8.Назначение процесса обжига
- •9.Поведение сульфидов при окислительном обжиге.
- •10.Принцып обжига в кипящем слое
- •11. Обжиговые печи. Преимущества обжига в печах кипящего слоя.
- •13. Химизм обжига медных концентратов.
- •14. Температурный режим обжига медных концентратов
- •15. Степень десульфуризации обжига и факторы, влияющие на степень десульфуризации.
- •19. Состав и свойства шлаков и штейна.
- •20.Причины и формы потерь меди при плавке медных концентратов.
- •21. Задачи и принцип конверторной переработки медного штейна.
- •22. Поведение сульфидов различных металлов при конвертировании
- •25. Задачи электролетического рафинирования
- •26. Поведение элементов при электролизе меди в зависимости от величины окислительно-восстановительного потенциала и концентрации элемента в растворе. Напряжение разложения.
- •27. Процессы на электродах.
- •29. Режим электролиза и показатели процесса
- •33 Задачи обжига свинцового концентрата, способы обжига и показатели обжига.
- •34.Состав шихты, роль флюсов при агломерирующем обжиге, влияние влажности шихты на качество агломерата, состав агломерата.
29. Режим электролиза и показатели процесса
Характер протекания электродных процессов при электролизе зависит от многих факторов, важнейшими из которых являются состав электролита, материал электродов и режим электролиза (температура, плотность тока и т.д.).
Различают
электролиз расплавов и растворов
электролитов.
Электролиз
расплавов электролитов. Электролиз
расплава соли с использованием инертных
электродов показан на следующей схеме:
Анод При высоких температурах расплав соли
диссоциирует на ионы:MgCI2---Mg+2+2CI-.
Прохождение
электрического тока через расплав
обусловлено тремя одновременно
протекающими процессами:
направленное
движение катионов Мg2+
к катоду, а анионов Cl-
- к аноду;
восстановление,
происходящее на катоде: Мg2+
+2е=
Мg
окисление,
происходящее на аноде: 2CI-=
CI2+2е
Суммарное
уравнение электролиза после уравнивания
числа отдаваемых и присоединенных
электронов принимает вид: Мg2++2CI-
=
Мg+ CI2
При высоких температурах расплав соли
диссоциирует на ионы:MgCI2---Mg+2+2CI-.
Прохождение
электрического тока через расплав
обусловлено тремя одновременно
протекающими процессами:
направленное
движение катионов Мg2+
к катоду, а анионов Cl-
- к аноду;
восстановление,
происходящее на катоде: Мg2+
+2е=
Мg
окисление,
происходящее на аноде: 2CI-=
CI2+2е
Суммарное
уравнение электролиза после уравнивания
числа отдаваемых и присоединенных
электронов принимает вид: Мg2++2CI-
=
Мg+ CI2
Характер окислительных процессов зависит также от материала электродов. Различают нерастворимые (инертные) и растворимые (активные) электроды.
Инертные электроды изготавливаются обычно из графита, угля, платины; в процессе электролиза они химически не изменяются, а служат лишь для передачи электронов во внешнюю цель. При использовании инертных анодов следует учитывать следующее: В первую очередь окисляются простые анионы в порядке возрастания их Ео, не превышающих
+ 1,5 В (S2-, J-, Br-, Cl-). При электролизе водных растворов, содержащих анионы кислородосодержащих кислот (CO32-, NO3-, SO4-2, PO43- и др.), на аноде окисляются не эти анионы, а молекулы воды. Количественные характеристики электролитических процессов устанавливаются двумя законами Фарадея: 1)Масса веществ, выделившихся на электродах при электролизе, прямо пропорциональна количеству электричества, прошедшего через раствор или расплав электролита. 2) При пропускании одинакового количества электричества через растворы или расплавы различных элементов масса веществ, выделяющихся на электродах, пропорциональна молярным массам их эквивалентов.
Показателем
эффективности электролиза является
выход по току η, %, определяемый как
отношение массы вещества, фактически
полученной в данных условиях электролиза
m практ,
к массе вещества, теоретически вычисленной
на основании закона Фарадея m теор:
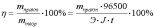 .
.
Выход по току при электроосаждении зависит от концентрации металла и серной кислоты в электролите, плотности тока, температуры, загрязненности электролита примесями и состояния катодной поверхности.
Повышение концентрации цинка в электролите при постоянной концентрации H2SO4 повышает эффективность использования электрического тока. Напротив, обеднение электролита цинком в ходе электролиза приводит к снижению выхода по току, которое становится особенно ощутимым.
Увеличение катодной плотности тока повышает выход по току, несколько компенсируя влияние возрастания кислотности электролита.
Сближение электродов обеспечивает снижение напряжения на ванне и удельного расхода электроэнергии. Поэтому расстояние между электродами стремятся поддерживать минимальным. В настоящее время в зависимости от конструкции ванны и условий электролиза расстояние между осями одноименных электродов составляет 55 – 70 мм.
Повышение плотности тока положительно влияет на выход по току, но напряжение на ванне при этом увеличивается.
30. Поведение примесей меди при электролизе.
1.наиболее электроотрицательные по сравнению с медью (полностью растворяются на аноде и могут попасть в катодную медь(железо,олово,свинец,никель,кобольт.))
2.мышьяк,сурьма висмут,их электродные потенциалы близки к меди и поэтому переходы в катодные осадки наиболее вероятнее.
3.благородные металлы-наиболлее электроположительными и анодно нерастворяются.
4.примеси представленные растворенной меди хим. Соединения типа Cu2S,CuTe.следовательно эл.хим нейтральны и малой растворимостью в электролите практически полностью переходят в шлам.как и 3 группа.
При получении цинка, медь не только ухудшает качество катодного цинка, но и вызывает резкое снижение выхода по току, когда содержание ее в электролите превышает допустимое.
Медь, осаждаясь вместе с цинком на катоде, вызывает образование черного губчатого осадка и резко снижает выход по току, вследствие коррозии катодного цинка из-за образования короткозамкнутых пар. Очистку растворов от меди ведут при содержании ее в электролите 0,1 мг/дм3. При такой концентрации получают катодный цинк высших марок.
30. Поведение примесей меди при электролизе.( второй вариант)
Основными требованиями, предъявляемыми к электролиту, являются его высокая электропроводность (низкое электрическое сопротивление) и чистота. Однако реальные электролиты, помимо сульфата меди, серной кислоты, воды и необходимых добавок, обязательно содержат растворенные примеси, содержащиеся до этого в анодной- меди. Поведение примесей анодной меди при электролитическом рафинировании определяется их положением в ряду напряжений. По электрохимическим свойствам примеси можно разделить на четыре группы: I группа — металлы более электроотрицательные, чем медь (Ni, Fe, Zn и др.); II группа — металлы, близко стоящие в ряду напряжений к-меди (As, Sb, Bi); III группа — металлы более электроположительные, чем медь (Au, Ag и платиноиды); IV группа — электрохимически нейтральные в условиях рафинирования меди химические соединения (Cu2S, Cu2Se, Cu2Te, AuTe2,Ag2Te). Примеси первой группы, обладающие наиболее электроотрицательным потенциалом, практически полностью переходят в электролит. Исключение составляет лишь никель, около 5% которого из анода осаждается в шлам в виде твердого раствора никеля в меди. Твердые растворы по закону Нернста становятся даже более электроположительными, чем медь, что и является причиной их перехода в шлам.
примеси II группы (As, Sb, Bi), имеющие близкие к меди электродные потенциалы, являются наиболее вредными с точки зрения возможности загрязнения катода. Будучи несколько более электроотрицательными по сравнению с медью, они полностью растворяются на аноде с образованием соответствующих сульфатов, которые накапливаются в электролите. Однако сульфаты этих примесей неустойчивы и в значительной степени подвергаются гидролизу, образуя основные соли (Sb и Bi) или мышьяковистую кислоту (As). Основные соли сурьмы образуют плавающие в электролите хлопья студенистых осадков («плавучий» шлам), которые захватывают частично и мышьяк.Таким образом, примеси II группы распределяются между электролитом, катодной медью и шламом.
Более электроположительные по сравнению с медью примеси (III группа), к которым относятся благородные металлы (главным образом, Au и Ag), в соответствии с положением в ряду напряжений должны переходить в шлам в виде тонкодисперсного остатка. Для уменьшения растворимости серебра и перевода его в шлам в состав электролита вводят небольшое количество иона хлора. .
Аналогично электроположительным примесям ведут себя при электролизе меди химические соединения (примеси IV группы). Поэтому при электролизе меди в электродных процессах они не участвуют и по мере растворения анода осыпаются на дно ванны. В виде селенидов и теллуридов переходят в шлам более чем 99% селена и теллура.
Таким образом, в результате электролитического рафинирования анодной меди все содержащиеся в ней примеси распределяются между катодной медью, электролитом и шламом'.
31. Оборудование для электролитического рафинирования меди.
Электролиз ведут в ваннах ящичного типа длиной 3-5,5, шириной 1 и глубиной 1,2-1,3 м, футерованных внутри кислотостойкими материалами (винипласт, стеклопластик и др.). В ванне подвешивают аноды и между ними катоды — пластины из чистой меди
Оригинальный процесс автогенной плавки сульфидных медных и медно-цинковых концентратов, названный авторами данной книги «плавкой в жидкой ванне», начал разрабатываться в Советском Союзе в 1951 г. Дальнейшие разработка и внедрение до 1986 г. велись под общим научным руководством проф. А.В. Ванюкова.
32.состав свинцовых руд и концентратов
Основным сырьем для производства свинца являются сульфидные полиметаллические руды, содержащие не более 8-9 % свинца. Руды подвергают обогащению, в результате получают свинцовые сульфидные концентраты, содержащие 30-80 % РЬ, 1-14 % Zn, до 10 % Си, 2-15 % Fe, 9-15 % S, 2-13%Si02, до 5 кг/т (Аи + Ag).
Свинцовый агломерат представлен в основном оксидами металлов и компонентами пустой породы (PbO, nPbG-mFe203, Cu20, ZnO, ZnOFe203, Zn0Si02, Si02, A1203, CaO, MgO и т.д.), небольшим количеством сульфидов (ZnS, Cu2S, FeS, PbS), сульфатами и карбонатами (CaS04, ZnS04, СаСОз).
