
- •Понятие равновесного термодинамического процесса. Изображение различных термодинамических процессов в диаграммах состояния.
- •Уравнение состояния идеального газа. Физический смысл газовой постоянной.
- •Внутренняя энергия идеального и реального газа. Свойства идеального газа.
- •Понятие теплоты и работы в термодинамике. Основное сходство и различие понятий.
- •5)Аналитическое выражение первого закона термодинамики для равновесных и неравновесных процессов.
- •6) Физический смысл и свойства энтальпии идеального газа.
- •7) Теплоемкость идеального газа. Зависимость теплоемкости от термических параметров состояния.
- •8. Зависимость теплоемкости идеального газа от характера процесса. Уравнение Майера.
- •9. Способы задания состава газовых смесей. Газовая постоянная и молекулярная масса смеси.
- •10. Газовые смеси. Закон Дальтона, теплоемкость смеси.
- •11. Уравнение первого закона термодинамики для потока газа. Понятие технической работы. Первый закон термодинамики для потока
- •12. Понятие энтропии идеального газа. Свойства энтропии.
- •13. Тепловая диаграмма. Изображение термодинамических процессов в тепловой диаграмме
- •14. Политропный процесс для идеального газа. Теплоемкость политропного процесса. Политропные процессы
- •Уравнение процесса
- •Теплоемкость политропных процессов
- •15. Изотермический процесс для идеального газа.
- •16. Изобарный процесс для идеального газа.
- •17. Изохорный процесс для идеального газа.
- •18. Адиабатный процесс. Показатель адиабаты.
- •19. Сущность второго закона термодинамики. Формулировка. Понятие теплового двигателя.
- •100% Энергии не может быть преобразовано в работу
- •Эффективность теплового двигателя
- •20. Термодинамический цикл. Термический кпд цикла.
- •Термический кпд тепловых машин
- •21. Сравнение термического кпд произвольного цикла и термического кпд цикла Карно. Регенеративный цикл Карно.
- •Регенеративный (обобщенный) цикл Карно
- •22. Изменение энтропии в необратимых процессах. H-s диаграмма необратимого адиабатного процесса.
- •23. Энтропия изолированной системы. Физический смысл энтропии.
- •24. Второй закон термодинамики для обратимых и необратимых процессов.
- •27. Цикл двс со смешанным подводом теплоты(изохорно-изобарный цикл),его термодинамический кпд.
- •28. Сравнение эффективности циклов двс
- •31. Классификация видов теплообмена.
- •32. Закон Фурье.
- •33. Коэффициент теплопроводности. Физический смысл. Свойства.
- •34. Дифференциальное уравнение теплопроводности.
- •35. Граничные условия 1-го и второго рода.
- •41. Теплопроводность цилиндрической стенки в граничных условиях 1-го рода.
- •42. Теплопроводность цилиндрической стенки в граничных условиях 3-го рода.
9. Способы задания состава газовых смесей. Газовая постоянная и молекулярная масса смеси.
Способы задания смеси. Состав газовой смеси может быть задан массовыми, объемными или мольными долями.
Массовой долей называется отношение массы отдельного компонента Мi, к массе смеси М:
![]() .
Очевидно, что
.
Очевидно, что  и
и

Массовые
доли часто задаются в процентах. Например,
для сухого воздуха ![]() ;
; ![]() .
.
Объемная доля
представляет собой отношение приведенного
объема газа V, к полному объему смеси V: ![]() .
.
Приведенным называется объем, который занимал бы компонент газа, если бы его давление и температура равнялись давлению и температуре смеси.
Для вычисления приведенного объема запишем два уравнения состояния i-го компонента:
![]() .
.
Первое уравнение относится к состоянию компонента газа в Смеси, когда он имеет парциальное давление pi и занимает полный объем смеси, а второе уравнение — к приведенному состоянию, когда давление и температура компонента равны, как и для смеси, р и Т. Из уравнений следует, что
![]() .
(2.2)
.
(2.2)
Просуммировав соотношение (2.2) для всех компонентов смеси, получим с учетом закона Иногда бывает удобнее задать состав смеси мольными долями. Мольной долей называется отношение количества молей Ni рассматриваемого компонента к общему количеству молей смеси N.
Пусть
газовая смесь состоит из N1 молей
первого компонента, N2 молей
второго компонента и т. д. Число молей
смеси  ,
а мольная доля компонента будет равна
,
а мольная доля компонента будет равна ![]() .
.
В
соответствии с законом Авогадро объемы
моля любого газа при одинаковых р и Т, в
частности при температуре и давлении
смеси, в идеально газовом состоянии
одинаковы. Поэтому приведенный объем
любого компонента может быть вычислен
как произведение объема моля ![]() на
число молей этого компонента, т. е.
на
число молей этого компонента, т. е. ![]() а
объем смеси — по формуле
а
объем смеси — по формуле ![]() .
Тогда
.
Тогда ![]() ,
и, следовательно, задание смесильных
газов мольными долями равно заданию ее
объемными долями.
,
и, следовательно, задание смесильных
газов мольными долями равно заданию ее
объемными долями.
Газовая
постоянная смеси газов.
Просуммировавуравнения для всех
компонентов смеси, получим  .
Учитывая
.
Учитывая 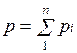 ,
можно записать
,
можно записать
![]() ,
где
,
где
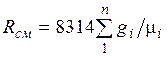
Из
уравнения (2.3) следует, что смесь идеальных
газов также подчиняется уравнению
Клапейрона. Поскольку ![]() то
из (2.4) следует, что газовая постоянная
смеси [Дж/(кг-К)] имеет вид
то
из (2.4) следует, что газовая постоянная
смеси [Дж/(кг-К)] имеет вид
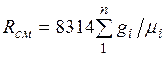
Кажущаяся
молекулярная масса смеси. Выразим
формально газовую постоянную смеси R,
введя кажущуюся окулярную массу
смеси ![]() :
: ![]() (2.6)
(2.6)
 .
.
Изопределения массовых долей следует, что
![]()
Просуммировав
это соотношение для всех компонентов
и учитывая, что  ,
получим выражение для кажущейся
молекулярной и массы смеси, заданной
объемными долями:
,
получим выражение для кажущейся
молекулярной и массы смеси, заданной
объемными долями:
 .
(2.7)
.
(2.7)
Соотношение
между объемными и массовыми
долями. Учитывая
(2.7), получаем  .
.
10. Газовые смеси. Закон Дальтона, теплоемкость смеси.
При расчетах тепловых устройств очень важным моментом является определение количества теплоты, участвующего в процессах. Точное его определение обеспечивает правильную оценку работы аппарата с технической и экономической точки зрения.
Сообщение телу теплоты вызывает изменение его состояния и в общем случае сопровождается изменением температуры. Было замечено, что для нагрева до одной и той же температуры двух различных тел одинаковой массы и в одинаковых условиях требуется различное количество теплоты. Следовательно, существует какое-то свойство тела, определяющее изменение его температуры в процессе подвода или отвода теплоты. Это свойство называют теплоемкостью тела. Таким образом, теплоемкость тела – это величина, характеризующая способность тела изменять свою температуру с подводом или отводом теплоты. Она равна количеству теплоты, которое надо подвести к телу, чтобы изменить его температуру на 1 К:
 Q/
Q/ ,
, ![]() Дж /
К,
в
дифференциальной форме, т. е. при подводе
элементарного количества тепла:
dQ/
Дж /
К,
в
дифференциальной форме, т. е. при подводе
элементарного количества тепла:
dQ/
Теплоемкость тела в общем случае не является характеристикой вещества (материала), из которого тело состоит. Она, в частности, будет зависеть от размеров тела. В зависимости от того, в каких единицах измеряется количество вещества – в килограммах, кубометрах, киломолях, различают:
- массовую (удельную) теплоемкость: c=C/m (Дж/кг К) т.е. теплоемкость одного килограмма вещества;
- объемную теплоемкость: с=С/V, (Дж/м3 К) т.е. теплоемкость одного кубометра вещества;
- мольную
теплоемкость:
 =
С/V,
( Дж/кмоль К)т.е. теплоемкость одного
киломоля вещества.
=
С/V,
( Дж/кмоль К)т.е. теплоемкость одного
киломоля вещества.
Очевидная
связь между этими величинами имеет вид:
![]()
Однако и эти величины еще не являются характеристиками вещества. Процесс нагревания или охлаждения может происходить в различных условиях: р = const, V = const, T = const, а также многих других. Значения теплоемкостей одного и того же вещества в разных процессах также будут различными. В частности, в соответствии с (1) теплоемкость в процессе при постоянной температуре оказывается бесконечно большой. В связи с этим теплоемкость называют функцией процесса.
Чтобы теплоемкость являлась физической характеристикой того или иного вещества, ее измерение необходимо проводить в одних и тех же условиях. Обычно экспериментальные измерения теплоемкостей проводят при р=const, V=const и определяют соответственно изобарную ср и изохорную сv теплоемкости. Разность между этими теплоемкостями для идеального газа, в соответствии с известной из физики формулой Майера, равна:
 ,
,
а отношение теплоемкостей
![]()
называется показателем адиабаты. Из молекулярно-кинетической теории идеальных газов известны численные значения показателя адиабаты, они зависят от числа атомов в молекуле газа:
- одноатомный газ k = 1,67;
- двухатомный газ k = 1,4;
- трех- и многоатомный газ k = 1,33.
Газовые смеси
В технике в качестве рабочих тел чаще используются не чистые вещества, а смеси различных газов. Под газовой смесью в данном случае понимают механическую смесь чистых веществ, называемых компонентами смеси, не вступающих друг с другом в химические реакции. Примером газовой смеси является воздух, основными компоненты которого являются кислород и азот. Если компонентами смеси являются идеальные газы, то и смесь в целом также будем считать идеальным газом.
При рассмотрении смесей предполагается, что:
- каждый газ, входящий в состав смеси, равномерно распределён по всему объёму, то есть его объём равен объёму всей смеси;
- каждый из компонентов смеси имеет температуру, равную температуре смеси;
- каждый газ создаёт своё давление на стенки сосуда, называемое парциальным давлением.
Парциальное давление, таким образом, это давление, которое имел бы компонент смеси, если бы он один занимал весь объем смеси при той же температуре. Сумма парциальных давлений каждого компонента равна давлению смеси (закон Дальтона):
![]() .
.
