
- •Понятие равновесного термодинамического процесса. Изображение различных термодинамических процессов в диаграммах состояния.
- •Уравнение состояния идеального газа. Физический смысл газовой постоянной.
- •Внутренняя энергия идеального и реального газа. Свойства идеального газа.
- •Понятие теплоты и работы в термодинамике. Основное сходство и различие понятий.
- •5)Аналитическое выражение первого закона термодинамики для равновесных и неравновесных процессов.
- •6) Физический смысл и свойства энтальпии идеального газа.
- •7) Теплоемкость идеального газа. Зависимость теплоемкости от термических параметров состояния.
- •8. Зависимость теплоемкости идеального газа от характера процесса. Уравнение Майера.
- •9. Способы задания состава газовых смесей. Газовая постоянная и молекулярная масса смеси.
- •10. Газовые смеси. Закон Дальтона, теплоемкость смеси.
- •11. Уравнение первого закона термодинамики для потока газа. Понятие технической работы. Первый закон термодинамики для потока
- •12. Понятие энтропии идеального газа. Свойства энтропии.
- •13. Тепловая диаграмма. Изображение термодинамических процессов в тепловой диаграмме
- •14. Политропный процесс для идеального газа. Теплоемкость политропного процесса. Политропные процессы
- •Уравнение процесса
- •Теплоемкость политропных процессов
- •15. Изотермический процесс для идеального газа.
- •16. Изобарный процесс для идеального газа.
- •17. Изохорный процесс для идеального газа.
- •18. Адиабатный процесс. Показатель адиабаты.
- •19. Сущность второго закона термодинамики. Формулировка. Понятие теплового двигателя.
- •100% Энергии не может быть преобразовано в работу
- •Эффективность теплового двигателя
- •20. Термодинамический цикл. Термический кпд цикла.
- •Термический кпд тепловых машин
- •21. Сравнение термического кпд произвольного цикла и термического кпд цикла Карно. Регенеративный цикл Карно.
- •Регенеративный (обобщенный) цикл Карно
- •22. Изменение энтропии в необратимых процессах. H-s диаграмма необратимого адиабатного процесса.
- •23. Энтропия изолированной системы. Физический смысл энтропии.
- •24. Второй закон термодинамики для обратимых и необратимых процессов.
- •27. Цикл двс со смешанным подводом теплоты(изохорно-изобарный цикл),его термодинамический кпд.
- •28. Сравнение эффективности циклов двс
- •31. Классификация видов теплообмена.
- •32. Закон Фурье.
- •33. Коэффициент теплопроводности. Физический смысл. Свойства.
- •34. Дифференциальное уравнение теплопроводности.
- •35. Граничные условия 1-го и второго рода.
- •41. Теплопроводность цилиндрической стенки в граничных условиях 1-го рода.
- •42. Теплопроводность цилиндрической стенки в граничных условиях 3-го рода.
Понятие равновесного термодинамического процесса. Изображение различных термодинамических процессов в диаграммах состояния.
Термодинамическим процессом называют всякое изменение состояние тела или системы, связанное с тепловыми явлениями. В термодинамическом процессе изменяется хотя бы один параметр, а значит совершается работа и происходит теплообмен. Равновесный термодинамический процесс – это процесс, при котором рабочее тело или система проходит непрерывный ряд равновесных состояний. Это понятие является термодинамическим идеалом, к нему стремятся все реальные системы, которые находятся в равновесном состоянии. Только равновесный термодинамический процесс можно изображать графически в виде кривой в координатах двух параметров состояния:
|
|
Уравнение состояния идеального газа. Физический смысл газовой постоянной.
Это
уравнение имеет вид:
 ;
где
;
где
P – полное давление: складывается Pизб+Pатм=Pабс из избыточного и атмосферного давления; (Па)
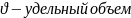 ;
который равен (м3/кг)
;
который равен (м3/кг)
R – универсальная газовая постоянная (Дж/кг*К)
Т – абсолютная температура (К)
С
учетом формулы
 уравнение состояние идеального газа
примет вид:
уравнение состояние идеального газа
примет вид:

С
учетом формулы
 уравнение примет вид:
уравнение примет вид:
 причем
причем
 ,
тогда уравнение преобразуется:
,
тогда уравнение преобразуется:

 – масса (кг);
– масса (кг);
М – молярная масса (кг/моль);
 – количество
вещества (моль)
– количество
вещества (моль)
Физический смысл универсальной газовой постоянной: Она численно равна работе расширения одного моля идеального газа в изобарном процессе при увеличении температуры на 1 К.
Внутренняя энергия идеального и реального газа. Свойства идеального газа.
Исходя из определения идеального газа, в нем отсутствует потенциальная составляющая внутренней энергии (т.е.отсутствуют силы взаимодействия молекул).
Таким образом внутренняя энергия идеального газа представляет собой только кинетическую энергию движения молекул.
Закон Джоуля: Закон термодинамики, согласно которому внутренняя энергия идеального газа является функцией одной лишь температуры и не зависит от объема.
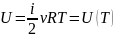
i – число степеней свободы молекулы газа:
Одноатомный газ (He, Ar …) i=3;
Двухатомный газ (H2 , O2 …) i=5:
Многоатомный газ (H2O, O3 …) i=6.
В случае реального газа необходимо учитывать потенциальную энергию взаимодействия молекул. А значит внутренняя энергия реального газа определяется следующим уравнением:
 (*)
(*)
Кинетическая энергия молекул:

где
 – молярная теплоемкость при V=const.
Потенциальная энергия молекул зависит
от расстояния между ними, поэтому она
должна быть функцией объема газа.
– молярная теплоемкость при V=const.
Потенциальная энергия молекул зависит
от расстояния между ними, поэтому она
должна быть функцией объема газа.
Согласно уравнению (*), внутренняя энергия реального газа должна быть функцией 2-ч параметров: V и Т.
Определим
 :
:
При расширении газа выполняется работа за счет изменения внутреннего молекулярного давления:
Эта работа равна изменению потенциальной энергии:
Проинтегрировав (2) с учетом (1) получим потенциальную энергию реального газа:

Значения
постоянной «с» нужно выбрать так, чтобы
при V потому что если V
потому что если V ,
то реальные газы по своим свойствам
приближаются к идеальным газам:
,
то реальные газы по своим свойствам
приближаются к идеальным газам:
V ; ; С=0.
Тогда из (3) уравнения потенциальная энергия равна :

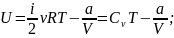
Свойства идеального газа:
-Взаимодействие между молекулами пренебрежимо мало;
-Расстояние между молекулами много больше размеров молекул;
-Молекулы выступают, как абсолютно упругие тела.



