
- •3 Законы Авогадро и обьем одного киломолия в нормальных условиях
- •6 Изложите физический смысл энтропии и приведите расчетные формулы для ее определения
- •7 Докозать что задание газовой смеси мольными долями равнозначно заданию объемными долями
- •9 Приведите способы задания газовой и докажите, что задание смеси мольными долями, равнозначно заданию у объемными долями.
- •22 Дайте определение компрессора, приведите диаграмму p,V – и объясните работу одноступенчатого компрессора.
- •20 Дайте полный анализ цикла двс с максимальным подводом теплоты.
- •21 Что такое термодинамический процесс? Классификация процессов и изображение их в диаграмме p,V –
- •22 Дайте определение компрессора, приведите диаграмму p,V – и объясните работу одноступенчатого компрессора.
- •23 В чем суть внутренней энергии системы? Из каких видов движений микрочастиц она состоит?
- •26 Вывод и характеристика критерия Рейнольдса.
- •27 Получите выражение для работы расширения. Покажите, что площадь под кривой процесса в p,V – диаграмме численно равна работе
- •29 .Получите уравнение первого закона термодинамике. Дайте формулировку этого закона
- •37Дайте определения теплопередачи. Напишите уравнении теплопередачи. Раскройте физический смысл коэффициента теплопередачи и приведите формулы для его расчета.
- •38.Перечислите различные виды теплоемкости, укажите на их размерность и запишите связь между ними.
- •41Выведите формулу адиабатного процесса термодинамической системы?
- •44. Вывод и характеристика критерия Пекле.
- •46. Обьесните физический смысл энтропии и получите формулы для определения энтропии.
- •48. Дайте полный анализ смешанного цикла двигателя внутреннего сгорания.
- •Циклы двигателей внутреннего сгорания
- •Рабочие циклы двигателей
1Что такое термодинамика и термодинамическая система.
Термодинамическая система — это некая 0%A4%D0%B8%D0%B7%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D0%B0"физическая система, состоящая из большого количества частиц, способная обмениваться с окружающей средой 0%AD%D0%BD%D0%B5%D1%80%D0%B3%D0%B8%D1%8F"энергией и 0%92%D0%B5%D1%89%D0%B5%D1%81%D1%82%D0%B2%D0%BE"веществом. Также обычно полагается, что такая система подчиняется статистическим закономерностям. Для термодинамических систем справедливы законы 0%A2%D0%B5%D1%80%D0%BC%D0%BE%D0%B4%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%BA%D0%B0"термодинамики.
2 Получи формулы термического КПД прямого термодинамического цикла и холодильного коэффициента обратного цикла. Дайте анализ.
Термодинами́ческие ци́клы — круговые процессы в 0%A2%D0%B5%D1%80%D0%BC%D0%BE%D0%B4%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%BA%D0%B0"термодинамике, то есть такие процессы, в которых начальные и конечные параметры, определяющие состояние рабочего тела (0%94%D0%B0%D0%B2%D0%BB%D0%B5%D0%BD%D0%B8%D0%B5"давление, 0%9E%D0%B1%D1%8A%D1%91%D0%BC"объём, 0%A2%D0%B5%D0%BC%D0%BF%D0%B5%D1%80%D0%B0%D1%82%D1%83%D1%80%D0%B0"температура, 0%A2%D0%B5%D1%80%D0%BC%D0%BE%D0%B4%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%8D%D0%BD%D1%82%D1%80%D0%BE%D0%BF%D0%B8%D1%8F"энтропия), совпадают.Термодинамические циклы являются моделями процессов, происходящих в реальных тепловых машинах для превращения тепла в 0%9C%D0%B5%D1%85%D0%B0%D0%BD%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%80%D0%B0%D0%B1%D0%BE%D1%82%D0%B0"механическую работу.Компонентами любой 0%A2%D0%B5%D0%BF%D0%BB%D0%BE%D0%B2%D0%B0%D1%8F_%D0%BC%D0%B0%D1%88%D0%B8%D0%BD%D0%B0"тепловой машины являются 0%A0%D0%B0%D0%B1%D0%BE%D1%87%D0%B5%D0%B5_%D1%82%D0%B5%D0%BB%D0%BE"рабочее тело, нагреватель и холодильник (с помощью которых меняется состояние рабочего тела).
Обратимым называют цикл, который можно провести как в прямом, так и в обратном направлении в 0%97%D0%B0%D0%BC%D0%BA%D0%BD%D1%83%D1%82%D0%B0%D1%8F_%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D0%B0"замкнутой системе. Суммарная 0%A2%D0%B5%D1%80%D0%BC%D0%BE%D0%B4%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%8D%D0%BD%D1%82%D1%80%D0%BE%D0%BF%D0%B8%D1%8F"энтропия системы при прохождении такого цикла не меняется. Единственным обратимым циклом для машины, в которой передача тепла осуществляется только между рабочим телом, нагревателем и холодильником, является 0%A6%D0%B8%D0%BA%D0%BB_%D0%9A%D0%B0%D1%80%D0%BD%D0%BE"Цикл Карно. Существуют также другие циклы (например, 0%A6%D0%B8%D0%BA%D0%BB_%D0%A1%D1%82%D0%B8%D1%80%D0%BB%D0%B8%D0%BD%D0%B3%D0%B0"цикл Стирлинга и0%A6%D0%B8%D0%BA%D0%BB_%D0%AD%D1%80%D0%B8%D0%BA%D1%81%D1%81%D0%BE%D0%BD%D0%B0&action=edit&redlink=1"цикл Эрикссона), в которых обратимость достигается путём введения дополнительного теплового резервуара — регенератора. Общим (т.е. указанные циклы частный случай) для всех этих циклов с регенерацией является 0%A6%D0%B8%D0%BA%D0%BB_%D0%A0%D0%B5%D0%B9%D1%82%D0%BB%D0%B8%D0%BD%D0%B3%D0%B5%D1%80%D0%B0"Цикл Рейтлингера. Можно показать что обратимые циклы обладают наибольшей эффективностью.
3 Законы Авогадро и обьем одного киломолия в нормальных условиях
Закон Авога́дро — одно из важных основных положений химии, гласящее, что «в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул». Было сформулировано ещё в 1811 году 0%90%D0%B2%D0%BE%D0%B3%D0%B0%D0%B4%D1%80%D0%BE,_%D0%90%D0%BC%D0%B5%D0%B4%D0%B5%D0%BE"Амедео Авогадро (1776—1856), профессором физики в 0%A2%D1%83%D1%80%D0%B8%D0%BD"Турине.
Первое следствие из закона Авогадро: один 0%9C%D0%BE%D0%BB%D1%8C"моль любого газа при одинаковых условиях занимает одинаковый объём.
В частности, при нормальных условиях, т. е. при 0 °C (273К) и 101,3 кПа, объём 1 моля газа, равен 22,4 л. Этот объём называют молярным объёмом газа Vm. Пересчитать эту величину на другие температуру и давление можно с помощью 0%A3%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D0%B5_%D1%81%D0%BE%D1%81%D1%82%D0%BE%D1%8F%D0%BD%D0%B8%D1%8F_%D0%B8%D0%B4%D0%B5%D0%B0%D0%BB%D1%8C%D0%BD%D0%BE%D0%B3%D0%BE_%D0%B3%D0%B0%D0%B7%D0%B0"уравнения Менделеева-Клапейрона:
Второе следствие из закона Авогадро: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа по второму.
Положение это имело громадное значение для развития химии, так как оно дает возможность определять частичный вес0%97%D0%B0%D0%BA%D0%BE%D0%BD_%D0%90%D0%B2%D0%BE%D0%B3%D0%B0%D0%B4%D1%80%D0%BE"[2] тел, способных переходить в газообразное или парообразное состояние. Если через m мы обозначим частичный вес тела, и через d — удельный вес0%97%D0%B0%D0%BA%D0%BE%D0%BD_%D0%90%D0%B2%D0%BE%D0%B3%D0%B0%D0%B4%D1%80%D0%BE"[3] его в парообразном состоянии, то отношение m / d должно быть постоянным для всех тел. Опыт показал, что для всех изученных тел, переходящих в пар без разложения, эта постоянная равна 28,9, если при определении частичного веса исходить из удельного веса0%92%D0%BE%D0%B7%D0%B4%D1%83%D1%85"воздуха, принимаемого за единицу, но эта постоянная будет равняться 2, если принять за единицу 0%A3%D0%B4%D0%B5%D0%BB%D1%8C%D0%BD%D1%8B%D0%B9_%D0%B2%D0%B5%D1%81"удельный вес 0%92%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4"водорода. Обозначив эту постоянную, или, что то же, общий всем парам и газам частичный объём через С, мы из формулы имеем с другой стороны m = dC. Так как удельный вес 0%9F%D0%B0%D1%80"пара определяется легко, то, подставляя значение d в формулу, выводится и неизвестный частичный вес данного тела.
4 Теплопередача через плоскую стенку, коэффициент теплоотдачи и коэффициент теплопередачи К.
1).
Теплопередача через плоскую
стенку.
Рассмотрим
однослойную плоскую стенку толщиной
d и теплопроводностью l
(рис12.1).
|
5 Приведите уравнения состояния идеальных газов и укажите на физическую сущность каждой величины, входящей в уравнение.
Уравнение состояния 0%98%D0%B4%D0%B5%D0%B0%D0%BB%D1%8C%D0%BD%D1%8B%D0%B9_%D0%B3%D0%B0%D0%B7"идеального газа (иногда уравнение 0%9A%D0%BB%D0%B0%D0%BF%D0%B5%D0%B9%D1%80%D0%BE%D0%BD,_%D0%91%D0%B5%D0%BD%D1%83%D0%B0_%D0%9F%D0%BE%D0%BB%D1%8C_%D0%AD%D0%BC%D0%B8%D0%BB%D1%8C"Клапейрона или уравнение 0%9C%D0%B5%D0%BD%D0%B4%D0%B5%D0%BB%D0%B5%D0%B5%D0%B2,_%D0%94%D0%BC%D0%B8%D1%82%D1%80%D0%B8%D0%B9_%D0%98%D0%B2%D0%B0%D0%BD%D0%BE%D0%B2%D0%B8%D1%87"Менделеева — 0%9A%D0%BB%D0%B0%D0%BF%D0%B5%D0%B9%D1%80%D0%BE%D0%BD,_%D0%91%D0%B5%D0%BD%D1%83%D0%B0_%D0%9F%D0%BE%D0%BB%D1%8C_%D0%AD%D0%BC%D0%B8%D0%BB%D1%8C"Клапейрона) — формула, устанавливающая зависимость между 0%94%D0%B0%D0%B2%D0%BB%D0%B5%D0%BD%D0%B8%D0%B5"давлением, 0%9C%D0%BE%D0%BB%D1%8F%D1%80%D0%BD%D1%8B%D0%B9_%D0%BE%D0%B1%D1%8A%D1%91%D0%BC"молярным объёмом и 0%90%D0%B1%D1%81%D0%BE%D0%BB%D1%8E%D1%82%D0%BD%D0%B0%D1%8F_%D1%82%D0%B5%D0%BC%D0%BF%D0%B5%D1%80%D0%B0%D1%82%D1%83%D1%80%D0%B0"абсолютной температурой 0%98%D0%B4%D0%B5%D0%B0%D0%BB%D1%8C%D0%BD%D1%8B%D0%B9_%D0%B3%D0%B0%D0%B7"идеального газа. Уравнение имеет вид:
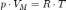 ,
,
где
 — 0%94%D0%B0%D0%B2%D0%BB%D0%B5%D0%BD%D0%B8%D0%B5"давление,
— 0%94%D0%B0%D0%B2%D0%BB%D0%B5%D0%BD%D0%B8%D0%B5"давление,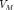 — 0%9C%D0%BE%D0%BB%D1%8F%D1%80%D0%BD%D1%8B%D0%B9_%D0%BE%D0%B1%D1%8A%D1%91%D0%BC"молярный
объём,
— 0%9C%D0%BE%D0%BB%D1%8F%D1%80%D0%BD%D1%8B%D0%B9_%D0%BE%D0%B1%D1%8A%D1%91%D0%BC"молярный
объём, — 0%A3%D0%BD%D0%B8%D0%B2%D0%B5%D1%80%D1%81%D0%B0%D0%BB%D1%8C%D0%BD%D0%B0%D1%8F_%D0%B3%D0%B0%D0%B7%D0%BE%D0%B2%D0%B0%D1%8F_%D0%BF%D0%BE%D1%81%D1%82%D0%BE%D1%8F%D0%BD%D0%BD%D0%B0%D1%8F"универсальная
газовая постоянная
— 0%A3%D0%BD%D0%B8%D0%B2%D0%B5%D1%80%D1%81%D0%B0%D0%BB%D1%8C%D0%BD%D0%B0%D1%8F_%D0%B3%D0%B0%D0%B7%D0%BE%D0%B2%D0%B0%D1%8F_%D0%BF%D0%BE%D1%81%D1%82%D0%BE%D1%8F%D0%BD%D0%BD%D0%B0%D1%8F"универсальная
газовая постоянная — 0%90%D0%B1%D1%81%D0%BE%D0%BB%D1%8E%D1%82%D0%BD%D0%B0%D1%8F_%D1%82%D0%B5%D0%BC%D0%BF%D0%B5%D1%80%D0%B0%D1%82%D1%83%D1%80%D0%B0"абсолютная
температура, 0%9A%D0%B5%D0%BB%D1%8C%D0%B2%D0%B8%D0%BD"К
— 0%90%D0%B1%D1%81%D0%BE%D0%BB%D1%8E%D1%82%D0%BD%D0%B0%D1%8F_%D1%82%D0%B5%D0%BC%D0%BF%D0%B5%D1%80%D0%B0%D1%82%D1%83%D1%80%D0%B0"абсолютная
температура, 0%9A%D0%B5%D0%BB%D1%8C%D0%B2%D0%B8%D0%BD"К
Идеальный газ — 0%9C%D0%B0%D1%82%D0%B5%D0%BC%D0%B0%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D0%BC%D0%BE%D0%B4%D0%B5%D0%BB%D1%8C"математическая модель 0%93%D0%B0%D0%B7"газа, в которой предполагается, что: 1) 0%9F%D0%BE%D1%82%D0%B5%D0%BD%D1%86%D0%B8%D0%B0%D0%BB%D1%8C%D0%BD%D0%B0%D1%8F_%D1%8D%D0%BD%D0%B5%D1%80%D0%B3%D0%B8%D1%8F"потенциальной энергией взаимодействия 0%9C%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D0%B0"молекул можно пренебречь по сравнению с их 0%9A%D0%B8%D0%BD%D0%B5%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%8D%D0%BD%D0%B5%D1%80%D0%B3%D0%B8%D1%8F"кинетической энергией; 2) суммарный объем молекул газа пренебрежимо мал. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда 0%90%D0%B1%D1%81%D0%BE%D0%BB%D1%8E%D1%82%D0%BD%D0%BE_%D1%83%D0%BF%D1%80%D1%83%D0%B3%D0%B8%D0%B9_%D1%83%D0%B4%D0%B0%D1%80"абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями. В расширенной модели идеального газа частицы, из которого он состоит, имеют также форму в виде упругих 0%A1%D1%84%D0%B5%D1%80%D0%B0"сфер или 0%AD%D0%BB%D0%BB%D0%B8%D0%BF%D1%81%D0%BE%D0%B8%D0%B4"эллипсоидов, что позволяет учитывать энергию не только поступательного, но и вращательно-колебательного движения, а также не только центральные, но и нецентральные столкновения частиц и др.0%98%D0%B4%D0%B5%D0%B0%D0%BB%D1%8C%D0%BD%D1%8B%D0%B9_%D0%B3%D0%B0%D0%B7"[1

 Температура
горячей жидкости (среды) t'ж, холодной
жидкости (среды) t''ж.
Температура
горячей жидкости (среды) t'ж, холодной
жидкости (среды) t''ж.