1)
Химия – это наука о строении, свойствах веществ, их превращениях и сопровождающих явлениях.
Перед химией стоят три задачи:
Исследование строения вещества, развитее теории строения и свойств молекул и материалов.
Осуществление направленного синтеза новых веществ с заданными свойствами.
Анализ. Оно связано как с увеличением числа химических объектов и изучаемых свойств, так и с необходимостью определения и уменьшения последствий воздействия человека на природу.
Основные химические понятия: Молекула,Атом,Атомное ядро,Заряд ядра,Изотопы,Аллотропия,Относительная атомная масса,Молярная масса
Моле́кула — электрически нейтральная частица, состоящая из двух или более связанных ковалентными связями атомов, наименьшая частица химического вещества
Атомное ядро́ — центральная часть атома, в которой сосредоточена основная его масса (более 99,9 %)
Зарядовое число атомного ядра — количество протонов в атомном ядре. Зарядовое число равно заряду ядра в единицах элементарного заряда и одновременно равно порядковому номеру соответствующего ядру химического элемента в таблице Менделеева.
Изото́пы — разновидности атомов (и ядер) какого-либо химического элемента, которые имеют одинаковый атомный номер, но при этом разные массовые числа
Аллотро́пия — существование одного и того же химического элемента в виде двух и более простых веществ, различных по строению и свойствам — так называемых аллотропических (аллотропных) модификаций или форм.
А́томная ма́сса, относительная атомная масса (устаревшее название — атомный вес) — значение массы атома, выраженное в атомных единицах массы
Моля́рная ма́сса вещества — масса одного моля вещества. Для отдельных химических элементов молярной массой является масса одного моля отдельных атомов этого элемента. В этом случае молярная масса элемента, выраженная в г/моль, численно совпадает с массой атома элемента, выраженной в а.е.м. (атомная единица массы). Однако надо чётко представлять разницу между молярной массой и молекулярной массой, понимая, что они равны лишь численно и отличаются по размерности
2) Классификация неорганических веществ.
1. Простые (состоят из одного элемента):
-Металлы
-Неметаллы
2. Сложные (состоят из двух или более элементов):
-Оксиды
-Кислоты
-Основания
-Соли
Генетическая связь между классами неорганических веществ – это связь между веществами, которые относятся к разным классам.
Основные признаки генетических рядов:
Все вещества одного ряда должны быть образованы одни химическим элементом.
Вещества, образованные одним и тем же элементом, должны принадлежать к различным классам химических веществ.
Вещества, образующие генетический ряд элемента, должны быть связаны между собой взаимопревращениями.
Таким образом, генетическим называют ряд веществ, которые представляют разные класс неорганических соединений, являются соединениями одного и того же химического элемента, связаны взаимопревращениями и отражают общность происхождения этих элементов.
3) Оксиды – это сложные вещества, состоящие из двух элементов один из которых является кислород, играющий более электроотрицательную роль.
Классификация: Солеобразующие (основные, кислотные, амфотерные), несолеобразующие.
Основные оксиды – оксиды, взаимодействующие с кислотами или кислотными оксидами с образованием солей. (MgО)
Кислотные оксиды - оксиды, взаимодействующие с основаниями или с основными оксидами с образованием солей. (SO3)
Амфотерные – оксиды, взаимодействующие как с кислотами, так и с основаниями. (Al2O3)
НЕСОЛЕОБРАЗУЮЩИЕ – оксиды, не способные взаимодействовать с кислотами или основаниями с образованиям солей. (NO)
Безразличны к ним.
Вывод: характер свойств оксидов в первую очередь зависти от валентности элемента:
CrO (II - основный)
Cr 2O3 (III - амфотерный)
CrO3 (VII – кислотный)
Физические свойства оксидов:
При комнатной температуре большинство оксидов - твердые вещества (СаО, Fe2O3 и др.), некоторые - жидкости (Н2О, Сl2О7 и др.) и газы (NO, SO2 и др.).
Химические свойства:
1. Основной оксид + Кислотный оксид = Соль (р. соединения)
CaO + SO2 = CaSO3
2. Основной оксид + Кислота = Соль + Н2О (р. обмена)
3K2O + 2H3PO4 = 2K3PO4 + 3H2O
3. Основной оксид + Вода = Щёлочь (р. соединения)
Na2O + H2O = 2NaOH
4 Кислотный оксид + Вода = Кислота (р. соединения)
СO2 + H2O = H2CO3, SiO2 – не реагирует
5. Кислотный оксид + Основание = Соль + Н2О (р. обмена)
P2O5 + 6KOH = 2K3PO4 + 3H2O
6. Основной оксид + Кислотный оксид = Соль (р. соединения)
CaO + SO2 = CaSO3
7. Менее летучие вытесняют более летучие из их солей
Амфотерные оксиды - Взаимодействуют как с кислотами, так и со щелочами.
Основания – это сложные вещества, состоящие из атома металла, связанного с одной или несколькими гидроксидгруппами.
-Щелочи
-Нерастворимы в воде
К щелочам относят гидроксиды щелочных и щелочноземельных металлов (LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2.Остальные - нерастворимые.
К нерастворимым относят так называемые амфотерные гидроксиды, которые при взаимодействии с кислотами выступают как основания, а со щёлочью - как кислоты.
Щёлочи |
Нерастворимые основания |
1.Взаимодействие с кислотами |
|
KOH+HCl=KCl+H2O |
Cu(OH)2+2HCl=CuCl2+2H2O |
2.Взаимодействие с кислотными оксидами |
|
2KOH+CO2=K2CO3+H2O |
не характерны |
3.Действие индикаторов |
|
лакмус-синяя, фенолфталеин-малиновая |
окраска не изменяется |
4.Взаимодействие с амфотерными оксидами |
|
2KOH+ZnO=K2ZnO2+H2O |
не реагируют |
5.Взаимодействие с солями, если образуется малорастворимая соль или малорастворимое основание |
|
NaOH+CuCl2=Cu(OH)2=2NaCl |
не реагируют |
6.При нагревании |
|
не разлагаются(кроме LiOH) |
Cu(OH)2=CuO+H2O |
Амфотерные гидроксиды( Al(OH)3, Zn(OH)2, Be(OH)2, Fe(OH)3 и другие. |
|
Взаимодействуют с кислотами Zn(OH)2+2HCl=ZnCl2+2H2O |
Взаимодействуют с щелочами Al(OH)3+NaOH=Na[Al(OH)4] |
5) Кислоты - сложные вещества, состоящие из одного или нескольких атомов водорода, способных замещаться на атома металлов, и кислотных остатков.
Классификация: По их силе, по основности и по наличию или отсутствие кислорода в составе кислоты.
Названия кислородных кислот производятся от названия неметалла с прибавлением окончаний –ная, -вая, если степень окисления его соответствует номеру группы. По мере понижения степени окисления суффиксы меняются в следующем порядке: -оватая, -истая, -оватистая:
|
|
|
Физические свойства - Многие кислоты, например серная, азотная, соляная – это бесцветные жидкости. известны также твёрдые кислоты: ортофосфорная, метафосфорнаяHPO3, борная H3BO3. Почти все кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая H2SiO3. Растворы кислот имеют кислый вкус. Так, например, многим плодам придают кислый вкус содержащиеся в них кислоты. Отсюда названия кислот: лимонная, яблочная и т.д.
Химические свойства:
Название индикатора |
Нейтральная среда |
Кислая среда |
Лакмус |
Фиолетовый |
Красный |
Фенолфталеин |
Бесцветный |
Бесцветный |
Метилоранж |
Оранжевый |
Красный |
Универсальная индикаторная бумага |
Оранжевая |
Красная |
.Реагируют с металлами в ряду активности до H2
(искл. HNO3 –азотная кислота)
3. С основными (амфотерными) оксидами – оксидами металлов
4. Реагируют с основаниями – реакция нейтрализации
КИСЛОТА + ОСНОВАНИЕ= СОЛЬ+ H2O ( р. обмена)
5. Реагируют с солями слабых, летучих кислот - если образуется соль, выпадающая в осадок или выделяется газ:
Сила кислот убывает в ряду: HI > HClO4 > HBr > HCl > H2SO4 > HNO3 > HMnO4 > H2SO3 > H3PO4 > HF > HNO2 >H2CO3 > H2S > H2SiO3 . Каждая предыдущая кислота может вытеснить из соли последующую |
6. Разложение кислородсодержащих кислот при нагревании
( искл. H2SO4 ; H3PO4 )
КИСЛОТА = КИСЛОТНЫЙ ОКСИД + ВОДА
6) Солями называются сложные вещества, молекулы которых, состоят из атомов металлов и кислотных остатков (иногда могут содержать водород). Например, NaCl – хлорид натрия, СаSO4 – сульфат кальция и т. д.
Практически все соли являются ионными соединениями, поэтому в солях между собой связаны ионы кислотных остатков и ионы металла:
Na+Cl– – хлорид натрия
Ca2+SO42– – сульфат кальция и т.д.
Соль является продуктом частичного или полного замещения металлом атомов водорода кислоты. Отсюда различают следующие виды солей:
1. Средние соли – все атомы водорода в кислоте замещены металлом: Na2CO3, KNO3 и т.д. 2. Кислые соли – не все атомы водорода в кислоте замещены металлом. Разумеется, кислые соли могут образовывать только двух- или многоосновные кислоты. Одноосновные кислоты кислых солей давать не могут: NaHCO3, NaH2PO4 ит. д.
3. Двойные соли – атомы водорода двух- или многоосновной кислоты замещены не одним металлом, а двумя различными: NaKCO3, KAl(SO4)2 и т.д.
4. Соли основные можно рассматривать как продукты неполного, или частичного, замещения гидроксильных групп оснований кислотными остатками: Аl(OH)SO4 , Zn(OH)Cl и т.д.
По международной номенклатуре название соли каждой кислоты происходит от латинского названия элемента. Например, соли серной кислоты называются сульфатами: СаSO4 – сульфат кальция, Mg SO4 – сульфат магния и т.д.; соли соляной кислоты называются хлоридами: NaCl – хлорид натрия, ZnCI2 – хлорид цинка и т.д.
В название солей двухосновных кислот добавляют частицу «би» или «гидро»: Mg(HCl3)2 – бикарбонат или гидрокарбонат магния.
При условии, что в трехосновной кислоте замещён на металл только один атом водорода, то добавляют приставку «дигидро»: NaH2PO4 – дигидрофосфат натрия.
Соли – это твёрдые вещества, обладающие самой различной растворимостью в воде.
Химические свойства солей
Химические свойства солей определяются свойствами катионов и анионов, которые входят в их состав.
1. Некоторые соли разлагаются при прокаливании:
CaCO3 = CaO + CO2↑
2. Взаимодействуют с кислотами с образованием новой соли и новой кислоты. Для осуществление этой реакции необходимо, чтобы кислота была более сильная чем соль, на которую воздействует кислота:
2NaCl + H2 SO4 → Na2SO4 + 2HCl↑.
3. Взаимодействуют с основаниями, образуя новую соль и новое основание:
Ba(OH)2 + Mg SO4 → BaSO4↓ + Mg(OH)2.
4. Взаимодействуют друг с другом с образованием новых солей:
NaCl + AgNO3 → AgCl + NaNO3 .
5. Взаимодействуют с металлами, которые стоят в раду активности до металла, который входит в состав соли:
Fe + CuSO4 → FeSO4 + Cu↓.
7) Атом - система взаимодействующих элементарных частиц, состоящая из положительно заряженного ядра и электронов.
Результаты опыта Резерфорда объяснил, предложим «планетарную» модель атома, уподоблявшую его солнечной системе. Согласно планетарной модели в центре атома находится очень маленькое ядро, размеры которого приблизительно в 100000 раз меньше самого ядра. Это ядро заключает в себя почти всю массу атома и несет положительный заряд. Вокруг ядра движутся электроны, число которых определяется зарядом ядра. Внешняя троектория движения электронов определяет внешние размеры атома. Диаметр атома – величина порядка м, а диаметр ядра.
Два противоречия:
Планетарная модель атома не могла объяснить устойчивости атома. По сути, электрон двигаясь должен испускать электромагнитную энергию в виде световых волн. Но электрон излучая свою энергию, что приводит к равновесию между центробежной силой, связанная с вращением атома и силой электростатического притяжения электрона к ядру. Электрон теряя свою энергию, должен по спиральной траектории упасть на ядро и атом прекратит своё существование.
Планетарная теория строения атома не смогла объяснить линейчатый спектр испускания атомов водорода и тем более объединение спектра в серии.
Спектр испускания – совокупность частот электромагнитного излучения, испускаемого веществами.
Спектр поглощения – вещества поглощают излучение определенных частот. Совокупность.
8) Основные положения своей теории Бор сформулировал в виде трех постулатов (постулат утверждение, принимаемое без доказательств):
1. Электрон может вращаться вокруг ядра не по любым, а только по некоторым определенным круговым орбита. Эти орбиты получили названия – стационарные.
2. Двигаясь по стационарной орбите, электрон не излучает электромагнитной энергии.
3. Излучение происходит при скачкообразном переходе электрона с одно стационарной орбиты на другую. При этом испускается или поглощается квант электромагнитного излучения, энергия которого равна разности энергии атома в конечном и исходном состояниях.
Квантово-волновой дуализм электрона. 1)Электрон- это частица А) электрон имеет массу 9,13*10^-31 кг Б)любая частица имеет заряд ,электрон имеет самый маленький заряд. В)Отклонение электрона в электромагнитном поле. 2) электрон- это волна А) дифракция (огибание) Б) интерференция (разложение на составляющие) Следствием волнового харак. Движения электрона в атоме, является квантованность .
9) Квантовые числа — энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3, . . .)
Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. Оно может принимать целочисленные значения от 0 до n-1(l = 0, 1, 2, 3,..., n-1). Каждому значению l соответствует орбиталь особой формы. Орбитали с l = 0 называются s-орбиталями, l = 1 – р-орбиталями (3 типа, отличающихся магнитным квантовым числом m), l = 2 – d-орбиталями (5 типов), l = 3 – f-орбиталями (7 типов).
Магнитное квантовое число m определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Его значения изменяются от +l до -l, включая 0. Например, при l = 1 число m принимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р-АО: рx, рy, рz.
Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемого спином (от англ. веретено). Для обозначения электронов с различными спинами используются символы:
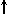 и
и 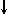 .
.
10) Правило Клечковского – Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантовых чисел. При одинаковой сумме раньше заполняется орбиталь с меньшим значением n.
![]()
Принцип Паули – В атоме не может быть электронов, имеющих одинаковый набор всех четырех квантовых чисел.
Правило Хунда – В наиболее устойчивом состоянии атома электроны размещаются в пределах электронной подоболочки так, чтобы их суммарный спин был максимален. Сначала электроны по одному заполняют квантовую ячейку, а когда нет места, электроны спариваются.
11) Периодический закон – Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
а) в периодах слева направо с ростом заряда ядра атомов металлические свойства элементов ослабевают, а неметаллические усиливаются; б) в группах сверху вниз с ростом заряда ядра атомов металлические свойства элементов усиливаются, а неметаллические ослабевают
Периодический закон- свойства простых веществ,а также образуемых или сложных веществ находится в периодической зависимости от заряда ядер их атомов. Короткий вариант периодической системы состоит из периодов,рядов и групп,по горизонтали имеется 7 периодов:1,2,3 назыв. Малыми, 4,5,6 назыв. Большими,а 7 незавершённый. По вертикали располож. 8 групп,каждая делится на главную и побочную ,что отображается смещением в лево и вправо. Периодичность изменения свойств элементов. Периодическое изменение свойств элементов в периоде объясняется последовательностью заполнения электронами уровней и подуровней в атомах при увеличении порядкового номера элемента и заряда ядра атома.
Электронные семейства s-элементы.у них заполняется s подуровень внешнего энергетич. Уровня. Они расположены вначале каждого периода. p-элементы ,у них заполн. p Подуровни внеш. Энерг. Уров.распологаются со 2-го по 6-ой период d-элемент,у них заполняется d подуровень предвнешнего энергитич.уров.и они образ. Вставные декады элементов между s и p элементами начинаяс 4 по 7 периоды. f-элемент,у них заполняется f подуровень 2-го снаружи энергитич. Уровня.
12)
Химическая связь - это взаимодействие двух атомов, осуществляемое путем обмена электронами.
Типы связи:
-Ковалентная (полярная, неполярная)
-Ионная
-Металлическая
-Водородная
Характеристики:
ЭНЕРГИЕЙ СВЯЗИ называют ту энергию, которую необходимо затратить для ее разрыва. При этом молекула должна находиться в основном (невозбужденном) состоянии и при 0оК. Эта величина определяет прочность связи. Чем больше энергия, затрачиваемая на разрыв связи, тем прочнее связь. Единица измерения энергии связи — кДж/моль.
ДЛИНОЙ СВЯЗИ называют среднее расстояние между ядрами, отвечающее минимуму энергии системы.
ВАЛЕНТНЫЕ УГЛЫ. Это углы между связями в молекуле. Их схематически можно представить как углы между прямыми линиями, соединяющими ядра атомов в молекуле. Эти воображаемые прямые, проведенные через два ядра, называют линиями связи. Величины валентных углов зависят от природы атомов и характера связи. Простые двухатомные молекулы всегда имеют линейную структуру. Трехатомные и более сложные молекулы могут обладать различными конфигурациями. Например, в молекуле воды угол между линиями связи Н—О равен 104,5°, а в сходной молекуле сероводорода валентный угол между связями составляет 92°.
Виды:
-Короткодействующая
-Дальнодействующая
13)
Ковалентная связь— химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений
-Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
-Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
-Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
-Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
-Электроны тем подвижнее, чем дальше они находятся от ядер. Ковалентная связь это когда два атома делятся электронами и держатся вместе.
К обменному механизму относят случаи, когда в образовании электронной пары от каждого атома участвует по одному электрону. Например водород: Н2 Н. +Н. →Н:Н или Н-Н. Связь возникает благодаря образованию общей электронной пары за счет объединения неспаренных электронов. У каждого атома есть по одному s –электрону. Атомы Н равноценны и пары одинаково принадлежат обоим атомам. По этому же принципу происходит образование общих электронных пар (перекрывание р-электронных облаков) при образовании молекулы Сl2. При образовании молекулы N2 Образуются 3 общие электронные пары. Перекрываются р-орбитали. Связь называется неполярная. При образовании молекулы хлороводорода перекрывается орбиталь s-электрона водорода и орбиталь р-электрона хлора Н-Сl. Связывающая электронная пара смещена к атому хлора, в результате чего образуется диполь, который измеряется дипольным моментом. Связь называется полярная. По донорно-акцепторному механизму происходит образование иона аммония. Донор (азот) имеет электронную пару, акцептор – (Н+) свободную орбиталь, которую пара электронная азота может занять. В ионе аммония три связи азота с водородом образованы по обменному механизму, а одна по донорно-акцепторному. Все 4 связи равноценны. Ковалентные связи классифицируют не только по механизму образования общих электронных пар, соединяющих атомы, но и по способу перекрывания электронных орбиталей , по числу общих пар, а также по смещению их. По способу перекрывания – σ (сигма s- s, s-р, р-р) π (р-р гантели перекрываются двумя местами). В молекуле азота между атомами существуют одна σ-связь и две π-связи, которые находятся в двух взаимно перпендикулярных плоскостях.
14) Пи-связь (π-связь) — ковалентная связь, образующаяся перекрыванием p-атомных орбиталей. В отличие от сигма-связи, осуществляемой перекрыванием s-атомных орбиталей вдоль линии соединения атомов, пи-связи, возникают при перекрывании p-атомных орбиталей по обе стороны от линии соединения атомов. Считается, что пи-связь реализуется в кратных связях — двойная связь состоит из одной сигма- и одной пи-связи, тройная — из одной сигма- и двух ортогональных пи-связей.
1. В образовании связи участвуют только электроны внешней электронной оболочки атома (валентные электроны).
2. Химическая связь образуется двумя валентными электронами различных атомов с антипараллельными спинами. При этом происходит перекрывание электронных орбиталей и между атомами появляется область с повышенной электронной плотностью, обусловливающая связь между ядрами атомов. Таким образом, в основе МВС лежит образование двухэлектронной, двухцентровой связи.
3. Химическая связь осуществляется в том направлении, в котором обеспечивается наибольшее перекрывание атомных орбиталей.
4. Из нескольких связей данного атома наиболее прочной будет связь, которая получилась в результате наибольшего перекрывания атомных орбиталей.
5. При образовании молекул электронная структура (кроме внешней электронной оболочки) и химическая индивидуальность каждого атома в основном сохраняются.
Известны два механизма образования общих электронных пар: обменный и донорно-акцепторный.
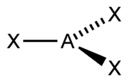
15) Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d) орбиталей центрального атома многоатомной молекулы с возникновением того же числа орбиталей, эквивалентных по своим характеристикам.
Гибридизация – это явление смешения АО или электронных облаков, приводящее к образованию новых гибридных облаков одинаковой формы и одинаковой энергии.
Тип гибридизации |
Число гибридных орбиталей |
Геометрия |
Структура |
Примеры |
sp |
2 |
Линейная |
|
BeF2, CO2, NO2+ |
sp2 |
3 |
Треугольная |
|
BF3, NO3-, CO32- |
sp3 |
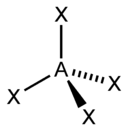
4 |
Тетраэдрическая |
|
CH4, ClO4-, SO42-, NH4+ |
dsp2 |
4 |
Плоскоквадратная |
|
Ni(CO)4, XeF4 |
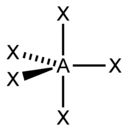
sp3d |
5 |
Гексаэдрическая |
|
PCl5, AsF5 |
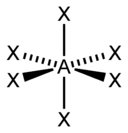
sp3d2 |
6 |
Октаэдрическая |
|
SF6, Fe(CN)63-, CoF63- |
16)
Ионы - это электрически заряженные частицы, образующиеся из нейтральных атомов или молекул путем отдачи или присоединени электронов.
Ионная связь - это химическая связь, образованная за счет электростатического притяжения между катионами и анионами
Очень прочная химическая связь, образующаяся между атомами с большой разностью (>1,5 по шкале Полинга) электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью.Это притяжение ионов как разноименно заряженных тел.
Образуется ионная кристаллическая решётка
Физические свойства: твёрдые, прочные, тугоплавкие.
Растворы и расплавы ионных соединений – электролиты.
Ионная связь – крайний случай ковалентной полярой связи, но в оличие от неё связь ненаправленная.
Ионная связь ненасыщенна и ненаправленна. Это связано с тем, что электростатические силы бесконечно распространяются в пространстве и, к тому же, равномерно во всех возможных радиальных направлениях от данного иона:
Важнейшие отличия ионной связи от других типов химической связи заключаются в ненаправленности и ненасыщаемости. Именно поэтому кристаллы, образованные за счёт ионной связи, тяготеют к различным плотнейшим упаковкам соответствующих ионов.
Если химическая связь образуется между атомами, которые имеют очень большую разность электроотрицательностей, то общая электронная параполностью переходит к атому с большей ЭО. Результатом этого является образование соединения противоположно заряженных ионов:
17) Металлическая связь - химическая связь, образованная за счет обобществления валентных электронов всех связываемых атомов металлического кристалла. В результате образуется единое электронное облако кристалла, которое легко смещается под действием электрического напряжения - отсюда высокая электропроводность металлов.
Металлическая связь образуется в том случае, когда связываемые атомы большие и потому склонны отдавать электроны. Простые вещества с металлической связью - металлы (Na, Ba, Al, Cu, Au и др.), сложные вещества - интерметаллические соединения (AlCr2, Ca2Cu, Cu5Zn8 и др.). Металлическая связь не обладает направленностью насыщаемостью. Она сохраняется и в расплавах металлов.
Водородная связь - межмолекулярная связь, образованная за счет частичного акцептирования пары электронов высокоэлектроотрицательнного атома атомом водорода с большим положительным частичным зарядом. Образуется в тех случаях, когда в одной молекуле есть атом с неподеленной парой электронов и высокой электроотрицательностью (F, O, N), а в другой - атом водорода, связанный сильно полярной связью с одним из таких атомов. Примеры межмолекулярных водородных связей:Внутримолекулярные водородные связи существуют в молекулах полипептидов, нуклеиновых кислот, белков и др.
18) Межмолекулярное взаимодействие - взаимодействие молекул между собой, не приводящее к разрыву или образованию новых химических связей. В их основе, как и в основе химической связи, лежат электрические взаимодействия. Силы Ван-дер-Ваальса включают все виды межмолекулярного притяжения и отталкивания.
КРИСТАЛЛИЧЕСКАЯ РЕШЁТКА, пространственное периодическое расположение атомов или ионов в кристалле. Точки кристаллической решетки, в которых расположены атомы или ионы, называются узлами кристаллической решетки.
В зависимости от того, из каких частицы построена кристаллическая решетка и каков характер химической связи между ними, выделяют различные типы кристаллов.
Схема 2