
- •1.Механическое движение как простейшая форма движения материи. Преставления о формах пространства и времени, лежащие в основе классической механики. Границы применимости классической механики.
- •2. Элементы кинематики материальной точки. Скорость и ускорение точки, как производные радиуса вектора по времени.
- •Кинематические уравнения движения
- •3) Нормальное и тангенциальное ускорения. Радиус кривизны траектории.
- •4.Элементы кинематики вращательного движения. Угловая скорость и угловое ускорение их связь с линейными скоростями и ускорениями точек вращающегося тела.
- •5. Динамика материальной точки и поступательного движения твёрдого тела. Сила. Закон инерции и инерциальные системы отсчета. Закон динамики материальной точки (2 и 3 законы Ньютона)
- •7.Работа консервативных и неконсервативных сил. Определение работы через интеграл, графически и через изменение энергии.
- •8. Кинетическая и потенциальные энергии. Понятие о градиенте потенциала. Закон сохранения механической энергии. Диссипация энергии. Консервативные и неконсервативные силы.
- •9. Поле как форма материи, осуществляющая силовое взаимодействие между частицами вещества. Вес и невесомость. Потенциальная энергия тяготения.
- •10. Применение законов сохранения к абсолютно неупругому удару. Энергия идущая на деформацию. Примеры неупругого удара.
- •11. Применение законов сохранения к абсолютно упругому удару. Частные случаи и их конкретные проявления.
- •12. Динамика вращательного движения абсолютно твердого тела. Момент силы. Основной закон вращательного движения. Момент инерции.
- •13.Момент инерции. Зависимость момента инерции твердого тела от его характеристик. Теорема Штейнера и ее применение на конкретном примере
- •14. Кинетическая энергия вращательного движения. Закон сохранения момента импульса и его проявление.
- •15. Неинерциальные системы отсчета. Силы инерции в поступательно движущейся неинерциальной системе. Эквивалентность сил инерции и гравитационных сил.
- •16. Силы инерции во вращающейся системе отсчета и их применение. Сила Кориолиса.
- •17. Преобразование координат Галилея. Механический принцип относительности. Закон сложения скоростей. Инварианты преобразования.
- •18. Постулаты специальной теории относительности. Преобразования Лоренца. Относительность одновременности.
- •20. Элементы релятивистской динамики. Закон взаимодействия массы и энергии. Изменение массы тела со скоростью. Границы применимости классической механики.
- •Релятивистский импульс
- •Закон взаимосвязи массы и энергии
- •Изменение массы тела со скоростью
- •Закон сложения скоростей
- •21) Термодинамический и молекулярно-кинетический методы исследования. Термодинамические параметры. Равновесные состояния и процессы, и их изображение на термодинамической диаграмме.
- •23. Число степеней свободы молекул. Закон равномерного распределения энергии по степеням свободы молекул. Внутренняя энергия идеального газа.
- •24) Работа газа при изменении его объема. Количество теплоты. Теплоемкость.
- •25.Первое начало термодинамики и применение его к изопроцессам. Работа в изопроцессах.
- •26. Применение первого начала термодинамики к адиабатному процессу. Уравнение Пуассона. Работа газа в адиабатном процессе.
- •27) Теплоемкость. Зависимость теплоемкости идеального газа от вида процесса. Свободная и связанная энергия.
- •28.Закон Максвелла для распределения молекул идеального газа по скоростям. Наиболее вероятная квадратичная и средняя арифметическая скорости молекул. Опытное подтверждение.
- •Барометрическая формула. Закон Больцмана для распределения частиц во внешнем потенциальном поле.
- •30) Среднее число столкновений и средняя длина свободного пробега молекул.
- •31.Явления переноса в термодинамически неравновестных системах. Коэффициент диффузии
- •32. Опытные законы теплопроводности и внутреннего трения. Коэффициенты теплопроводности и внутреннего трения
- •33) Обратимые и необратимые процессы. Круговые процессы (циклы) и их изображение на термодинамической диаграмме. Принцип Томпсона. Тепловые двигатели и холодильные машины.
- •34.Принцип Томсона. Цикл Карно и его кпд, работа за цикл. Ход цикла Карно в термодинамической диаграмме.
- •35.Второе начало термодинамики. Молекулярно-кинетическая картина равновесных состояний. Энтропия идеального газа.
- •36) Отступление от законов идеальных газов. Реальные газы. Силы и потенциальная энергия межмолекулярного взаимодействия. Эффективный диаметр молекул.
- •37.Уравнение Ван-дер-Вальса
- •38.Сравнение изотерм Ван-дер-Ваальса с экспериментальными. Критическое состояние.
- •39) Фазовые переходы I и II рода. Уравнение Клапейрона-Клаузиуса.
35.Второе начало термодинамики. Молекулярно-кинетическая картина равновесных состояний. Энтропия идеального газа.
Второе начало гласит, что невозможен самопроизвольный переход тепла от тела, менее нагретого, к телу, более нагретому. Более строго, невозможны такие процессы, единственным конечным результатом которых был бы переход тепла от тела, менее нагретого, к телу, более нагретому.
Исторически второе начало термодинамики возникло из анализа работы тепловых двигателей. Рассмотрим схему теплового двигателя. От термостата с более высокой температурой Т1, называемого нагревателем, за цикл отнимается количество теплоты Q1, а термостату с более низкой температурой Т2, называемому холодильником, за цикл передается количество теплоты Q2 и совершается работа
|
|
|
|
Чтобы термический коэффициент
полезного действия теплового двигателя
был ![]() ,
должно быть выполнено условие
,
должно быть выполнено условие ![]() ,
т.е. тепловой двигатель должен иметь
один источник теплоты, а это невозможно.
Такой двигатель называется вечным
двигателем второго рода.
,
т.е. тепловой двигатель должен иметь
один источник теплоты, а это невозможно.
Такой двигатель называется вечным
двигателем второго рода.
В 1824 г. Карно доказал, что для работы теплового двигателя необходимо не менее двух источников теплоты с различными температурами. Невозможность создания вечного двигателя второго рода подтверждается вторым началом термодинамики.
Приведем некоторые формулировки второго начала термодинамики:
Невозможен процесс, единственным результатом которого является превращение всей теплоты, полученной от нагревателя в эквивалентную ей работу (формулировка Кельвина).
Невозможен вечный двигатель второго рода (формулировка Томпсона – Планка).
Невозможен процесс, единственным результатом которого является передача энергии в форме теплоты от холодного тела к горячему (формулировка Клаузиуса).
Для получения математического выражения второго начала термодинамики рассмотрим работу идеальной тепловой машины (машины, обратимо работающей без трения и потерь тепла; рабочее тело – идеальный газ). Работа машины основана на принципе обратимого циклического процесса – термодинамического цикла Карно (рис. 1.2).
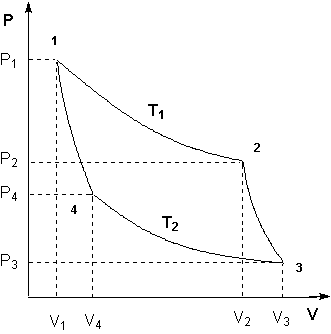
Рисунок 1.2 Цикл Карно
Запишем выражения для работы на всех участках цикла:
Общая работа в цикле равна сумме работ на всех участках:
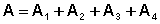 (I.40)
(I.40)Проведя ряд несложных преобразований, получим для КПД идеальной тепловой машины, работающей по циклу Карно:
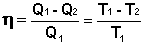 (I.41)
(I.41)
Т.о., максимальный КПД тепловой машины не зависит от природы рабочего тела, а определяется только разностью температур нагревателя и холодильника. Очевидно, что без перепада температур превращение теплоты в работу невозможно. Полученное выражение справедливо для тепловой машины, обратимо работающей по любому циклу, поскольку любой цикл можно разбить на множество бесконечно малых циклов Карно.
Термодинамическая энтропия S, часто просто именуемая энтропия, — физическая величина, используемая для описаниятермодинамической системы, одна из основных термодинамических величин. Энтропия является функцией состояния и широко используется в термодинамике, в том числе химической.
Понятие
энтропии было впервые введено
в 1865 году Рудольфом
Клаузиусом. Он
определил изменение
энтропии термодинамической
системы при обратимом
процессе как
отношение общего количества
тепла ![]() к
величине абсолютной
температуры
:
к
величине абсолютной
температуры
:
![]() .
.
Например, при температуре 0 °C, вода может находиться в жидком состоянии и при незначительном внешнем воздействии начинает быстро превращаться в лед, выделяя при этом некоторое количество теплоты. При этом температура вещества так и остается 0 °C. Изменяется состояние вещества, сопровождающееся выделением тепла, вследствие изменения структуры.
Рудольф
Клаузиус дал величине ![]() имя
«энтропия», происходящее от греческого
слова τρoπή,
«изменение» (изменение, превращение,
преобразование). Данное равенство
относится к изменению энтропии, не
определяя полностью саму энтропию.
имя
«энтропия», происходящее от греческого
слова τρoπή,
«изменение» (изменение, превращение,
преобразование). Данное равенство
относится к изменению энтропии, не
определяя полностью саму энтропию.
Эта формула применима только для изотермического процесса (происходящего при постоянной температуре). Её обобщение на случай произвольного квазистатического процесса выглядит так:
![]() ,
,
где ![]() —
приращение (дифференциал) энтропии
некоторой системы, а
—
приращение (дифференциал) энтропии
некоторой системы, а ![]() —
бесконечно малое количество теплоты,
полученное этой системой.
—
бесконечно малое количество теплоты,
полученное этой системой.
Необходимо обратить внимание на то, что рассматриваемое термодинамическое определение применимо только к квазистатическим процессам (состоящим из непрерывно следующих друг за другом состояний равновесия).
Поскольку энтропия является функцией состояния, в левой части равенства стоит её полный дифференциал. Напротив, количество теплоты является функцией процесса, в котором эта теплота была передана, поэтому считать полным дифференциалом нельзя.
Энтропия, таким образом, согласно вышеописанному, определена вплоть до произвольной аддитивной постоянной. Третье начало термодинамики позволяет определить её точнее: предел величины энтропии равновесной системы при стремлении температуры к абсолютному нулю полагают равным нулю.
