
- •1.Механическое движение как простейшая форма движения материи. Преставления о формах пространства и времени, лежащие в основе классической механики. Границы применимости классической механики.
- •2. Элементы кинематики материальной точки. Скорость и ускорение точки, как производные радиуса вектора по времени.
- •Кинематические уравнения движения
- •3) Нормальное и тангенциальное ускорения. Радиус кривизны траектории.
- •4.Элементы кинематики вращательного движения. Угловая скорость и угловое ускорение их связь с линейными скоростями и ускорениями точек вращающегося тела.
- •5. Динамика материальной точки и поступательного движения твёрдого тела. Сила. Закон инерции и инерциальные системы отсчета. Закон динамики материальной точки (2 и 3 законы Ньютона)
- •7.Работа консервативных и неконсервативных сил. Определение работы через интеграл, графически и через изменение энергии.
- •8. Кинетическая и потенциальные энергии. Понятие о градиенте потенциала. Закон сохранения механической энергии. Диссипация энергии. Консервативные и неконсервативные силы.
- •9. Поле как форма материи, осуществляющая силовое взаимодействие между частицами вещества. Вес и невесомость. Потенциальная энергия тяготения.
- •10. Применение законов сохранения к абсолютно неупругому удару. Энергия идущая на деформацию. Примеры неупругого удара.
- •11. Применение законов сохранения к абсолютно упругому удару. Частные случаи и их конкретные проявления.
- •12. Динамика вращательного движения абсолютно твердого тела. Момент силы. Основной закон вращательного движения. Момент инерции.
- •13.Момент инерции. Зависимость момента инерции твердого тела от его характеристик. Теорема Штейнера и ее применение на конкретном примере
- •14. Кинетическая энергия вращательного движения. Закон сохранения момента импульса и его проявление.
- •15. Неинерциальные системы отсчета. Силы инерции в поступательно движущейся неинерциальной системе. Эквивалентность сил инерции и гравитационных сил.
- •16. Силы инерции во вращающейся системе отсчета и их применение. Сила Кориолиса.
- •17. Преобразование координат Галилея. Механический принцип относительности. Закон сложения скоростей. Инварианты преобразования.
- •18. Постулаты специальной теории относительности. Преобразования Лоренца. Относительность одновременности.
- •20. Элементы релятивистской динамики. Закон взаимодействия массы и энергии. Изменение массы тела со скоростью. Границы применимости классической механики.
- •Релятивистский импульс
- •Закон взаимосвязи массы и энергии
- •Изменение массы тела со скоростью
- •Закон сложения скоростей
- •21) Термодинамический и молекулярно-кинетический методы исследования. Термодинамические параметры. Равновесные состояния и процессы, и их изображение на термодинамической диаграмме.
- •23. Число степеней свободы молекул. Закон равномерного распределения энергии по степеням свободы молекул. Внутренняя энергия идеального газа.
- •24) Работа газа при изменении его объема. Количество теплоты. Теплоемкость.
- •25.Первое начало термодинамики и применение его к изопроцессам. Работа в изопроцессах.
- •26. Применение первого начала термодинамики к адиабатному процессу. Уравнение Пуассона. Работа газа в адиабатном процессе.
- •27) Теплоемкость. Зависимость теплоемкости идеального газа от вида процесса. Свободная и связанная энергия.
- •28.Закон Максвелла для распределения молекул идеального газа по скоростям. Наиболее вероятная квадратичная и средняя арифметическая скорости молекул. Опытное подтверждение.
- •Барометрическая формула. Закон Больцмана для распределения частиц во внешнем потенциальном поле.
- •30) Среднее число столкновений и средняя длина свободного пробега молекул.
- •31.Явления переноса в термодинамически неравновестных системах. Коэффициент диффузии
- •32. Опытные законы теплопроводности и внутреннего трения. Коэффициенты теплопроводности и внутреннего трения
- •33) Обратимые и необратимые процессы. Круговые процессы (циклы) и их изображение на термодинамической диаграмме. Принцип Томпсона. Тепловые двигатели и холодильные машины.
- •34.Принцип Томсона. Цикл Карно и его кпд, работа за цикл. Ход цикла Карно в термодинамической диаграмме.
- •35.Второе начало термодинамики. Молекулярно-кинетическая картина равновесных состояний. Энтропия идеального газа.
- •36) Отступление от законов идеальных газов. Реальные газы. Силы и потенциальная энергия межмолекулярного взаимодействия. Эффективный диаметр молекул.
- •37.Уравнение Ван-дер-Вальса
- •38.Сравнение изотерм Ван-дер-Ваальса с экспериментальными. Критическое состояние.
- •39) Фазовые переходы I и II рода. Уравнение Клапейрона-Клаузиуса.
Закон сложения скоростей
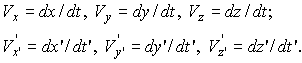
В случае движения
частицы параллельно осям ОХ и O'X- в
направлении скорости ![]()
![]() .
(16)
.
(16)
Эта формула
выражает закон сложения скоростей в
релятивистской механике. При ![]() =c,
из (16) найдем, что
=c,
из (16) найдем, что ![]() .
.
Или пусть
=c,
а ![]() ,
где
,
где ![]() -
малая величина, то
-
малая величина, то
![]() .
.
21) Термодинамический и молекулярно-кинетический методы исследования. Термодинамические параметры. Равновесные состояния и процессы, и их изображение на термодинамической диаграмме.
Термодинамические и молекулярно-кинетический методы исследования.
Для исследования физических свойств макроскопических систем, связанных с огромным числом содержащихся в них атомов и молекул, применяют два качественно различных и взаимно дополняющихдруг друга метода: статистический (или молекулярно-кинетический) и термодинамический.
Статистический метод — это метод исследования систем из большого числа частиц, оперирующийстатистическими закономерностями и средними (усредненными) значениями физических величин, характеризующих всю систему.
Этот метод лежит в основе молекулярной физики — раздела физики, изучающего строение и свойства вещества исходя из молекулярно- кинетических представлений, основывающихся на том, что все тела состоят из атомов, молекул или ионов находящихся в непрерывном хаотическом движении. В дальнейшем мы будем использовать термин "молекула" имея ввиду мельчайшую структурную единицу (элемент) данного вещества.
Термодинамический метод — это метод исследования систем из большого числа частиц, оперирующий величинами, характеризующими систему в целом (например, давление, объем, температура) при различных превращениях энергии, происходящих в системе, не учитывая при этом внутреннего строения изучаемых тел и характера движения отдельных частиц.
Этот метод лежит в основе термодинамики — раздела физики, изучающего общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями.
Термодинамические параметры.
Параметры состояния, термодинамические параметры — физические величины, характеризующие состояние термодинамической системы: температура, давление, удельный объём, намагниченность,электрическая поляризация и др. Различают экстенсивные параметры состояния, пропорциональныемассе системы:
объём,
внутренняя энергия,
энтропия,
энтальпия,
энергия Гиббса,
энергия Гельмгольца (свободная энергия),
и интенсивные параметры состояния, не зависящие от массы системы:
давление,
температура,
концентрация,
магнитная индукция и др.
Не все параметры состояния независимы, так что равновесное состояние системы можно однозначно определить, установив значения ограниченного числа параметров состояния.
Равновесные состояния и процессы, и их изображение.
Равновесные состояния и процессы, их изображение на термодинамических диаграммах. Равновесные процессы: T-const-изотермический процесс.



P=const-изобарный. V=const-изохорный.
22.Идеальный газ как модель. Основное уравнение мкт идеального газа для давления и его сравнение с уравнение Менделеева-Клайперона. Средняя кинетическая энергия молекул. Молекулярно-кинетическое толкование температуры.
Простейшей моделью, рассматриваемой молекулярно-кинетической теорией, является модель идеального газа. В кинетической модели идеального газа молекулы рассматриваются как идеально упругие шарики, взаимодействующие между собой и со стенками только во время упругих столкновений. Суммарный объем всех молекул предполагается малым по сравнению с объемом сосуда, в котором находится газ. Модель идеального газа достаточно хорошо описывает поведение реальных газов в широком диапазоне давлений и температур. Задача молекулярно-кинетической теории состоит в том, чтобы установить связь междумикроскопическими (масса, скорость, кинетическая энергия молекул) и макроскопическими параметрами (давление, объем, температура).
В результате каждого столкновения между молекулами и молекул со стенками скорости молекул могут изменяться по модулю и по направлению; на интервалах времени между последовательными столкновениями молекулы движутся равномерно и прямолинейно. В модели идеального газа предполагается, что все столкновения происходят по законам упругого удара, т. е. подчиняются законам механики Ньютона.
Основное уравнение молекулярно-кинетической теории идеального газа
Это уравнение связывает
макропараметры системы – давление p
и концентрацию молекул![]() с
ее микропараметрами – массой молекул,
их средним квадратом скорости или
средней кинетической энергией:
с
ее микропараметрами – массой молекул,
их средним квадратом скорости или
средней кинетической энергией:
![]()
Вывод этого уравнения основан на представлениях о том, что молекулы идеального газа подчиняются законам классической механики, а давление – это отношение усредненной по времени силы, с которой молекулы бьют по стенке, к площади стенки.
Пропорциональность силы, с которой молекулы воздействуют на стенку, их концентрации, массе и скорости каждой молекулы качественно понятны. Квадратичный рост давления со скоростью связан с тем, что от скорости зависит не только сила отдельного удара, но и частота соударений молекул со стенкой.
Учитывая связь между концентрацией молекул в газе и его плотностью ( = nm0), можно получить еще одну форму основного уравнения МКТ идеального газа:
![]()
Уравнение Менделеева – Клапейрона (уравнение состояния идеального газа)
В результате экспериментальных исследований многих ученых было установлено, что макропараметры реальных газов не могут изменяться независимо. Они связаны уравнением состояния:
pV = vRT
где R = 8,31 Дж/(K·моль)
– универсальная газовая постоянная,
 ,
где m – масса газа и M – молярная
масса газа. Уравнение Менделеева –
Клапейрона называют уравнением
состояния, поскольку оно связывает
функциональной зависимостью параметры
состояния. Его записывают и в других
видах:
,
где m – масса газа и M – молярная
масса газа. Уравнение Менделеева –
Клапейрона называют уравнением
состояния, поскольку оно связывает
функциональной зависимостью параметры
состояния. Его записывают и в других
видах:
![]()
![]()
Температура, как мера средней кинетической энергии молекул
Попробуем получить нетривиальные результаты, используя уравнение Клайперона-Менделеева и основное уравнение МКТ.
Введем понятие средней кинетической энергии молекул:
![]() (1)
(1)
Преобразуем основное уравнение МКТ с учетом формулы (1):
![]() т.е.
основное уравнение МКТ запишем так
т.е.
основное уравнение МКТ запишем так
![]() (2)
(2)
Воспользуемся уравнением К.-М. в таком виде:
![]() (3)
(3)
Сравним уравнения (2) и (3) и получим, что
![]() или
или
![]() (4)
(4)
Как понимать формулу (4)?
Мы выяснили, что от температуры зависит величина средней кинетической энергии молекул. Поэтому говорят, что температура - мера средней кинетической энергии молекул. Это утверждение мы доказали на для идеального газа, но оказывается оно справедливо и для других агрегатных сосятояний вещества.
Молекулярно – кинетическое толкование абсолютной температуры.
C точки зрения молекулярно-кинетической теории молекулы нагретого тела находятся в хаотическом движении. Причем, чем выше температура T, тем больше средняя кинетическая энергия <εk>хаотического движения молекул (T~<εk>).
Связь между средней кинетической энергией поступательного движения молекулы и абсолютной температурой дается формулой <εk>=3/2kT где k - постоянная Больцмана, k=1.38*10-23 (Дж/К). Следовательно, абсолютная температура есть мера средней кинетической энергии поступательного движения молекулы.
Формула позволяет выяснить смысл абсолютного нуля: T=0, если < εk > =0. Т. е. абсолютный нуль - это температура, при которой прекращается всякое хаотическое движение молекул.
