
ФизХимия
Иванов Сергей Сергеевич.
Экзамен.
8(966) 316-99-05
Термодинамика –
Теория равновесия –
Гетерогенное равновесие
гомогенное равновесие
Электррохимия – Восстановительные и окислительные процессы.
Термодинамика.
Наука изучающая привращение энергии из одной формы в другую в различных процессах. обычно выделяют:
Общую (физическую)
Техническую
Химическую – изучает приложение общих законов к химическим и физхим явлениям.
Термодинамика возникла и сформировалась в 19м веке и базируется на 2х основных закономерностях называемых: 1м и 2м началами термодинамики. В последствии конец 19 века В. Нернцтом была сформулирована тепловая теорема (3й закон термодинамики).
Основным объект термодинамики система. Система – тело или группа тел (газ в баллоне, вещество, тепловая машина), мысленно выделяемые из окружающего мира и состоящая из большого числа частиц. Термодинам система может быть:
изолированной – совершенно не взаимодействует с окружающей средой (не обменивается веществом и энергией
замкнутой – обмен веществом невозможен. Обмен энергией есть
открытой – свободна от этих ограничений.
Состояние системы можно ахорактеризовать некоторыми величинами которые называют Термодинамическими параметрами:
давление P
Объём V
Температура T
Все эти
параметры взаимосвязаны. Если заданны
количество вещества n
температура и давление то можно рассчитать
объём
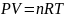 .
.
Взаимосвязь параметров выражается уравнением Менделеева-Клаперона
R
– универсальная газовая постоянная
8,31

моль – колво
вещества, число структурных единиц.
Равное
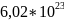 Na число Авагадро
Na число Авагадро
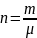
n=1000гр
n=1000/18=55моль
R – работа моля идеального газа при его нагревании на 1 градус.
Идеальный газ – молекулы которого не испытывают сил взаимодействия со стороны других частиц.
T=t+273
Экстенсивные параметры – Объём и масса пропорциональны количеству вещества.
Интенсивные араметры – не зависят от количества вещества. P, V, T, концентрация С.
В термодинамике рассматриваются равновесные системы . Системы в любой точке которой значение парамсетров одинаковы и самопроизвольно не изменяются во времени
Если температура, давление и состав одинаковы во всех точках то система находится в состоянии теплового, химического и механического равновесия.
f(P,T,V)
V=f(T,P)
P= f(T,V)
T= f(V,P)
в общем виде такие уравнения записываются в виде 3х переменных равных 0/ Все эти функции являются функциями состояния. Какое либо свойство системы численное значение которого полностью определяет состояние системы в данный момент. Изменение такой функции в любом процессе вычисляется по исходным и конечным величинам, независимо от пути осуществления этого процесса.
Это означает
что бесконечно малое изменение какого
либо параметра является полным
дифференциалом
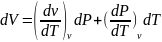
Потенциальная энергия тела E=m*g*h. это функция состояния так как она зависит от m и g и не зависит от h.
Термодинамические процессы это совокупность последрвательных состояний через которые после взаимодействия с внешней средой параметры системы претерпевают изменения. Если в результате измений в какомто из промежуточных состояний система находится в равновесии то система называется равновесной. Особенность:
Бесконечно большая длительность
равенство действия сил и противодействия
отсутствие потерь
Если система способна вернутся в исходное состояние, тоесть в обратном направлении, такой процесс называют обратимым. Если процесс возвращающий систему в первоночальное состояние без изменений во внешней среде и в самой системе то такой процесс называется обратимым. Процесс необратим если в окр среде и в самой системе остаются возникают изменения, тоесть необратимость процесса обусловлена их неравновесностью.
Равновесные процессы являются идеализируемой моделью и на практике не осуществимым.
Теплота и работа
являются 2мя формами передачи энергии (движение материи от одной системы к другой). Теплота – характеризует передачу движения за счёт хаотичного беспорядочного движения частиц. Которое осущечтвляется при контакте 2х тел имеющих различные тампературы. Её противоположность Работа – передача упорядоченного движения от одной системы к другой.
PVT
работа и теплота не являются функциями
состояния, так как их величина зависит
от пути перехода от одного сорстояния
к другому. Поэтому не говорим о малом
или конечном приращении теплоты или
работы, а пишем бесконечно малое. В самой
системе теплота и работа не содержатся.
В системе содержится энергия в виде
различных форм движения которые могут
становится работой и теплотой. Получаемой
или отдаваемой системы. В процессе
равновесного перехода Система может
совершать работу А за счёт преодоления
внешних сил. за счёт преодоления внешних
сил, если на систему действует внешние
силы. Тогда её можно записать

 бесконечно малое колво производимой
работы и бесконечно малое работы
бесконечно малое колво производимой
работы и бесконечно малое работы
 работа в макро масштабе.
работа в макро масштабе.
Изотермический процесс
T=const
наиболее частые процессы.
Используем уравнение выше приведённое и уравнение , можно получить.
 этот процесс относится к изобарному
процессу P=const.
Применим к уравнению уравнение
,
выразив через T и P
объём.
этот процесс относится к изобарному
процессу P=const.
Применим к уравнению уравнение
,
выразив через T и P
объём.
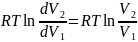
Изохорный процесс
При нём работа равна 0
P1V1=P2V2
V2/V1=P1/P2
Работа системы Положительна, а работа внешних сил указывается отрицательной.
1й Закон термодинамики
отражает закон сохранения и превращения энергии применительно к тепловым процессам. Поглощением, выделением, преобразованием теплоты. В его основу положен принцип эквивалентности теплоты Q и работы А. Это равенство характерно для круговых процессов.
Q-A=0
Из этого
выражения следует что невозможно
построить механизм который бы совершал
работу не потребляя энергии. Для не
круговых процессов в которых система
не возвращается в исходное состояние
это уравнение не выполняется. Так как
на ряду с превращением теплоты в работу
происходят изменения в системе.

Внутренняя
энергия системы – полная энергия системы
включающая потенциальную и кинетическую
энергию системы и связи составляющих
вещество частиц. Внут энергия не зависит
от состояния системы, определяется её
параметрами и является функцией состояния
для не круговых процессов. Q-A=ΔU.
Тепло подводимое к системе расходуется
на работу и изменение внутренней энергии.
 .
Поэтому КПД тепло машин <1.
.
Поэтому КПД тепло машин <1.


Все процессы делятся на:
Изобарные – протекающие при P – const.
Изохорные – протекающие при t – const.
поэтому часто нужно рассмотривать условия прохождение того или иного процесса. Кроме того учитывают в какой системе происходят такие процессы.
Из 1го закона термодинамики следует
Изолированные
системы (без обмена вещества и энергии)
– в такой системе не может осуществляется
обмен энергией с окружающей средой
 и
и
 .
и поэтому
.
и поэтому
 внутренняя энергия системы постоянна.
Все процессы сопровождаются превращениями
из одних форм энергии в другие при
сохранении полной энергии системы.
Большинство процессов в основе которых
хим реакц протек в условиях постоянства
объёма и давления.
внутренняя энергия системы постоянна.
Все процессы сопровождаются превращениями
из одних форм энергии в другие при
сохранении полной энергии системы.
Большинство процессов в основе которых
хим реакц протек в условиях постоянства
объёма и давления.
Изобарный процесс – при постоянном давлении при переходе системы из состояния 1 в состояние 2
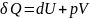 происходит совершение работы которая
равна произведению P*V.
После интегрирования выражения U1→U2
V1→V2
уравнение переписывается (Qp
– тепло при постоянном давлении)
происходит совершение работы которая
равна произведению P*V.
После интегрирования выражения U1→U2
V1→V2
уравнение переписывается (Qp
– тепло при постоянном давлении)
 .
.
Функция
приращения внутренней энергией работой
против сил называется Энтальпией



при изобарном процессе теплота равно изменению энтольпии, поскольку p, V, U парамет ры системы, энтольпия тоже функция состояния системы.
Изохорный процесс – в ходе процесса объём системы постоянен и dV=0. В соответствии с 1м законом термодинамики работа не совершается Δα=0.
 Теплота процесса равна изменению
внутренней энергии.
Теплота процесса равна изменению
внутренней энергии.
Можно выразить P, V через другие параметры, Используя уравнение Менделеева Клаперона. pV=NRT
