
- •1.Роль и значение методов исследований в различных отраслях науки ( физике, химии, биологии и др.).Предмет, цели и задачи курса «Физические и физико-химические методы исследований».
- •2.Классификация методов определения и разделения элементов.
- •3.Основные физические методы исследований(примеры).
- •4.Основные физико-химические методы исследований(примеры).
- •5.Инструментальные (оптические) методы исследований.
- •6.Инструментальные (электрохимические) методы исследований.
- •7.Важнейшие критерии выбора методов анализа (чувствительность и др.)
- •8. Важнейшие критерии выбора методов анализа (точность и др.)
- •9.Математическая обработка экспериментальных данных (виды ошибок и их влияние на точность метода).
- •11.Теория ошибок (формула Гаусса нормального распределения вариант, ошибка среднего арифметического, доверительный интервал выборочной средней и доверительная вероятность). Коэффициенты Стьюдента.
- •12. Оценка достоверности разности между средними арифметическими двух выборочных совокупностей с помощью нормативного распределения (1) и критерия р.
- •Показатели корреляции Параметрические показатели корреляции Ковариация
- •Линейный коэффициент корреляции
- •Область применения
- •13.Использование метода наименьших квадратов и элементов корреляционного анализа при обработке информации.
- •Сущность мнк
- •Альтернативное использование мнк
- •14.Взаимодействие света с веществом. Механизм поглощения света . Вращательные, колебательные и электронные уровни в многоатомных молекулах и переходы между ними.
- •16.Основные закономерности поглощения света ( перехода электронов молекул на возбужденный уровень).
- •17.Основной закон светопоглощения – закон Бугера-Ламберта-Бэра и его практическое использование.
- •18.Классификация электронных переходов. Основные хромофоры некоторых многоатомных молекул (белков и нуклеиновых кислот) и их спектры поглощения.
- •22.Пути дезактивации возбужденных молекул. Внутренняя конверсия.
- •24.Виды люминесценции как физического явления.
24.Виды люминесценции как физического явления.
Люминесценцией называется неравновесное излучение света телами, избыточное над тепловым излучением этих тел. Различают следующие виды люминесценции, которая вызывается переходом излучающих частиц в возбужденное состояние: - под действием освещения – фотолюминесценция;- вследствие бомбардировки электронами (катодными лучами) -катодолюм инесценция;-при пропускании электрического тока - электролюминесценция; - при химических реакциях - хемилюминесценция. Флуоресценцией называется люминесценция, прекращающаяся почти сразу вслед за прекращением действия фактора, возбуждающего атомы или молекулы люминофора. Фосфоресценцией называется люминесценция, сохраняющаяся значительное время после прекращения возбуждения свечения. Фосфоресценция объясняется наличием метастабильных возбужденных состояний.
25.Теоретические основы , принципы и инструментальное использование люминесцентной спектроскопии. Люминесценцией называется неравновесное излучение света телами, избыточное над тепловым излучением этих тел. Отличие люминесцентной спектроскопии от других спектроскопических методик состоит в том, что регистрируемая спектральная зависимость является функцией двух переменных - длины волны возбуждения λ ex и длины волны испускания λ em. Если λ ex поддерживается постоянной, а λ em сканируется, то измеряется спектр люминесценции (спектральная зависимость интенсивности люминесцентного испускания от длины волны). Если сканируется λ ex при постоянной λ em, то получается спектр возбуждения люминесценции (спектральная зависимость эффективности возбуждения люминесценции от длины волны).Люминесцентные методы включают в себя исследования с использованием флуоресценции (флуориметрия) и фосфоресценции (фосфориметрия). Наиболее широко люминесцентные измерения используются как методы анализа и контроля за протеканием химических и биохимических реакций, а также для кинетических исследований быстрых реакций электронно-возбужденных молекул. Применение люминесценции для аналитических целей включает широкую область использования ее для идентификации веществ, для обнаружения малых концентраций веществ, для контроля изменений, претерпеваемых веществом, для определения степени чистоты веществ. Широко применяются измерения люминесценции при изучении кинетики обычных химических реакций. Высокая чувствительность метода позволяет фиксировать малую степень превращения веществ, а иногда по люминесценции промежуточных соединений становится возможным установить механизм химической реакции. Люминесцентные методы используются в биологии, в частности для исследования структуры белков методом флуоресцентных зондов и меток. Успешно применяются люминесцентные измерения при изучении быстрых реакций электронно-возбужденных молекул. В результате протекания таких реакций интенсивность флуоресценции исходного соединения уменьшается, происходит «тушение» флуоресценции. Реакции тушения конкурируют с дезактивацией возбужденных молекул по другим механизмам. Так как время затухания флуоресценции порядка 10-8 с, флуоресцентные методы обычно применяют для изучения кинетики быстрых реакций возбужденных молекул, протекающих за время 10-7–10-10 с.
26.
Флуоресценция,
основные закономерности ( законы Стокса,
Вавилова и Левшина) и характеристики (
спектры флуоресценции и возбуждения,
квантовый выход, длительность).
Одним из способов дезактивации
электронно-возбужденных состояний
является флуоресценция - физический
внутримолекулярный процесс, который
описывается уравнением S*=So+hv,. Возбужденная
молекула переходит в основное состояние
за время 10-6
-10-9
с. испуская квант света. При этом
фотоэлектрон опускается на различные
колебательные подуровни основного
состояния. Как и при поглощении, здесь
выполняется принцип Франка-Кондона.
Основные
характеристики флуоресценции: спектры
излучения и возбуждения, квантовый
выход, время жизни и поляризация.
Спектром
флуоресценции называется зависимость
интенсивности испускания от длины волны
(частоты) света. Спектры флуоресценции
сдвинуты в длинноволновую область но
сравнению с длинноволновой полосой
поглощения (правило Стокса) и
зеркально-симметричны ей (правило
Левшина). Правило Стокса означает, что
энергия кванта флуоресценции меньше
энергии кванта возбуждающего света.
Это обусловлено двойной потерей энергии
на пути между франк-кондоновским и
равновесным электронно-колебательным
основным состоянием. Спектры
флуоресценции не зависят от длины волны
возбуждающего света. Длина волны, при
которой пересекаются спектры флуоресценции
и поглощения, соответствует чисто
электронному переходу Энергия излучаемого
при этом кванта соответствует энергии
синглетного электронно-возбужденного
состояния. Колебательная структура
спектров флуоресценции отражает систему
колебательных подуровней основного
состояния молекулы. Спектры флуоресценции
являются индивидуальной характеристикой
вещества. Квантовый
выход флуоресценции (В) - отношение
количества высвеченных (nфл)
квантов к поглощенным ( )
- отражает вероятность дезактивации
синглетного возбужденного состояния
по излучательному пути: В = nфл
/
.
его
величина меньше единицы. Квантовый
выход флуоресценции имеет постоянные
значения, независимо от того, светом
какой длины волны в пределах полосы
поглощения освещают вещество (закон
Вавилова). Причина этого - установление
теплового равновесия в системе
возбужденная молекула-среда с испусканием
квантов с одного и того же нижнего
колебательного подуровня возбужденного
состояния. При
этом измеряют так называемые спектры
возбуждения (действия) флуоресценции,
которые показывают, насколько эффективен
свет той или иной длины волны для
возбуждения свечения : nфл
/
)
- отражает вероятность дезактивации
синглетного возбужденного состояния
по излучательному пути: В = nфл
/
.
его
величина меньше единицы. Квантовый
выход флуоресценции имеет постоянные
значения, независимо от того, светом
какой длины волны в пределах полосы
поглощения освещают вещество (закон
Вавилова). Причина этого - установление
теплового равновесия в системе
возбужденная молекула-среда с испусканием
квантов с одного и того же нижнего
колебательного подуровня возбужденного
состояния. При
этом измеряют так называемые спектры
возбуждения (действия) флуоресценции,
которые показывают, насколько эффективен
свет той или иной длины волны для
возбуждения свечения : nфл
/ .
Где
nфл
- количество квантов флуоресценции,
-количество квантов возбуждающего
(падающего на объект) света. при
одной и той же квантовой интенсивности
возбуждающего света количество
возбужденных молекул, а, следовательно,
и интенсивность флуоресценции будут
прямо пропорциональны поглощению:
.
Где
nфл
- количество квантов флуоресценции,
-количество квантов возбуждающего
(падающего на объект) света. при
одной и той же квантовой интенсивности
возбуждающего света количество
возбужденных молекул, а, следовательно,
и интенсивность флуоресценции будут
прямо пропорциональны поглощению: = В(1- Т). Вследствие этого спектр возбуждения
флуоресценции должен совпадать со
спектром поглощения вещества.
Длительность
флуоресценции или время жизни возбужденного
состояния (τ) непосредственно связана
с вероятностью излучательного перехода
и отражает среднестатистическое время
существования возбужденного состояния.
= В(1- Т). Вследствие этого спектр возбуждения
флуоресценции должен совпадать со
спектром поглощения вещества.
Длительность
флуоресценции или время жизни возбужденного
состояния (τ) непосредственно связана
с вероятностью излучательного перехода
и отражает среднестатистическое время
существования возбужденного состояния.
27.Интеркомбинационная конверсия, триплетные состояния и фосфоресценция. Основные закономерности (законы Стокса, Вавилова и Левшина ) и характеристики ( спектр фосфоресценции, квантовый выход, длительность). Наряду с синглетными (S) молекула обладает триплетными (Т) электронными уровнями, расположенными в шкале энергий ниже, чем синглетные . Переход синглетного возбужденного состояния за время около10-12 с в триплетное называется интеркомбинационной конверсией: S1—>Т. При интеркомбинационной конверсии ориентация спина фотоэлектрона меняется на противоположную, в результате чего спины двух ранее спаренных электронов становятся параллельными. Триплетная молекула приобретает парамагнитные свойства, приближаясь к бирадикалу. Во внешнем магнитном поле триплетный уровень расщепляется на три составляющих уровня, каждый из которых соответствует одному из трех типов ориентации суммарного спина: по полю, перпендикулярно и против поля. Так появился термин «триплетное состояние». При излучательной дезактивации (Т—>S0) триплетной молекулы высвечивается квант фосфоресценции. Фосфоресценция характеризуется теми же специфическими параметрами, что и флуоресценция: спектром, квантовым выходом, длительностью возбужденного состояния и поляризацией. Спектры фосфоресценции сдвинуты в длинноволновую область по сравнению со спектрами флуоресценции и формируются при излучательных переходах фотоэлектрона с нижнего колебательного подуровня «триплета» на различные колебательные подуровни основного состояния. Вследствие квантовомеханических запретов длительность _фосфоресценции имеет довольно большие значения. Триплетная молекула может переходить в синглетное возбужденное состояние либо за счет тепловой энергии, либо при взаимодействии с другой триплетной молекулой. В обоих случаях наблюдается замедленное свечение, сходное по спектрам с флуоресценцией, а по длительности - с фосфоресценцией. Кроме того, триплетная молекула может поглотить второй квант света, в результате чего фотоэлектрон переходит на второй триплетный уровень - триплет (Т1)-триплетное (Т2) поглощение. Спектры флуоресценции сдвинуты в длинноволновую область но сравнению с длинноволновой полосой поглощения (правило Стокса) и зеркально-симметричны ей (правило Левшина). Правило Стокса означает, что энергия кванта флуоресценции меньше энергии кванта возбуждающего света. Это обусловлено двойной потерей энергии на пути между франк-кондоновским и равновесным электронно-колебательным основным состоянием. Спектры флуоресценции не зависят от длины волны возбуждающего света. Длина волны, при которой пересекаются спектры флуоресценции и поглощения, соответствует чисто электронному переходу Энергия излучаемого при этом кванта соответствует энергии синглетного электронно-возбужденного состояния. Колебательная структура спектров флуоресценции отражает систему колебательных подуровней основного состояния молекулы. Спектры флуоресценции являются индивидуальной характеристикой вещества. Квантовый выход флуоресценции (В) - отношение количества высвеченных (nфл) квантов к поглощенным ( ) - отражает вероятность дезактивации синглетного возбужденного состояния по излучательному пути: В = nфл / . его величина меньше единицы. Квантовый выход флуоресценции имеет постоянные значения, независимо от того, светом какой длины волны в пределах полосы поглощения освещают вещество (закон Вавилова). Причина этого - установление теплового равновесия в системе возбужденная молекула-среда с испусканием квантов с одного и того же нижнего колебательного подуровня возбужденного состояния. При этом измеряют так называемые спектры возбуждения (действия) флуоресценции, которые показывают, насколько эффективен свет той или иной длины волны для возбуждения свечения : nфл / . Где nфл - количество квантов флуоресценции, -количество квантов возбуждающего (падающего на объект) света. при одной и той же квантовой интенсивности возбуждающего света количество возбужденных молекул, а, следовательно, и интенсивность флуоресценции будут прямо пропорциональны поглощению: = В(1- Т). Вследствие этого спектр возбуждения флуоресценции должен совпадать со спектром поглощения вещества. Длительность флуоресценции или время жизни возбужденного состояния (τ) непосредственно связана с вероятностью излучательного перехода и отражает среднестатистическое время существования возбужденного состояния.
28.Основные
особенности строения кристаллов.
Межплоскостные расстояния и индексы
узловых плоскостей кристаллических
структур. Все
сложное явление дифракции рентгеновских
лучей в кристалле можно представить
как их зеркальное отражение от некоторых
плоскостей, которые можно мысленно
построить в кристаллической решетке.
Каждому отраженному лучу принято
приписывать определенные индексы,
которые одновременно являются индексами
отражающей плоскости (так называемые
миллеровские индексы) и характеризуют
ориентацию отражающих плоскостей в
кристалле Один из основных законов
кристаллографии состоит в том, что
внешние грани кристаллов параллельны
плоскостям с небольшими миллеровскими
индексами. Разделив ребра элементарной
ячейки на отрезки определенной длины,
мы можем провести через последовательные
точки деления серию последовательных
плоскостей . Все они окажутся параллельными
друг другу и будут находиться на
одинаковом одна от другой расстоянии.
Такому семейству параллельных плоскостей
приписывают одни и те же индексы. Таким
образом, для каждого семейства плоскостей
с определенными индексами характерно
свое межплоскостное расстояние.
Межплоскостные расстояния принято
обозначать
 -
миллеровские индексы семейства
плоскостей. Основной закон дифракции
рентгеновских лучей в кристалле - закон
Брегга-Вульфа - определяет зависимость
угла отражения рентгеновских -лучей υ
от длины волны используемого излучения
λ и межплоскостного расстояния d той
системы плоскостей, от которой происходит
отражение. Если использовать
монохроматическое излучение, то закон
Брегга-Вульфа можно записать в виде
2d/n sin υ = λ. Здесь n носит название порядка
отражения. При постоянном значении λ
можно наблюдать различные порядки
отражения от какой-либо системы плоскостей
кристалла, изменяя определенным образом
угол υ. Угол υ, под которым отражаются
рентгеновские лучи, называется брегговским
углом или углом дифракции. Для
того чтобы произошло усиление
интенсивности, необходимо, чтобы разность
хода лучей (отраженных последовательными
плоскостями) BB'-BD = 2d sin υ равнялась целому
числу длин волн (nλ).Уравнение 2d sin υ = nλ
есть закон Брегга-Вульфа.
-
миллеровские индексы семейства
плоскостей. Основной закон дифракции
рентгеновских лучей в кристалле - закон
Брегга-Вульфа - определяет зависимость
угла отражения рентгеновских -лучей υ
от длины волны используемого излучения
λ и межплоскостного расстояния d той
системы плоскостей, от которой происходит
отражение. Если использовать
монохроматическое излучение, то закон
Брегга-Вульфа можно записать в виде
2d/n sin υ = λ. Здесь n носит название порядка
отражения. При постоянном значении λ
можно наблюдать различные порядки
отражения от какой-либо системы плоскостей
кристалла, изменяя определенным образом
угол υ. Угол υ, под которым отражаются
рентгеновские лучи, называется брегговским
углом или углом дифракции. Для
того чтобы произошло усиление
интенсивности, необходимо, чтобы разность
хода лучей (отраженных последовательными
плоскостями) BB'-BD = 2d sin υ равнялась целому
числу длин волн (nλ).Уравнение 2d sin υ = nλ
есть закон Брегга-Вульфа.

Рис.Следы различных систем отражающих плоскостей в кристаллической решетке.
29.Цели, принципы и задачи рентгеноструктурного анализа. Условия дифракции рентгеновских лучей на кристаллах. Уравнение Брэгга-Вульфа. Метод дает возможность проводить идентификацию веществ по их рентгенограммам, получать информацию о типе ячеек Браве кристаллов и их структурном типе, проводить простейшие расчеты, основанные на информации, получаемой из рентгенограмм, характеризовать распределение электронной плотности в кристаллических веществах. Условия дифракции рентгеновских лучей могут быть описаны в различной форме в зависимости от того, какое описание пространственной решетки при выводе условий дифракции используется. Если рассматривается пространственная решетка как совокупность параллельных узловых плоскостей, то условие дифракции описывается уравнением, выведенным в 1912 г. независимо друг от друга русским профессором Ю.В. Вульфом и английским физиком B.JI. Брэггом. Разделив ребра элементарной ячейки на отрезки определенной длины, мы можем провести через последовательные точки деления серию последовательных плоскостей . Все они окажутся параллельными друг другу и будут находиться на одинаковом одна от другой расстоянии. Такому семейству параллельных плоскостей приписывают одни и те же индексы. Для каждого семейства плоскостей с определенными индексами характерно свое межплоскостное расстояние. Межплоскостные расстояния принято обозначать - миллеровские индексы семейства плоскостей. Основной закон дифракции рентгеновских лучей в кристалле - закон Брегга-Вульфа - определяет зависимость угла отражения рентгеновских -лучей υ от длины волны используемого излучения λ и межплоскостного расстояния d той системы плоскостей, от которой происходит отражение. Если использовать монохроматическое излучение, то закон Брегга-Вульфа можно записать в виде 2d/n sin υ = λ. Здесь n носит название порядка отражения. При постоянном значении λ можно наблюдать различные порядки отражения от какой-либо системы плоскостей кристалла, изменяя определенным образом угол υ. Угол υ, под которым отражаются рентгеновские лучи, называется брегговским углом или углом дифракции. Для того чтобы произошло усиление интенсивности, необходимо, чтобы разность хода лучей (отраженных последовательными плоскостями) BB'-BD = 2d sin υ равнялась целому числу длин волн (nλ).Уравнение 2d sin υ = nλ есть закон Брегга-Вульфа.
30.Три метода получения дифракционной картины рентгеновских лучей на кристаллах ( методы Лауэ, порошка и вращающего кристалла). Условия дифракции Лауэ. Условия дифракции выполняются не при любых значениях длин волн и углов падения рентгеновских лучей на кристалл. Для того, чтобы наблюдалась дифракционная картина от монокристалла при использовании монохроматического излучения, необходимо изменять ориентацию кристалла относительно падающего рентгеновского луча (метод вращающегося кристалла). Можно при фиксированном положении монокристалла получить дифракционную картину, если использовать не монохроматическое рентгеновское излучение, а непрерывный набор различных длин волн (белое рентгеновское излучение) Такой способ получения дифракционной картины называется методом Лауэ. Еще один способ получения дифракционной картины заключается в использовании монохроматического излучения и набора большого числа хаотически ориентированных микрокристаллов, среди которых всегда найдутся ориентации, удовлетворяющие условиям дифракции. Такой способ получения дифракционной картины называется методом порошка Каждый из названных методов имеет свое аппаратурное оформление и используется для решения определенных задач.
31.Назначение, устройство и принцип работы дифрактометров. Регистрация рентгеновской дифракционной картины кроме фотоэмульсионной пленки может быть осуществлена также ионизационными методами. Для этого служат специальные приборы, называемые дифрактометрами. Дифрактометры позволяют измерять положения и интенсивности рентгеновских отражений при помощи гейгеровских, пропорциональных или сцинтилляционных счетчиков, которые, двигаясь синхронно вместе с кристаллом, регистрируют последовательно дифракционные максимумы. Во-первых, при использовании автоматических дифрактометров значительно сокращается время, требуемое для измерения интенсивностей рефлексов полного дифракционного поля. Во-вторых, точность измерений, определяемая длительностью регистрации максимумов, может быть доведена до 1-2%.Дифрактометры необходимы для измерения слабых рефлексов дальних участков дифракционного поля, которые не могут быть выявлены фотометодом при больших экспозициях, так как время жизни белковых кристаллов ограничено. Результаты измерений на дифрактометре могут быть автоматически записаны на перфокарты или перфоленту, которые затем непосредственно используются в вычислительных машинах. Различные конструкции дифрактометров отличаются схемой связи и характером движения кристалла и счетчика.
32.Теоретические
основы, принципы и инструментальное
использование рефрактометрического
метода.
Показатель преломления - важная оптическая
характеристика прозрачных сред. Метод
измерения показателя преломления
-рефрактометрия - применяется в
лабораторной практике для определения
концентрации вещества в растворе,
установления его подлинности и чистоты.
Приборы, использующие особенности
распространения света в оптических
волокнах с особым распределением
показателя преломления -эндоскопы,
широко используются для обследования
полостных органов тела человека. Пусть
две прозрачные среды находятся в контакте
и из среды I в сторону среды II распространяется
луч света . Тогда на границе раздела
двух сред происходит отражение и
преломление (рефракция) света. Эти
процессы подчиняются следующим законам:
1.
Отраженный (1')
и преломленный (1") луч лежат в одной
плоскости, проходящей через падающий
луч (1) и перпендикуляр (2) к оверхности
раздела. 2. Угол отражения 7 равен углу
падения
 :
: =
.3. Синус угла падения
относится к синусу угла преломления β
( как показатель преломления (n2)
во второй среде к показателю преломления
в первой среде (n1)
=
.3. Синус угла падения
относится к синусу угла преломления β
( как показатель преломления (n2)
во второй среде к показателю преломления
в первой среде (n1)
 Физический смысл показателя преломления
n
- отношение скорости света в вакууме с
к скорости света v в данной среде:
n
=c/v
.Отношение показателей преломления
двух сред - среды 2 с показателем
преломления n2
и среды 1 с показателем преломления
Физический смысл показателя преломления
n
- отношение скорости света в вакууме с
к скорости света v в данной среде:
n
=c/v
.Отношение показателей преломления
двух сред - среды 2 с показателем
преломления n2
и среды 1 с показателем преломления
 -называют относительным коэффициентом
преломления: n21=
n2
/
,
Если
первой средой является вакуум (или
воздух), для которых
= c/v = 1, то относительный показатель
преломления просто равен показателю
преломления во второй среде n21
= n2.
Из
двух сред, та, у которой показатель
преломления выше, называется оптически
более плотной. Например, вода (показатель
преломления n
= 1,334) оптически более плотная среда, чем
воздух (показатель преломления n = 1).
Если
луч падает из оптически менее плотной
среды в более плотную (
<
n2)
, то по мере возрастания угла падения а
от 0 до 90° угол преломления β также
увеличивается, достигая максимального
значения -предельного угла преломления
βпред
Существование предельного угла
преломления означает, что при падении
луча из первой среды во вторую, в последней
отсутствуют лучи, распространяющиеся
под углами, большими, чем предельный.
При этом возникает граница раздела
"свет - тень". Если
луч падает из оптически более плотной
среды в менее плотную (
>
n2)
, то угол преломления β больше угла
падения α. По мере возрастания угла
падения α от 0 до критического значения
- угла полного внутреннего отражения
(ПВО) αпво
, угол преломления β также увеличивается,
достигая максимального значения 90° В
этом случае преломленный луч скользит
вдоль границы между двумя средами.
Существование угла полного внутреннего
отражения αпво
означает, что при падении луча из первой
среды во вторую под углами, большими,
-называют относительным коэффициентом
преломления: n21=
n2
/
,
Если
первой средой является вакуум (или
воздух), для которых
= c/v = 1, то относительный показатель
преломления просто равен показателю
преломления во второй среде n21
= n2.
Из
двух сред, та, у которой показатель
преломления выше, называется оптически
более плотной. Например, вода (показатель
преломления n
= 1,334) оптически более плотная среда, чем
воздух (показатель преломления n = 1).
Если
луч падает из оптически менее плотной
среды в более плотную (
<
n2)
, то по мере возрастания угла падения а
от 0 до 90° угол преломления β также
увеличивается, достигая максимального
значения -предельного угла преломления
βпред
Существование предельного угла
преломления означает, что при падении
луча из первой среды во вторую, в последней
отсутствуют лучи, распространяющиеся
под углами, большими, чем предельный.
При этом возникает граница раздела
"свет - тень". Если
луч падает из оптически более плотной
среды в менее плотную (
>
n2)
, то угол преломления β больше угла
падения α. По мере возрастания угла
падения α от 0 до критического значения
- угла полного внутреннего отражения
(ПВО) αпво
, угол преломления β также увеличивается,
достигая максимального значения 90° В
этом случае преломленный луч скользит
вдоль границы между двумя средами.
Существование угла полного внутреннего
отражения αпво
означает, что при падении луча из первой
среды во вторую под углами, большими,
чем
αпво,
свет полностью отражается и не происходит
потерь энергии, связанных с выносом
энергии волнами, покидающими эту среду.
Если же рассмотреть распространение
лучей в обратном направлении - из нижней
среды в верхнюю, когда луч идет из
оптически более плотной среды в менее
плотную. Для этого случая характерно
существование угла полного внутреннего
отражения αпво
. Таким образом, для границы раздела
двух сред в зависимости от направления
распространения света существуют либо
предельный угол преломления, либо угол
полного внутреннего отражения, численно
эти углы равны. Показатель преломления
растворов
 определяется показателем преломления
растворителя n0
и линейно зависит от концентрации с
растворенного вещества:
=
n0+
Ас, где А - коэффициент пропорциональности,
характерный для данного растворенного
вещества .
определяется показателем преломления
растворителя n0
и линейно зависит от концентрации с
растворенного вещества:
=
n0+
Ас, где А - коэффициент пропорциональности,
характерный для данного растворенного
вещества .
33.Назначение,
устройство и принцип работы рефрактометров.
Принцип
действия рефрактометра состоит в
измерении предельного угла преломления
на границе исследуемой жидкости и
стеклянной призмы с известным коэффициентом
преломления. Рефрактометр состоит из
двух призм: вспомогательной откидной
призмы (1) с матовой нижней гранью (2) и
измерительной призмы (3). Между ними
имеется тонкий зазор толщиной 0,1 мм, в
который помещается несколько капель
исследуемой жидкости (4). Измеряется
предельный угол преломления на границе
жидкость - измерительная призма. Величину
угла и, соответственно, коэффициент
преломления определяют с помощью
отсчетного устройства (5). Встроенный в
него компенсатор (6) позволяет сделать
границу свет - тень черно-белой при
освещении белым светом Отсчеты
производятся глазом (7). Рефрактометр
работает следующим образом. Луч света
проходит через вспомогательную откидную
призму (I) и рассеивается на матовой
нижней грани (2). При этом рассеянные
лучи распространяются во всех направлениях,
в том числе и параллельно поверхности
измерительной призмы (3) . Далее эти лучи
преломляются на границе жидкость (4) -
измерительная призма (3), и, пройдя сквозь
эту призму (3), попадают в отсчетное
устройство (5). Если граница свет - тень
оказалась окрашенной и размытой, надо
с помощью компенсатора (6) добиться
резкой черно-белой границы. Путем
поворота специального рычага необходимо
совместить границу свет - тень с маркером
отсчетного устройства. При этом маркер
показывает на встроенной шкале
непосредственно значения коэффициента
преломления .

Рисунок - блок-схема рефрактометра
34. Природа постоянного дипольного момента. Дипольные моменты отдельных связей и групп и их некоторое сложение в многоатомных молекулах . Измерение молекулярной рефракции. Дипольный момент – важная молекулярная константа, характеризующая электрическую симметрию молекулы. Знание величины дипольного момента необходимо для изучения природы химической связи, оценки прочности донорно-акцепторных и межмолекулярных связей, для квантово-химических расчетов. По величине дипольного момента можно судить об изомерии и конформации органических соединений, конфигурации координационных узлов комплексов, о взаимном влиянии атомов и связей в молекуле. Величина электрического дипольного момента (μ) определяется соотношением: μ= q*1
где l - радиус-вектор, направленный от центра тяжести отрицательного электрического заряда к центру тяжести положительного заряда, абсолютная величина каждого заряда равна q. Принято измерять дипольные моменты в единицах Дебая: 1 D = 1·10-18 эл.-ст. ед. В системе единиц СИ 1 D = 3.34·10-30 Кл*м. Причиной появления дипольного момента являются несколько факторов. В первую очередь – это различия в природе составляющих молекулу атомов. В простейшем случае для двухатомной молекулы μ = 0, если она состоит из двух одинаковых атомов. Это относится к H2, O2, N2 и т.д. В двухатомной молекуле с атомами разной природы проявляется постоянный дипольный момент, т. к., вследствие разной электроотрицательности, характеризующей способность атома оттягивать электронную плотность, появляется асимметрия электронной плотности. Другие причины – разные гибридные состояния орбиталей атомов. Методы определения дипольных моментов основаны на нахождении ориентационного эффекта (за исключением метода молекулярного пучка) полярных молекул в приложенном электрическом поле. При этом следует учитывать, что если молекула является полярной и обладает дипольным моментом, то он называется постоянным или собственным дипольным моментом (μ0). А при поляризации молекул в электрическом поле возникает индуцированный дипольный момент молекулы (μg). В статических полях или полях с относительно низкими частотами колебаний происходит поляризация вещества в целом, включающая также некоторое смещение ядер и ориентацию молекул вдоль поля, и возникает индуцированный ориентационный дипольный момент молекул (μr), который зависит от μo и из которого можно определить постоянный дипольный момент молекулы μo. Для точных измерений μ0 малых молекул применяются методы, основанные на микроволновой спектроскопии и молекулярных пучков. Особенно распространен метод Штарка, основанный на эффектах расщепления и сдвига спектральных линий в электрическом поле. Для линейных молекул известны точные выражения, связывающие дипольный момент со штарковским расщеплением линий вращательных спектров. Этот метод дает наиболее точные значения величины дипольного момента (до 10-4 D), причем экспериментально определяется не только величина, но и направление вектора дипольного момента. Важно, что точность определения дипольного момента почти не зависит от его абсолютной величины. Это позволило получить весьма точные значения очень малых дипольных моментов ряда молекул углеводородов, которые нельзя надежно определить другими методами.
35.Теоретические основы, принципы и инструментальное использование поляриметрического метода для определения концентрации оптически активных веществ. Метод исследования вещества, основанный на использовании явления вращения плоскости поляризации света, называется поляриметрией. Поляриметрия широко применяется в медицине, биофизике, химии и фармации. Конкретно используется в следующих целях измерение концентрации Сахаров в растворах; измерение степени спиральности белков; исследование переходов спираль-клубок в биополимерах; контроль денатурации и ренатурации биополимеров под влиянием различных факторов. Оптической активностью называется вращение плоскости поляризации света при прохождении через оптически активные вещества. К таковым относятся углеводы, аминокислоты, белки, антибиотики и многие лекарственные вещества. Ряд веществ обладает разными оптическими свойствами для разных поляризаций .Так например, свет с одной поляризацией может проходит почти полностью, а с прочими - сильно поглощается. Такими свойствами обладает так называемая поляроидная пленка Если через такую пленку (назовем ее "анализатор") рассматривать естественный свет, который излучает Солнце или ряд других источников света, то при любом повороте такой пленки в плоскости, перпендикулярной лучу, интенсивность проходящего света не изменяется. Если же на пути этого луча предварительно поставить еще одну такую пленку (ее называют "поляризатор") и повторить эксперимент, то окажется, что дважды за период вращения анализатора измеряемая интенсивность I света меняется от нуля до максимального значения I0 и подчиняется закону Малюса: I = I 0Cos2 φ, где φ - угол вращения, отсчитываемый от положения с максимальной интенсивностью света. Таким образом, поляризатор - это устройство, которое из естественного света делает поляризованный. Плоскость, в которой у поляризованного света лежит вектор напряженности электрического поля Е, называется главной. В качестве поляризатора, кроме поляроидной пленки, можно использовать специальные оптические устройства (призму Николя и др.). Вращением плоскости поляризации называется поворот этой плоскости при прохождении через вещество. Вещества, способные вращать плоскость поляризации, называются оптически активными .К ним относятся органические асимметричные молекулы, лишенные зеркальной симметрии.
36.Назначение,
устройство и принцип работы поляриметров.
Метод исследования вещества, основанный
на использовании явления вращения
плоскости поляризации света, называется
поляриметрией. Поляриметрия широко
применяется в медицине, биофизике, химии
и фармации. Конкретно используется в
следующих целях измерение концентрации
Сахаров в растворах; измерение степени
спиральности белков; исследование
переходов спираль-клубок в биополимерах;
контроль денатурации и ренатурации
биополимеров под влиянием различных
факторов. Оптической активностью
называется вращение плоскости поляризации
света при прохождении через оптически
активные вещества. К таковым относятся
углеводы, аминокислоты, белки, антибиотики
и многие лекарственные вещества. Удельное
вращение веществ изучается с помощью
поляриметров. Схема поляриметра
представлена на рисунке.
Поляриметр
круговой (СМ-3) предназначен для измерения
угла вращения плоскости поляризации
оптически активными прозрачными
растворами. В его состав входит источник
света (И), светофильтр (СФ), пропускающий
свет с длиной волны 589 нм, поляризатор
(П), кювета (К) с исследуемым веществом,
анализатор (А) с отсчетным устройством,
окуляр (О).

И - источник света; СФ - светофильтр, П - поляризатор; Ф11 - фазовая пластинка; К - кювета с исследуемым веществом, А - анализатор с отсчетным устройством; О -окуляр . Половина пучка поляризованного света перекрывает фазовая пластинка (ФП). Последняя нужна, чтобы обеспечить полутеневой отсчет, который существенно повышает точность измерений. Порядок работы на приборе описывается в инструкции по эксплуатации В корпусе прибора (1) расположены источник света, светофильтр, поляризатор, фазовая пластинка. К нему крепится кюветное отделение (2) с поворачивающейся крышкой (3), через окуляр (4) наблюдается изображение полутеневого отсчета . Ручкой 5 поворачивают анализатор Через линзы отсчетного устройства (6) рассматриваются шкалы (7) отсчетного устройства.
37.Теоретические основы кондуктометрии и кондуктометрического титрования. Зависимость электропроводности растворов от концентрации и химической природы вещества и температуры. Определение концентрации кислоты методом кондуктометрического титрования. Концентрацию хлороводорода в растворе можно измерить по ее электропроводности кондуктометрическим методом анализа (чисто физический метод). Если же в растворе хлороводорода появятся примеси, например, хлорид натрия, то определение кислотности по электропроводности приведет к неправильным результатам. Можно, используя ту же аппаратуру, сделать определение более избирательным, устранив влияние хлорида натрия. Для этого испытуемый раствор титруют щелочью и записывают электропроводность как функцию количества прибавленной щелочи. По перегибу кривой титрования можно найти точку эквивалентности и рассчитать количество хлороводорода не из данных электропроводности, а по количеству затраченной щелочи .Это уже метод кондуктометрического титрования (физико-химический метод). Кондуктометрическое титрование (предполагает титрование, конец которого определяют по перегибу кривой зависимости электропроводности от количества прибавленного титрованного рабочего раствора). Недостатком этого метода является присутствие посторонних электролитов, увеличивающих фон проводимости, что уменьшает чувствительность и точность метода Кондуктометрическое титрование является разновидностью кондуктометрического метода высокочастотного титрования, при котором применение тока высокой частоты позволяет пользоваться системой без погружаемых в раствор электродов; Кондуктометрический анализ - относят методы в которых измеряется электропроводность электролитов.Так, например, в процессе титрования едкого натра хлористоводородной кислотой Na++OH+H++Cl-=Na++Cl-+H2O концентрация щелочи уменьшается. Так как электропроводность раствора значительно ниже электропроводности раствора и хлористоводородной кислоты, то по мере прибавления кислоты электропроводность раствора уменьшается и в точке эквивалентности будет наименьшей. При дальнейшем прибавлении хлористоводородной кислоты электропроводность вновь возрастает. (рис на след. странице)

38.Теоретические основы потенциометрии и потенциометрического титрования. Определение концентрации соляной кислоты в смеси кислот потенциометрическим титрованием. Потенциометрические определения основаны на том, что потенциал ряда электродов является функцией активностей компонентов соответствующих окислительно-восстановительных систем. Для проведения потенциометрического измерения ячейку, состоящую из электрода, потенциал которого хотят измерить (индикаторный электрод), и вспомогательного электрода, потенциал которого известен (электрод сравнения), включают в схему, измеряющую электродвижущую силу. По полученному значению потенциала индикаторного электрода можно определить активность или отношение активностей соответствующих ионов. Однако для химического анализа интерес представляет определение концентрации, а не активности веществ. Поэтому потенциометрия с одновременным обычным титрованием широко используется лишь для определения рН растворов. Такой метод получил название потенциометрического титрования. Потенциометрическое титрование является объемно-аналитическим методом. Как и обычное титрование, потенциометрическое титрование основано на резком изменении вблизи точки эквивалентности концентрации титруемого вещества при прибавлении к раствору небольшого количества титрующего реагента. Конец титрования определяется по резкому изменению потенциала индикаторного электрода вблизи точки эквивалентности. Это объясняется линейной зависимостью потенциала электрода и концентрацией (активностью) ионов. Выбор индикаторного электрода при потенциометрическом титровании определяется типом протекающей реакции и природой присутствующих в растворе ионов. При реакциях окисления-восстановления в качестве индикаторного электрода чаще всего используют электроды из индефферентного металла (платины, золота). При реакциях нейтрализации индикаторными электродами могут служить электроды, потенциал которых зависит от величины рН (водородный, хингидронный, сурьмяный и др.). Кроме типа реакции, выбор электродов зависит от условий титрования, наличия в растворе загрязнений, интервала изменения рН во время титрования и др. При реакциях осаждения и комплексообразования обычно используются электроды, потенциал которых является функцией концентрации (активности) ионов, принимающих участие в реакции осаждения или комплексообразования. Потенциометрическое титрование можно проводить по компенсационному и некомпенсационному методам. При компенсационном методе во время титрования определяют электродвижущую силу (э.д.с.) потенциометрической ячейки, а при некомпенсационном - силу тока, протекающего в цепи ячейки. Некомпенсационный метод потенциометрического титрования является более быстрым и удобным. При потенциометрическом титровании для нахождения точки эквивалентности существуют различные графические, расчетные и инструментальные способы. Так как максимальное изменение э.д.с. потенциометрической ячейки наблюдается вблизи точки эквивалентности, то наиболее простым и удобным способом ее определения является графическое построение кривой титрования. При этом на оси абсцисс откладывают объем прилитого титрованного раствора (v), а на оси ординат - соответствующие значения э.д.с. ячейки. При некомпенсационном методе титрования вместо величины э.д.с. откладывают соответствующую силу тока (i) Точку эквивалентности (т. экв ) находится по перегибу кривой титрования.Потенциометрическое титрование удобно выполнять, используя специальные приборы (титраторы, рН-метры, потенциометры и др.). Принцип действия и порядок работы на них излагается в прилагаемых к этим приборам инструкциях.
39.Изотопные методы исследований в биологии и их значение. Изотопный метод впервые был применен в 1940 г. Шенхаймером и Риттенбергом, которые показали, каким образом, используя химические соединения, в которых часть водорода замещена на дейтерий, можно проследить судьбу этих соединений, определяя содержание дейтерия в возможных продуктах превращений. В настоящее: время используют два типа изотопов. 1) Тяжелые или стабильные изотопы. Искомое соединение обогащают одним из изотопов, встречающихся в природе в очень малых концентрациях , и следят за его появлением в продуктах преобразования. Использование обогащенных тяжелыми изотопами предшественников приводит к тому, что синтезированные из них макромолекулы обладают повышенной плотностью, что позволяет осуществлять соответствующую идентификацию. Количественная оценка содержания тяжелых изотопов производится либо просто путем определения плотности, либо масс-спектрометрическим методом. 2)Радиоактивные изотопы. Эти изотопы получают, как правило, в ядерных реакторах, которые затем включают в требуемые соединения путем химического синтеза. Для синтеза можно использовать также живые клетки, вводя в них радиоактивные элементы через питательную среду . Радиоактивные Н1 ,С14 , Р32 ,S 35 , І 131, І125. Тяжелые (стабильные) H2 , N15, O13. Изотопы можно использовать как при работе с живыми организмами , так и в опытах с использованием препаратов тканей и отдельных клеток. В биологии пользуются относительной удельной активностью, подразумевая радиоактивность биохимического соединения, приходящуюся на единицу веса вещества. Радиоактивность выражают в милликюри или микрокюри, а иногда характеризуют просто числом импульсов в минуту, регистрируемых счетчиками. В основе лежит способность фотографических эмульсий регистрировать радиоактивные распады, благодаря чему удается локализовать местоположение радиоактивных соединений внутри клетки путем наблюдения в микроскоп почерневших участков чувствительной пленки, накладываемой на клетку.
40.Теоретические основы гель- и ионообменной хроматографии. Определение молекулярной массы неизвестных высокомолекулярных соединений с помощью гель-хроматографии. Хроматография как и другие методы разделения, основана на распределении веществ между двумя фазами. Одной фазой является анализируемая жидкость, например, какой-нибудь раствор или газ (смесь газов), другой фазой - твердый поглотитель (сорбент). При контакте этих двух фаз происходит химическое взаимодействие, например, ионный обмен, или поглощение за счет сил Ван-дер-Ваальса, в результате чего вещества распределяются так, что концентрация определяемых элементов в жидкости (или газе) уменьшается, происходит поглощение - сорбция их твердым поглотителем. При соответствующем изменении условий, например, при обработке поглотителя подходящими растворителями или при нагревании происходит обратный процесс - десорбция: поглощенные вещества переходят в жидкую или газообразную фазу, т.е. извлекаются из поглотителя. Поскольку различные вещества сначала при сорбции, а затем при десорбции, дважды по-разному распределяются между двумя данными фазами, смеси веществ легко разделяются хроматографическим методом. Вместе с тем путем сорбции из большого объема и десорбции в меньший объем достигается концентрирование сорбированных веществ, что также используется в анализе. Хроматографирование проводится обычно при помощи колонки представляющей собой трубку, наполненную порошком поглотителя Через подобную колонку и пропускают растворы (или газы), проводя сначала сорбцию, а затем десорбцию. Этот метод исследования назван хроматографическим потому, что при разделении в колонке окрашенных смесей на сорбенте образуются цветные зоны , и получается хроматограмма. Число зон на хроматограмме равно числу окрашенных веществ, находящихся в данной смеси. Хроматографическому разделению можно подвергать и бесцветные вещества. В этом случае, чтобы различить зоны хроматограмму обрабатывают реактивами, образующими окрашенные соединения с компонентами смеси, или пользуются другими специальными приемами. Сорбентами чаще всего являются твердые высокомолекулярные соединения Поглощение (сорбция) есть реакция поглощающегося вещества с данным высокомолекулярным соединением. Хроматография на колонках (общие положения) Для хроматографии используют цилиндрическую стеклянную колонку (трубку), снабженную в нижней части запорным устройством, которую заполняют твердым веществом известной природы в виде порошка или геля. Заливают раствор смеси веществ, подлежащих разделению Компоненты этой смеси связываются так или иначе с веществом колонки (носителем). Затем через колонку пропускают жидкость,называемую элюентом, которая снимает компоненты смеси, но не все сразу, а последовательно. В результате эти компоненты движутся вниз по колонке одно за другим и могут быть получены раздельно, если вытекающую жидкость собирать небольшими фракциями. После этого может быть проведено их количественное определение и исследование. Сбор фракций ведут автоматически при помощи коллектора фракций. Существует много различных типов хроматографии на колонках: адсорбционная хроматография, хроматография на ионнообменных смолах, афинная хроматография (хроматография по сродству), гель-хроматография (хроматография на декстране) и др., которые отличаются используемыми носителями и техникой проведения хроматографии. Кроме колоночной хроматографии в научных и учебных целях широко используется хроматография на бумаге. По существу, это один из вариантов распределительной хроматографии, в основе которой лежат различия в относительной растворимости веществ, входящих в состав смесей (аминокислот и др.) в водных и в органических растворителях. Используя явление капиллярности хроматографической бумаги, проводят разделение смеси веществ определенным растворителем. Растворитель вымывает из пятна нанесенных на бумагу смеси веществ и уносит с собой компоненты смеси; три этом те из них, которые лучше растворимы в органическом растворителе, продвинутся соответственно на большее расстояние вдоль полоски бумаги. По окончании процесса миграции каждое из веществ характеризуют отношением между пройденным им расстоянием и расстоянием, на которое продвинулся фронт жидкости .
41.Электрофорез
в полиакриламидном геле. Определение
степени чистоты и молекулярной массы
неизвестных высокомолекулярных
соединений. Электрофорез
белков в полиакриламидном геле — метод
разделения смесей белков в полиакриламидном
геле в соответствии с их электрофоретической
подвижностью (функцией длины полипептидной
цепочки или молекулярной массы, а также
укладки белковой молекулы, посттрансляционных
модификаций и других факторов). Данный
способ фракционирования белков и
пептидов широко применяют в современной
молекулярной биологии, биохимии,
генетике. Разработано большое количество
модификаций электрофореза белков в
полиакриламидном геле для решения
разных задач и для различных белков и
пептидов. Наиболее распространённой
разновидностью является электрофорез
белков в полиакриламидом геле в
присутствии додецилсульфата натрия по
Лэммли. Электрофоретическая
подвижность биополимеров в геле зависит
от ряда параметров. Скорость миграции
пропорциональна заряду молекулы, и в
свободной жидкости молекулы с одинаковым
удельным зарядом мигрируют с равной
скоростью. В случае разделения в среде,
имеющей жесткую пространственную
матрицу, происходит сегрегация за счет
трения о гель. Сила трения зависит от
пространственной конфигурации молекулы,
в том числе от её размера. Таким образом,
в случае электрофоретического разделения
нативных белков будет наблюдаться
сложная картина их распределения в
зависимости от вышеприведенных факторов.
В
большинстве случаев результаты
электрофоретического разделения
достаточно получить путем визуальной
оценки геля. 2.(подпункт
вопроса) Молекулярная
масса
- важная характеристика всякого
высокомолекулярного соединения,
обусловливающая все основные его
свойства. Поскольку в процессе получения
ВМС образуются смеси полимеров с
различными длинами цепей, а следовательно,
и с различной молекулярной массой,
приходится говорить о некоторой средней
молекулярной массе. Для определения
молекулярной массы ВМС применимы почти
все физико-химические методы, используемые
для определения молекулярной массы
низкомолекулярных веществ: криоскопический,
эбулиоскопический, осмотический,
диффузионный, вискозиметрический и др.
В указанных методах применяются растворы
ВМС в подходящих растворителях. Все
методы определения молекулярной массы
высокомолекулярных соединений можно
разделить на две группы: 1) криоскопический,
эбулиоскопический, осмотический,
основанные на вычислении молярной
концентрации раствора, т. е. на определении
числа частиц в навеске ВМС ;2) диффузионный,
вискозиметрический методы, основанные
на вычислении среднего размера частиц
в растворе. Осмотический метод заключается
в следующем: по величине гидростатического
давления, при котором прекращается
переход растворителя в раствор, измеряют
осмотическое давление раствора ВМС, а
затем используют уравнение Вант-Гоффа:

Вискозиметрический
метод является самым простым и наиболее
применимым на практике методом определения
средней молекулярной массы ВМС. В этом
случае с помощью капиллярного вискозиметра
определяют вязкость исследуемого
раствора и, используя уравнение
Штаудингера, вычисляют М:

Наиболее проверенным и теоретически обоснованным методом определения молекулярной массы ВМС, а также размеров частиц суспензий и золей является метод ультрацентрифугирования. Современная ультрацентрифуга - сложное устройство, приводящееся во вращение с помощью электрического привода. Взвешенные частицы в золях и суспензиях, а также макромолекулы в растворах ВМС подчиняются закону Стокса. В спокойной среде под действием силы тяжести они оседают с постоянной и малой скоростью. Для ускорения оседания необходимо создать силовое поле в сотни тысяч раз больше, чем поле земного притяжения. Такое поле создается при быстром вращении ротора центрифуги.
42.Полярографический метод. Это метод качественного и количественного анализа, основанный на получении кривых зависимости величины тока от напряжения в цепи, состоящей из исследуемого раствора и погруженных в него электродов, один из которых сильно поляризующийся, а второй почти неполяризующийся. Принцип метода: протекание электрического тока в водном растворе связано с движением ионов, образованных в результате электролитической диссоциации. Протекание тока через ртуть, другие металлические и углеродные материалы – с движением электронов. Поэтому на границе электрод-раствор должен существовать какой-то процесс, обеспечивающий переход потока ионов в поток электронов ,иначе ток не пойдет. Такой процесс представляет собой электрохимическую реакцию. Количество прореагировавшего вещества определяется законом Фарадея: т.е. пропорционально прошедшему через электрод заряду: М = Мэкв * Q / zF.
М – масса прореагировавшего вещества; Q – прошедший через электрод заряд; z – количество электронов, участвующий в превращении одной молекулы или одного иона; F – число Фарадея. В качестве поляризуемого электрода могут быть использованы ртутно- капающий электрод и др. На ртутном электроде в водном растворе, содержащем электрохимические неактивные соли (фторид натрия) в широком диапазоне напряжений не протекает никаких реакций, связанных с протеканием тока через электрод, поэтому если прикладывается какое-либо напряжение к ртутно- капельному электроду, ток остается нулевым , т.к. никаких реакций на электроде нет. Такой электрод называется поляризуемым. Для измерения используют полярограф .От потенциометра (2), соединенного с аккумулятором (1) подают постепенно возрастающее напряжение на поляризующийся , обычно капельно-ртутный электрод (3) и неполяризующийся электрод (4) – слой ртути с относительно большой поверхностью. Величину тока , проходящего при этом через анализируемый раствор (5), измеряют гальванометром (6). На основании полученных данных вычерчивают полярограмму. Кривая АВ – полярографическая волна, h – высота, которая пропорциональна концентрации анализируемого вещества в растворе. E ½- напряжение, которое соответствует половине высоты волны и называется потенциалом полуволны. Применение метода – широко используется в металлургии, геологии, орг. химии и медицине, для определения ряда ионов, орг. веществ, их концентрации, а также для изучения механизма электродных реакций.
Нефелометрия
Мощность светового потока рассеиваемого мельчайшими частицами взвеси описывается уравнением Реллея:
Wp
= K1W0
* *(
*(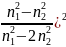
К1 - коэффициент пропорциональности,
V - средний объем частицы,
С - концентрация частиц,
- плотность вещества частицы,
λ - длина волны падающего света,
n1 - показатель преломления частиц взвеси,
n2 - показатель преломления растворителя.
Значение V, δ и n - зависят для данной взвеси от условий ее получения и измерения скорости смешивания реагентов, а так же температуры, кислотности среды, длины волны падающего света.
При постоянстве условий величины n1 , n2, λ , δ и V постоянны.
Объединяя все постоянные величины в одну константу можно записать, что :
Wp = K*C
То есть , мощность рассеянного светового потока прямо пропорциональна концентрации частиц суспензии.
Для двух мутных сред с частицами одинаковой формы и размера отношение мощностей рассеянного света пропорционально отношению концентрации частиц.

C1
=

Уравнение это используют при нефелометрических определениях.
Кроме нефелометрических измерений проводят турбидиметрические измерения. Связь между мощностью прошедшего через суспензию света и размером частиц взвеси описывается уравнением:
D
= lg

D - величина аналогичная оптической плотности(рассеивающая способность)
W0 - мощность падающего на суспензию светового потока,
W - мощность прошедшего через суспензию светового потока,
L - толщина поглощающего слоя,
r - средний диаметр частиц,
λ - длина волны падающего света,
К1 – коэффициент пропорциональности, зависящий от природы суспензии и метода измерения.
α - константа, зависящая только от метода измерения.
Это уравнение применяют для сильно разбавленных суспензий.
При турбидиметрическом измерении пользуются одним и тем же прибором.
Суспензии готовят по строго определенной прописи, то есть все измерения проводят при определенных значениях K, r, α и λ.
Объединяя все постоянные величины в одну получают простое уравнение :
D = K*L*C
Это отношение аналогично уравнению Бугера-Ламберта-Бера для поглощения света окрашенными растворами.
Из уравнения следует , что интенсивность рассеянного и поглощенного света зависит от размера частиц взвеси.
Для предотвращения коагуляции частиц в суспензии часто вводят стабилизаторы (желатин, крахмал …).
Однако этим методом на практике пользуются ограниченно, так как трудно получить одинаковые по размерам частицы взвеси.
Нефелометрические измерения производят с помощью нефелометра. Этот прибор имеет приспособление для наблюдения рассеянного света под углом 90 градусов к направлению падающего луча.
С помощью нефелометра можно определять концентрации коллоидных растворов, суспензий и эмульсий. Прибор действует по принципу управления двух световых потоков: одного – от рассеивающей взвеси, а другого – от матового, стеклянного рассеивателя.
Потоки уравнивают измерением мощности одного из потоков с помощью диафрагмы.
Свет от источника света (1) проходит прозрачную пластинку (2) и попадает в камеру (4) с дистиллированной водой. В этой камере помещена кювета (3) с исследуемой взвесью. Световой поток, прошедший через кювету, гасится в светоловушке. Часть светового потока рассеянного частицами взвеси, проходя через линзу (5) попадает в фотометрическую головку и создает яркость одной половины поля зрения акуляра, вторая часть светового потока, отраженная от пластинки (2) , попадает на рассеиватель(7). Затем, проходя через линзу (5), также попадает в фотометрическую головку и создает яркость второй половины поля зрения акуляра. Световые потоки в фотометрической головке проходят измерительные диафрагмы, каждая из которых связана со своим барабаном (6).Оба световых потока объективами (8), призмами (9) сводятся к оси акуляра (11) и попадают в глаз наблюдателя. Глаз видит поле в форме круга, разделенного пополам вертикальной линией. На измерительных барабанах нанесены 2 шкалы:
1 – светопропускания,
2 – градуирована в единицах оптической плотности.
Для определения концентрации суспензии строят градировочный график, из стандартных растворов суспензий с известными концентрациями определяемого вещества. Определяют, измеряя, оптическую плотность для всех образцов в порядке убывания их концентрации, а затем строят график.
Например: нефелометрическое определение сульфат- ионов.
Метод основан на образовании малорастворимо BaSO4.
S
В разбавленных растворах сульфатов осадок выпадает медленно и получается достаточно устойчивая суспензия.
Ее стабилизируют добавлением желатина.
Полученную суспензию ВаSO4 наливают в кювету нефелометра и измеряют оптическую плотность , а затем по градировочному графику находят концентрацию SО42- в анализируемом растворе.
