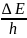- •1.Роль и значение методов исследований в различных отраслях науки ( физике, химии, биологии и др.).Предмет, цели и задачи курса «Физические и физико-химические методы исследований».
- •2.Классификация методов определения и разделения элементов.
- •3.Основные физические методы исследований(примеры).
- •4.Основные физико-химические методы исследований(примеры).
- •5.Инструментальные (оптические) методы исследований.
- •6.Инструментальные (электрохимические) методы исследований.
- •7.Важнейшие критерии выбора методов анализа (чувствительность и др.)
- •8. Важнейшие критерии выбора методов анализа (точность и др.)
- •9.Математическая обработка экспериментальных данных (виды ошибок и их влияние на точность метода).
- •11.Теория ошибок (формула Гаусса нормального распределения вариант, ошибка среднего арифметического, доверительный интервал выборочной средней и доверительная вероятность). Коэффициенты Стьюдента.
- •12. Оценка достоверности разности между средними арифметическими двух выборочных совокупностей с помощью нормативного распределения (1) и критерия р.
- •Показатели корреляции Параметрические показатели корреляции Ковариация
- •Линейный коэффициент корреляции
- •Область применения
- •13.Использование метода наименьших квадратов и элементов корреляционного анализа при обработке информации.
- •Сущность мнк
- •Альтернативное использование мнк
- •14.Взаимодействие света с веществом. Механизм поглощения света . Вращательные, колебательные и электронные уровни в многоатомных молекулах и переходы между ними.
- •16.Основные закономерности поглощения света ( перехода электронов молекул на возбужденный уровень).
- •17.Основной закон светопоглощения – закон Бугера-Ламберта-Бэра и его практическое использование.
- •18.Классификация электронных переходов. Основные хромофоры некоторых многоатомных молекул (белков и нуклеиновых кислот) и их спектры поглощения.
- •22.Пути дезактивации возбужденных молекул. Внутренняя конверсия.
- •24.Виды люминесценции как физического явления.
16.Основные закономерности поглощения света ( перехода электронов молекул на возбужденный уровень).
Испускание света атомами происходит за счёт изменения энергии атомов. Атомы могут обладать только строго определёнными дискретными запасами внутренней энергии Е1,Е2… Это означает, что атомы не могут иметь энергию промежуточного значения. В возбуждённом состоянии уровень энергии изменяется. Если в нормальном состоянии атом обладает минимальной энергией Е0,то при подведении энергии, например при столкновении с быстролетящими электронами атомы возбуждаются и переходят на более высокий энергетический уровень. Через очень короткое время 10-8 с атом самопроизвольно возвращается в нормальное состояние, при этом выделяется энергия в виде светового кванта hν.
Частота излучения ν определяется:
ν= |
 ;
;E' и E – это энергии атома в возбуждённом и нормальном состояниях;
U ˗ скорость.
Совокупность излучаемых частот связана с энергетическим состоянием атома. Энергетическое состояние простейшего одноэлектронного атома водорода определяется энергетическим состоянием его единственного электрона и может быть найдено с помощью уравнения Шредингера. При решении уравнения Шредингера получают набор 3х квантовых- чисел:
Главного n
Побочного l
Магнитного m
4-ое квантовое число – спиновое с уравнением Шредингера не связано.
В атомах и ионах, содержащих более 1 электрона, взаимодействие частиц имеет довольно сложный характер.
Ридберг показал, что спектральные термы атомов щелочных Ме могут быть выражены формулой:
T(n)
=
|
∆ зависит от побочного квантового числа l и сумма (n+∆) иногда называется эффективным квантовым числом.
С увеличением числа внешних электронов формула усложняется.
Группа энергетических состояний характеризуемая одними и теми же величинами l и s имеют близкую энергию и образуют один терм.
Терм основного состояния обычно определяют пользуясь правилами Хунда:
1.Основное, т.е. низшее энергетическое состояние имеет наибольшее значение суммарного спина (мультиплетности).
2.Среди термов с максимальной мультиплетностью низшим является тот, у которого наибольшее значение l.
3.Низшим компонентом мультиплета будет тот, у которого уровень заполнен меньше, чем наполовину.
Вывод системы термов для заданной электронной конфигурации имеет большое значение в теоретической спектроскопии.
Каждая спектральная линия отражает переход электрона с одного энергетического уровня на другой ,при этом волновое число любой спектральной линии может быть представлено как разность термов.
Существует определённое правило отбора, которое указывает какие комбинации термов возможны и не возможны.
Переходы, возможные по этим правилам , называются разрешёнными, а невозможные ˗ запрещёнными.
Основные правила отбора:
1.Разрешены переходы, при которых терм меняется на 1.
Например:p-s,d-p.
Переходы не разрешены:d-d,s-d,p-p.
2.Внутреннее квантовое число может меняться только на ±1 или совсем не меняться.
Запрещены переходы, когда ∆=±2.
3.Разрешены переходы без изменения мультиплетности.