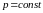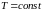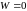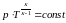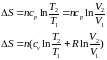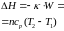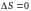- •1 Химическая термодинамика
- •Примеры решения задач
- •Контрольные задания
- •2 Химическое равновесие
- •Примеры решения задач
- •Контрольные задания
- •3 Фазовые равновесия
- •Примеры решения задач
- •Контрольные задания
- •4 Электрохимия
- •Примеры решения задач
- •Контрольные задания
- •5 Химическая кинетика
- •Примеры решения задач
- •Контрольные задания
- •Список литературы
- •Содержание
ВВЕДЕНИЕ
Физическая химия имеет большое практическое значение, открывая широкие возможности активного управления химико-технологическими процессами, рационального использования сырья, повышения качества продукции, экономии энергетических ресурсов, защиты окружающей среды и т.д. Данное методическое пособие является практическим руководством для выполнение контрольной работы по дисциплине «Физическая химия» в котором представлены задания по основным разделам физической химии: химическая термодинамика, химическое равновесие, фазовые равновесия, электрохимия, химическая кинетика и катализ.
Каждый студент выполняет задания согласно варианту, определяемому преподавателем (таблица 1). Прежде чем приступать к решению задач по каждому разделу, следует проработать соответствующий лекционный материал. По учебнику [1] изучить теорию и разобрать решения типовых задач по задачнику [2]. Обратите внимание на то, что некоторые задачи имеют общие условия, а данные представлены в обобщенных таблицах. Для каждой из этих задач исходные данные для расчета нужно брать в таблице напротив номера задачи, соответствующего вашему варианту.
Таблица 1. Варианты и задания к ним
варианты |
номер задания |
|||||||||
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
00 |
1 |
15 |
81 |
87 |
124 |
134 |
151 |
164 |
217 |
240 |
01 |
2 |
16 |
82 |
88 |
125 |
135 |
152 |
165 |
218 |
241 |
02 |
3 |
17 |
83 |
89 |
126 |
136 |
153 |
166 |
219 |
242 |
03 |
4 |
18 |
84 |
90 |
127 |
137 |
154 |
167 |
220 |
243 |
04 |
5 |
19 |
85 |
91 |
128 |
138 |
155 |
168 |
221 |
244 |
05 |
6 |
20 |
86 |
92 |
129 |
139 |
156 |
169 |
222 |
245 |
06 |
7 |
21 |
81 |
93 |
130 |
140 |
157 |
170 |
223 |
246 |
07 |
8 |
22 |
82 |
94 |
131 |
141 |
158 |
171 |
224 |
247 |
08 |
9 |
23 |
83 |
95 |
132 |
142 |
159 |
172 |
225 |
248 |
09 |
10 |
24 |
84 |
96 |
133 |
143 |
160 |
173 |
226 |
249 |
10 |
11 |
25 |
85 |
97 |
124 |
144 |
161 |
174 |
227 |
250 |
11 |
12 |
26 |
86 |
98 |
125 |
145 |
162 |
175 |
228 |
251 |
12 |
13 |
27 |
81 |
99 |
126 |
146 |
163 |
176 |
229 |
252 |
13 |
14 |
28 |
82 |
100 |
127 |
147 |
151 |
177 |
230 |
253 |
14 |
1 |
29 |
83 |
101 |
128 |
148 |
152 |
178 |
231 |
254 |
15 |
2 |
30 |
84 |
102 |
129 |
149 |
153 |
179 |
232 |
255 |
16 |
3 |
31 |
85 |
103 |
130 |
150 |
154 |
180 |
233 |
256 |
17 |
4 |
32 |
86 |
104 |
131 |
134 |
155 |
181 |
234 |
257 |
18 |
5 |
33 |
81 |
105 |
132 |
135 |
156 |
182 |
235 |
258 |
19 |
6 |
34 |
82 |
106 |
133 |
136 |
157 |
183 |
236 |
259 |
20 |
7 |
35 |
83 |
107 |
124 |
137 |
158 |
184 |
237 |
260 |
21 |
8 |
36 |
84 |
108 |
125 |
138 |
159 |
185 |
238 |
261 |
22 |
9 |
37 |
85 |
109 |
126 |
139 |
160 |
186 |
239 |
262 |
23 |
10 |
38 |
86 |
110 |
127 |
140 |
161 |
187 |
217 |
263 |
24 |
11 |
39 |
81 |
111 |
128 |
141 |
162 |
188 |
218 |
264 |
25 |
12 |
40 |
82 |
112 |
129 |
142 |
163 |
189 |
219 |
265 |
26 |
13 |
41 |
83 |
113 |
130 |
143 |
151 |
190 |
220 |
266 |
27 |
14 |
42 |
84 |
114 |
131 |
144 |
152 |
191 |
221 |
267 |
28 |
1 |
43 |
85 |
115 |
132 |
145 |
153 |
192 |
222 |
268 |
29 |
2 |
44 |
86 |
116 |
133 |
146 |
154 |
193 |
223 |
269 |
30 |
3 |
45 |
81 |
117 |
124 |
147 |
155 |
194 |
224 |
270 |
31 |
4 |
46 |
82 |
118 |
125 |
148 |
156 |
195 |
225 |
271 |
32 |
5 |
47 |
83 |
119 |
126 |
149 |
157 |
196 |
226 |
272 |
33 |
6 |
48 |
84 |
120 |
127 |
150 |
158 |
197 |
227 |
273 |
34 |
7 |
49 |
85 |
121 |
128 |
134 |
159 |
198 |
228 |
274 |
35 |
8 |
50 |
86 |
122 |
129 |
135 |
160 |
199 |
229 |
275 |
36 |
9 |
51 |
81 |
123 |
130 |
136 |
161 |
200 |
230 |
276 |
37 |
10 |
52 |
82 |
87 |
131 |
137 |
162 |
201 |
231 |
277 |
38 |
11 |
53 |
83 |
88 |
132 |
138 |
163 |
202 |
232 |
278 |
39 |
12 |
54 |
84 |
89 |
133 |
139 |
151 |
203 |
233 |
279 |
40 |
13 |
55 |
85 |
90 |
124 |
140 |
152 |
204 |
234 |
280 |
41 |
14 |
56 |
86 |
91 |
125 |
141 |
153 |
205 |
235 |
281 |
42 |
1 |
57 |
81 |
92 |
126 |
142 |
154 |
206 |
236 |
282 |
43 |
2 |
58 |
82 |
93 |
127 |
143 |
155 |
207 |
237 |
283 |
44 |
3 |
59 |
83 |
94 |
128 |
144 |
156 |
208 |
238 |
284 |
45 |
4 |
60 |
84 |
95 |
129 |
145 |
157 |
209 |
239 |
285 |
46 |
5 |
61 |
85 |
96 |
130 |
146 |
158 |
210 |
217 |
286 |
47 |
6 |
62 |
86 |
97 |
131 |
147 |
159 |
211 |
218 |
287 |
48 |
7 |
63 |
81 |
98 |
132 |
148 |
160 |
212 |
219 |
288 |
49 |
8 |
64 |
82 |
99 |
133 |
149 |
161 |
213 |
220 |
289 |
50 |
9 |
65 |
83 |
100 |
124 |
150 |
162 |
214 |
221 |
290 |
51 |
10 |
66 |
84 |
101 |
125 |
134 |
163 |
215 |
222 |
291 |
52 |
11 |
67 |
85 |
102 |
126 |
135 |
151 |
216 |
223 |
292 |
53 |
12 |
68 |
86 |
103 |
127 |
136 |
152 |
164 |
224 |
293 |
54 |
13 |
69 |
81 |
104 |
128 |
137 |
153 |
165 |
225 |
240 |
55 |
14 |
70 |
82 |
105 |
129 |
138 |
154 |
166 |
226 |
241 |
56 |
1 |
71 |
83 |
106 |
130 |
139 |
155 |
167 |
227 |
242 |
57 |
2 |
72 |
84 |
107 |
131 |
140 |
156 |
168 |
228 |
243 |
58 |
3 |
73 |
85 |
108 |
132 |
141 |
157 |
169 |
229 |
244 |
59 |
4 |
74 |
86 |
109 |
133 |
142 |
158 |
170 |
230 |
245 |
60 |
5 |
75 |
81 |
110 |
124 |
143 |
159 |
171 |
231 |
246 |
61 |
6 |
76 |
82 |
111 |
125 |
144 |
160 |
172 |
232 |
247 |
62 |
7 |
77 |
83 |
112 |
126 |
145 |
161 |
173 |
233 |
248 |
63 |
8 |
78 |
84 |
113 |
127 |
146 |
162 |
174 |
234 |
249 |
64 |
9 |
79 |
85 |
114 |
128 |
147 |
163 |
175 |
235 |
250 |
65 |
10 |
80 |
86 |
115 |
129 |
148 |
151 |
176 |
236 |
251 |
66 |
11 |
15 |
81 |
116 |
130 |
149 |
152 |
177 |
237 |
252 |
67 |
12 |
16 |
82 |
117 |
131 |
150 |
153 |
178 |
238 |
253 |
68 |
13 |
17 |
83 |
118 |
132 |
134 |
154 |
179 |
239 |
254 |
69 |
14 |
18 |
84 |
119 |
133 |
135 |
155 |
180 |
217 |
255 |
70 |
1 |
19 |
85 |
120 |
124 |
136 |
156 |
181 |
218 |
256 |
71 |
2 |
20 |
86 |
121 |
125 |
137 |
157 |
182 |
219 |
257 |
72 |
3 |
21 |
81 |
122 |
126 |
138 |
158 |
183 |
220 |
258 |
73 |
4 |
22 |
82 |
123 |
127 |
139 |
159 |
184 |
221 |
259 |
74 |
5 |
23 |
83 |
87 |
128 |
140 |
160 |
185 |
222 |
260 |
75 |
6 |
24 |
84 |
88 |
129 |
141 |
161 |
186 |
223 |
261 |
76 |
7 |
25 |
85 |
89 |
130 |
142 |
162 |
187 |
224 |
262 |
77 |
8 |
26 |
86 |
90 |
131 |
143 |
163 |
188 |
225 |
263 |
78 |
9 |
27 |
81 |
91 |
132 |
144 |
151 |
189 |
226 |
264 |
79 |
10 |
28 |
82 |
92 |
133 |
145 |
152 |
190 |
227 |
265 |
80 |
11 |
29 |
83 |
93 |
124 |
146 |
153 |
191 |
228 |
266 |
81 |
12 |
30 |
84 |
94 |
125 |
147 |
154 |
192 |
229 |
267 |
82 |
13 |
31 |
85 |
95 |
126 |
148 |
155 |
193 |
230 |
268 |
83 |
14 |
32 |
86 |
96 |
127 |
149 |
156 |
194 |
231 |
269 |
84 |
1 |
33 |
81 |
97 |
128 |
150 |
157 |
195 |
232 |
270 |
85 |
2 |
34 |
82 |
98 |
129 |
134 |
158 |
196 |
233 |
271 |
86 |
3 |
35 |
83 |
99 |
130 |
135 |
159 |
197 |
234 |
272 |
87 |
4 |
36 |
84 |
100 |
131 |
136 |
160 |
198 |
235 |
273 |
88 |
5 |
37 |
85 |
101 |
132 |
137 |
161 |
199 |
236 |
274 |
89 |
6 |
38 |
86 |
102 |
133 |
138 |
162 |
200 |
237 |
275 |
90 |
7 |
39 |
81 |
103 |
124 |
139 |
163 |
201 |
238 |
276 |
91 |
8 |
40 |
82 |
104 |
125 |
140 |
151 |
202 |
239 |
277 |
92 |
9 |
41 |
83 |
105 |
126 |
141 |
152 |
203 |
217 |
278 |
93 |
10 |
42 |
84 |
106 |
127 |
142 |
153 |
204 |
218 |
279 |
94 |
11 |
43 |
85 |
107 |
128 |
143 |
154 |
205 |
219 |
280 |
95 |
12 |
44 |
86 |
108 |
129 |
144 |
155 |
206 |
220 |
281 |
96 |
13 |
45 |
81 |
109 |
130 |
145 |
156 |
207 |
221 |
282 |
97 |
14 |
46 |
82 |
110 |
131 |
146 |
157 |
208 |
222 |
283 |
98 |
1 |
47 |
83 |
111 |
132 |
147 |
158 |
209 |
223 |
284 |
99 |
2 |
48 |
84 |
112 |
133 |
148 |
159 |
210 |
224 |
285 |
1 Химическая термодинамика
Химическая термодинамика является наукой об энергетических эффектах химических реакций, их направлении и равновесии. Изучает применение законов термодинамики к химическим и физико-химическим процессам.
Термодинамический метод полезен тем, что позволяет:
- установить взаимосвязь между параметрами равновесной системы, что дает возможность вычислить неизвестный параметр системы по другим известным параметрам;
- оценить величину изменения параметров системы при осуществлении какого-либо процесса в ней;
- определить параметры системы после перехода ее из одного состояния в другое термодинамическое состояние или из одного технологического режима в другой режим проведения процесса;
- определить принципиальную возможность протекания процесса в нужном направлении;
- оценить глубину протекания процесса в зависимости от условий.
При определении параметров простейших термодинамических процессов идеальных газов используйте формулы, приведенные в таблицах 1.1 и 1.2. Необходимо обратить особое внимание на правильное применение соответствующих размерностей параметров. Используйте следующие значения универсальной газовой постоянной: R = 8,31 Дж/(моль·К) = 1,98 кал/(моль·К) = 0,082(л·атм)/(моль·К).
Тепловой эффект реакций при стандартных условиях определяется по формуле:

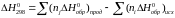 (1.1)
(1.1)
Соответствующие
значения
 компонентов приведены в таблице 1.4.
компонентов приведены в таблице 1.4.
При расчете тепловых эффектов при других температурах необходимо опираться на закон Кирхгофа и на вытекающее из него уравнение:
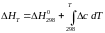 (интегральная
форма), (1.2)
(интегральная
форма), (1.2)
в котором Δс - разность суммы теплоемкостей продуктов и исходных реагентов:
 ,
(1.3)
,
(1.3)
где индекс i – стехиометрические коэффициенты соответствующих исходных реагентов; j – стехиометрические коэффициенты соответствующих продуктов реакции.
При этом можно сделать следующие допущения:
1. Δс = 0. Тогда ΔHT = ΔH0298.
2. Δc = const. Тогда Δc определяется по значениям теплоемкости компонентов реакционной системы при стандартных условиях (таблица 1.4) и значение ΔHT вычисляют по формуле:
 . (1.4)
. (1.4)
3.
 .
При этом допущении необходимо
учитывать температурную зависимость
теплоемкости компонентов реакционной
системы
.
При этом допущении необходимо
учитывать температурную зависимость
теплоемкости компонентов реакционной
системы
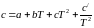 , (1.5)
, (1.5)
из которой следует
 ,
(1.6)
,
(1.6)
где
 .
Параметры
.
Параметры
 рассчитываются аналогичным образом.
Значения а,b, c,
c/
компонентов реакции приведены в таблице
1.4.
рассчитываются аналогичным образом.
Значения а,b, c,
c/
компонентов реакции приведены в таблице
1.4.
Изменение энтропии реакции при стандартных условиях определяются исходя из значений S0 (таблица 1.4) по формуле:
 . (1.7)
. (1.7)
При
определении
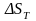 необходимо
учитывать температурную зависимость
теплоемкости компонентов от температуры:
необходимо
учитывать температурную зависимость
теплоемкости компонентов от температуры:
 . (1.8)
. (1.8)
Вычисление
 проводят по формуле:
проводят по формуле:
 . (1.9)
. (1.9)
Значение
 определяют по аналогичной формуле
определяют по аналогичной формуле
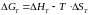 . (1.10)
. (1.10)
По
знаку величин
![]() и
и
![]() определяют возможное направление
протекания реакции при стандартных
условиях и при температуре Т.
определяют возможное направление
протекания реакции при стандартных
условиях и при температуре Т.
Если: G < 0 – самопроизвольное протекание химической реакции возможно;
G > 0 – самопроизвольное протекание химической реакции невозможно;
G = 0 – система находится в равновесии.
Таблица 1.1 Связь
между основными параметрами состояния
в изопроцессах и определение их функции
перехода для n молей
вещества (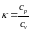 )
)
Процесс |
Уравнение процесса |
Связь между параметрами состояния |
Работа в процессе |
Количество теплоты, сообщенное в процессе |
Изобарный |
|
|
|
|
Изотерми- ческий |
|
|
|
|
Изохорный |
|
|
|
|
Адиабатный |
|
|
|
|
Таблица 1.2 Изменение функций состояния системы в изопроцессах (n - количество вещества, )
Процесс |
Изменение энтальпии |
Изменение внутренней энергии |
Изменение энтропии |
Молярная теплоемкость |
Изобарный |
ΔН=ΔU+W=Q |
ΔU=ncv(T2 – T1) |
|
|
Изотерми-ческий |
ΔН = 0 |
ΔU = 0 |
|
|
Изохорный |
ΔН= nсp(T2 –T1) |
ΔU= ncv(T2 – T1) |
|
|
Адиабатный |
|
|
|
сад = 0 |
Литература: [1], с. 12 – 69; [2], с. 8 – 49.