- •Следствия из закона:
- •Граничные поверхности подуровней
- •Правило Хунда. Это правило определяет последовательность заполнения орбиталей электронами в пределах одного подуровня.
- •Механизмы образования ковалентной связи:
- •Кристаллическая решётка — вспомогательный геометрический образ, вводимый для анализа строения кристалла. Выделяют 4 типа кристаллических решеток:
- •Скорость большинства реакций увеличивается при увеличении температуры (искл. Ферментативные реакции).
- •Понятие об активных молекулах:
- •Катализ:
- •Обратимые реакции - химические реакции, протекающие одновременно в двух противоположных направлениях, а необратимые- в одном напралении.
Особенно сильно возросла роль химии в современной технике, оперирующей энергиями огромной мощности, большая часть которых получается за счет энергии химических реакций окисления топлив, или за счет энергии ядерных превращений. В настоящее время роль химии в жизни общества неизмерима. Химические знания сейчас достигли такого уровня развития, что на их основе коренным образом меняются представления о природе и механизме ряда важнейших технологических процессов. Химия помогла нам открыть и использовать не только ранее неизвестные свойства веществ и материалов, но и создать новые, не существующие в природе вещества и материалы. В химической промышленности ведущее место занимает промышленность органического синтеза, базирующаяся на нефтегазовом сырье, или нефтехимия. Большую роль в отрасли играет выпуск химической продукции: топливо, масла, ароматические углеводороды, минеральные удобрения, кислоты, лаки, краски, автошины, химические волокна, полимеры и др. Необходимо отметить производство калийных удобрений, которое базируется на собственной сырьевой базе.
Закон сохранения массы веществ: масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции.
Закон сохранения энергии: энергия не возникает из ничего и не исчезает бесследно, но одни её виды могут превращаться в другие в строго эквивалентных количествах.
Закон постоянства состава (Пруст, 1799): каждое химическое соединение имеет постоянный качественный и количественный состав независимо от способа его получения.
Закон кратных отношений (Дальтон, 1803): если два элемента образуют между собой несколько соединений, то на одно и то же весовое количество одного элемента приходятся такие весовые количества другого элемента, которые относятся между собой как небольшие целые числа.
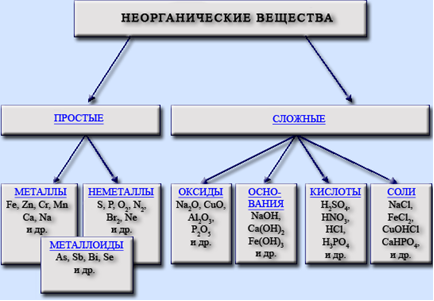
Основные классы неорганических соединений
Эквивалент - это реальная или условная частица вещества Х, которая в данной кислотно-основной реакции эквивалентна одному водороду или в данной окислительно-восстановительной реакции одному электрону.
Масса одного моля вещества называется его молярной массой. Молярную массу обычно выражают в граммах на моль (г/моль) или килограммах на моль (кг/моль). Так, М(СаСО3) = 100 г/моль = 0,1 кг/моль. Моль любого вещества содержит одно и тоже число структурных элементов независимо от его химических свойств и агрегатного состояния.
Фактор эквивалентности простых веществ можно определить через их валентность:
![]()
, где N(A) – число атомов в формуле простого вещества A.
Для кислот фактор эквивалентности определяется по их основности– числу ионов
в![]() одорода,
обменивающихся в данной реакции на
основные остатки.
одорода,
обменивающихся в данной реакции на
основные остатки.


Количественные соотношения между эквивалентами веществ, участвующих в химической реакции, задаются законом эквивалентов: числа эквивалентов всех веществ, участвующих в данной
реакции одинаковы.
Для реакции А+В=С+D согласно этому закону
 (А) =
(В)
=
(С)
=
(D)
т.е. вещества взаимодействуют и образуются
в количествах, которые равны количествам
веществ эквивалентов.
(А) =
(В)
=
(С)
=
(D)
т.е. вещества взаимодействуют и образуются
в количествах, которые равны количествам
веществ эквивалентов.
Закон Авогадро: в равных объёмах различных газов при одинаковых условиях (давлении и температуре) содержится равное число молекул.
Следствия из закона:
а) одинаковое число молекул различных газов при одинаковых давлении и температуре занимают одинаковый объем.
б) при нормальных условиях объем любого
газа, химическим количеством в 1 моль,
равен 22,4
 ,
такой объем называется молярным объемом
(
,
такой объем называется молярным объемом
( ).
).
в) массы одинаковых объёмов двух газов относятся как их молярные (относ. молекулярные) массы.
Число частиц в одном моле вещества в
настоящее время определено с большой
точностью — 6,0249•1023. В практических
расчетах его принимают равным 6,02•1023.
Это число называется Числом
Авогадро ( ).
).
Атом - это наименьшая частица химического элемента, способная к самостоятельному существованию и являющаяся носителем его свойств. Атом представляет собой электронейтральную микросистему, состоящую из положительно заряженного ядра и соответствующего числа электронов.
Молекула - это наименьшая частица вещества, определяющая его свойства. Состоит из атомов одного или различных химических элементов и существует как единая система атомных ядер и электронов. В случае одноатомных молекул (например, благородных газов) понятия атома и молекулы совпадают.
Химический элемент – вид атомов с одинаковым зарядом ядра.
Простые вещества - это вещества, состоящие из атомов одного и того же элемента. Сложные вещества состоят из атомов различных элементов.
Аллотропия – явление образования нескольких простых веществ одним химическим элементом. Каждое из этих простых веществ — аллотропное видоизменение (модификация) данного вещества.
Номенклату́ра ИЮПА́К — это система наименований химических соединений и описания науки химии в целом. Она развивается и поддерживается в актуальном состоянии Международным союзом теоретической и прикладной химии — ИЮПАК (IUPAC).
Атомной массой элемента называется масса его атома, выраженная в атомных единицах массы. Иными словами, атомная масса показывает, во сколько раз масса данного атома больше 1/12 массы атома 12С.
Молекулярной массой вещества называется масса молекулы, выраженная в атомных единицах массы.
Моль — это количество вещества, содержащее столько структурных единиц (атомов, молекул, ионов, электронов и др.), сколько их содержится в 12 г изотопа углерода-12.
Масса одного моля вещества называется его молярной массой. Молярную массу обычно выражают в граммах на моль (г/моль) или килограммах на моль (кг/моль).
Около 1900 г. Дж. Томсон предлагает первую модель атома, согласно которой положительный заряд равномерно заполняет весь объем атома, а отрицательный, представленный электронами, вкраплен в эту положительно заряженную сферу. Эта модель получила название «пудинг Томсона».
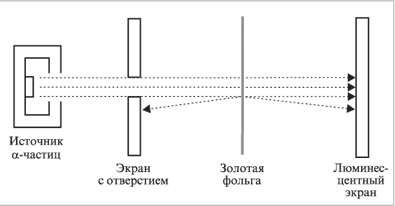 Ханс
Гейгер и Эрнест Марсден были
студентами Резерфорда. В 1910 г. они
проводили эксперименты, в которых
бомбардировали тонкие листы золотой
фольги пучком -частиц (ядер атомов
гелия). Толщина золотой фольги варьировалась
от 1000 до 10 000 атомов. В ходе эксперимента
было обнаружено, что подавляющее
большинство -частиц совершенно свободно
проходило через фольгу, причем некоторые
из них лишь незначительно отклонялись
от первоначального направления. Однако
примерно одна из 10 000–100 000 частиц резко
изменяла свое направление на
противоположное.
Ханс
Гейгер и Эрнест Марсден были
студентами Резерфорда. В 1910 г. они
проводили эксперименты, в которых
бомбардировали тонкие листы золотой
фольги пучком -частиц (ядер атомов
гелия). Толщина золотой фольги варьировалась
от 1000 до 10 000 атомов. В ходе эксперимента
было обнаружено, что подавляющее
большинство -частиц совершенно свободно
проходило через фольгу, причем некоторые
из них лишь незначительно отклонялись
от первоначального направления. Однако
примерно одна из 10 000–100 000 частиц резко
изменяла свое направление на
противоположное.
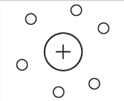 Это
наблюдение заставило Резерфорда
выдвинуть новую модель атома, согласно
которой положительно заряженное ядро
окружено электронами.
Это
наблюдение заставило Резерфорда
выдвинуть новую модель атома, согласно
которой положительно заряженное ядро
окружено электронами.
Планетарная модель атома, или модель Резерфорда - модель строения атома, которую предложил Эрнест Резерфорд в результате эксперимента с рассеиванием альфа-частиц. По этой модели атом состоит из небольшого положительно заряженного ядра, в котором сосредоточена почти вся масса атома, вокруг которого движутся электроны, - подобно тому, как планеты движутся вокруг Солнца. Он рассматривал атом как подобие Солнечной системы: в центре – ядро, содержащее основную массу и весь положительный заряд атома, а вокруг, по разным орбитам, вращаются электроны.
Достоинство: Планетарная модель атома соответствует современным представлениям о строении атома с учётом того, что движение электронов имеет квантовый характер и не описывается законами классической механики.
Недостатки: 1) В соответствии с уравнениями классической электродинамики заряженная частица, движущаяся с ускорением (а электрон в атоме движется с центростремительным ускорением), должна излучать энергию. При этом потеря энергии должна приводить к уменьшению радиуса орбиты и падению электрона на ядро.
2) Непрерывное изменение траектории электрона должно способствовать и непрерывному изменению частоты излучения и, следовательно, непрерывному спектру испускания. Но эксперименты показывали, что спектр испускания водорода, а также других атомов, находящихся в газообразном состоянии, состоит из нескольких полос, т. е. имеет дискретный характер.
В основу КММ (квантово-механической модели) положена квантовая теория атома, согласно которой электрон обладает как свойствами частицы, так и свойствами волны. Другими словами, о местоположении электрона в определенной точке можно судить не точно, а с определенной долей вероятности. Поэтому в КММ орбиты Бора заменили орбиталями (эдакие "электронные облака" - области пространства в которых существует вероятность пребывания электрона).
В 1900 г. Планк предположил, что излучение и поглощение энергии может происходить только строго определенными порциями, названными им квантами. Частота излучения связана с энергией уравнением:
![]()
где c – скорость света в вакууме равная
3*108 м/с. Поэтому частота этого излучения
зависит от разности между энергиями
уровней ( ).
В зависимости от длины волны
).
В зависимости от длины волны
 это излучение может относиться к
различным областям спектра: рентгеновской,
ультрафиолетовой, видимой или инфракрасной.
это излучение может относиться к
различным областям спектра: рентгеновской,
ультрафиолетовой, видимой или инфракрасной.
Г![]() ейзенберг
предложил соотношение, которое
получило название «соотношение
неопределенностей»:
ейзенберг
предложил соотношение, которое
получило название «соотношение
неопределенностей»:
где
 p
– неопределенность в значении импульса
частицы, а
x
– неопределенность в ее координатах.
Из этого соотношения следует, что чем
точнее определены координаты электрона,
тем с меньшей точностью будет определен
его импульс и наоборот. Иными словами,
говорить о траектории электрона не
имеет смысла, так как для описания
последней необходимо точно знать и
координаты электрона, и его импульс в
каждый момент времени (что было заложено
в модель атома Бора). Соотношение
неопределенностей показывает, что столь
точное описание движения такой маленькой
частицы, как электрон, невозможно, т. е.
само понятие орбита (траектория) электрона
оказывается несостоятельным.
p
– неопределенность в значении импульса
частицы, а
x
– неопределенность в ее координатах.
Из этого соотношения следует, что чем
точнее определены координаты электрона,
тем с меньшей точностью будет определен
его импульс и наоборот. Иными словами,
говорить о траектории электрона не
имеет смысла, так как для описания
последней необходимо точно знать и
координаты электрона, и его импульс в
каждый момент времени (что было заложено
в модель атома Бора). Соотношение
неопределенностей показывает, что столь
точное описание движения такой маленькой
частицы, как электрон, невозможно, т. е.
само понятие орбита (траектория) электрона
оказывается несостоятельным.
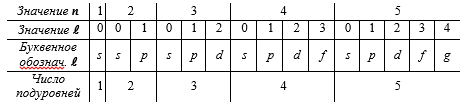
Поведение электрона в атоме описывается четырьмя квантовыми числами: главное (характеризует удаленность максимума электронной плотности от ядра), орбитальное (характеризует энергию электронов подуровня в пределах данного энергетического уровня), магнитное (характеризует ориентацию орбитали в пространстве) и спиновое (характеризует собственное вращение электрона вокруг своей оси).
Главное квантовое число n. Оно может принимать значения от 1 до бесконечности, которые определяют:
а) номер энергетического уровня (в теории Бора – номер орбиты);
б) интервал энергий электронов, находящихся на этом уровне;
в) размеры орбиталей (в теории Бора – радиусы орбит);
г) число подуровней данного энергетического уровня (первый уровень состоит из одного подуровня, второй – из двух, третий – из трех и т. д.).
д) в Периодической системе Д. И. Менделеева значению
Спиновое квантовое число
(спин электрона),
 :
В 1926 г. Уленбек и Голдсмит показали,
что помимо орбитального движения
электрон должен участвовать во вращении
вокруг собственной оси, проходящей
через центр. Поэтому электрон должен
иметь собственный момент импульса, а
так как он является заряженной частицей,
то и магнитный момент. Это представление
довольно примитивно, но используется
для наглядности, поэтому мы будем им
пользоваться. Возможны только два
направления вращения электрона вокруг
своей оси: по и против часовой стрелки.
Следовательно, спиновое квантовое число
принимает лишь два значения: +
:
В 1926 г. Уленбек и Голдсмит показали,
что помимо орбитального движения
электрон должен участвовать во вращении
вокруг собственной оси, проходящей
через центр. Поэтому электрон должен
иметь собственный момент импульса, а
так как он является заряженной частицей,
то и магнитный момент. Это представление
довольно примитивно, но используется
для наглядности, поэтому мы будем им
пользоваться. Возможны только два
направления вращения электрона вокруг
своей оси: по и против часовой стрелки.
Следовательно, спиновое квантовое число
принимает лишь два значения: + и -
и -
Энергетический уровень — собственные значения энергии квантовых систем, то есть систем, состоящих из микрочастиц (электронов, протонов и других элементарных частиц) и подчиняющихся законам квантовой механики. Каждый уровень характеризуется определённым состоянием системы, или подмножеством таковых в случае вырождения. Понятие применимо к атомам (электронные уровни), молекулам (различные уровни, соответствующие колебаниям и вращениям), атомным ядрам (внутриядерные энергетические уровни) и т. д. Каждому численному значению
 соответствует определенная геометрическая
форма орбиталей и приписывается
буквенное обозначение. Первые четыре
буквенныx обозначения имеют историческое
происхождение и связаны с характером
спектральных линий, соответствующих
электронным переходам между этими
подуровнями: s, p, d, f – первые буквы
английских слов, использованных для
названия спектральных линий sharp (резкий),
principal (главный), diffuse (диффузный),
fundamental (основной). Обозначения других
подуровней идут в алфавитном порядке:
g, h, ….
соответствует определенная геометрическая
форма орбиталей и приписывается
буквенное обозначение. Первые четыре
буквенныx обозначения имеют историческое
происхождение и связаны с характером
спектральных линий, соответствующих
электронным переходам между этими
подуровнями: s, p, d, f – первые буквы
английских слов, использованных для
названия спектральных линий sharp (резкий),
principal (главный), diffuse (диффузный),
fundamental (основной). Обозначения других
подуровней идут в алфавитном порядке:
g, h, ….
Любой подуровень определяется двумя квантовыми числами – главным (при записи обычно указывают численное значение) и орбитальным (при записи обычно используют буквенное обозначение).
Энергетический подуровень — совокупность орбиталей с одинаковыми значениями главного и орбитального квантовых чисел. Энергетический подуровень обозначается латинскими буквами: s, p, d, f и т. д.
Орбитальное или азимутальное квантовое число . Орбитальное квантовое число определяет момент количества движения (момент импульса) электрона, точное значение его энергии и форму орбиталей.
Н![]() овое
понятие «орбиталь» по звучанию напоминает
слово «орбита», но имеет совершенно
иной смысл. Орбиталь – это область
пространства, в которой вероятность
нахождения электрона имеет определенное
значение (90 – 95 %). Орбитальное квантовое
число зависит от главного квантового
числа и принимает следующие значения:
овое
понятие «орбиталь» по звучанию напоминает
слово «орбита», но имеет совершенно
иной смысл. Орбиталь – это область
пространства, в которой вероятность
нахождения электрона имеет определенное
значение (90 – 95 %). Орбитальное квантовое
число зависит от главного квантового
числа и принимает следующие значения:
Число подуровней, определяемых значением n