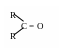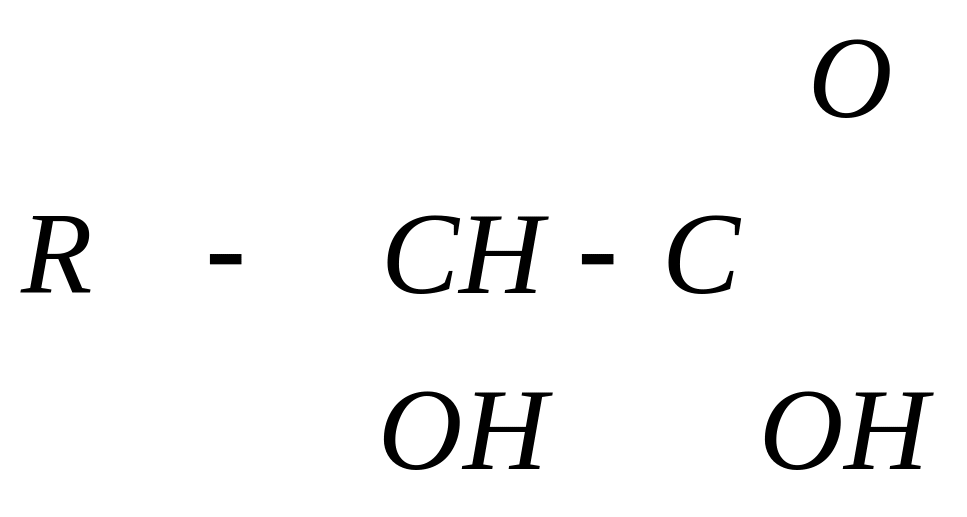Федеральное государственное образовательное учреждение
высшего профессионального образования
Ижевская государственная сельскохозяйственная академия
Факультет непрерывного профессионального образования
Органическая химия
Методические материалы для студентов специальности
271200 Технология продуктов общественного питания
Составитель:
доцент каф. химии,
к.т.н И.Ш.Шумилова
Ижевск
2010
Цель и задачи дисциплины
Целью дисциплины “Органическая химия” является познание общих законов, связывающих строение и свойства органических соединений, изучение путей синтеза и свойств органических соединений, а также их применения в пищевой промышленности, сельском хозяйстве, медицине и других областях народного хозяйства.
В результате изучения курса студент должен
Владеть теоретическими представлениями органической химии.
Иметь знания о составе, строении и свойствах органических веществ - представителей основных классов органических соединений (углеводородов; гомофункциональных соединений, гетерофункциональных соединений, гетероциклических соединений).
Иметь представление о белках и биологически активных веществах, структуре и свойствах важнейших типов биомолекул.
Владеть основами органического синтеза: уметь планировать и рассчитывать синтез органических соединений, исходя из строения и свойств; уметь идентифицировать и исследовать органические вещества; иметь представление о токсичности органических веществ и навыки безопасной работы с ними.
Знать и уметь применять основные законы, связывающие строение и свойства органических соединений.
Знать основные современные методы исследования строения и свойств органических соединений.
Знать применение органических веществ в пищевой промышленности, сельском хозяйстве, медицине и других областях народного хозяйства.
Методические указания по выполнению контрольной работы
В соответствии с учебным планом изучения данной дисциплины студенты выполняют контрольную работу, которая является обязательной частью учебного процесса и без успешного написания которой они не допускаются к экзамену.
Рекомендации по оформлению контрольной работы:
- четко оформите титульный лист, укажите номер зачетной книжки
- задания оформите в следующем порядке: номер задачи, текст задачи, краткое условие задачи, решение, ответ
- текст, формулы, пояснения к задачам напишите разборчиво или отпечатайте (интервал между строчками 1 клетка)
- страницы нумеруйте, оставляя поля
- в конце работы укажите список использованных информационных источников
Контрольная работа представляется на проверку в академию в сроки, установленные учебным планом. Допущенные к защите работы остаются у преподавателя или хранятся в деканате, а незачтенные возвращаются студенту на доработку. Качество выполнения контрольной работы учитывается при сдаче экзамена по дисциплине.
Задание 1. Определите класс(ы) органических соединений, к которому(ым) относится вещество с данной эмпирической формулой;
- постройте структурную формулу, дайте название
- постройте и назовите изомеры (если таковые имеются)
№ задачи |
Эмпирическая формула соединений |
№ задачи |
Эмпирическая формула соединений |
№ задачи |
Эмпирическая формула соединений |
1.1 |
С5Н8; С6Н13О2N |
1.11 |
С8Н18; C6H5N |
1.21 |
С2Н3Cl; С6Н12 |
1.2 |
С6Н12; С4Н8О2 |
1.12 |
С5Н10О; СН4О |
1.22 |
С9Н12; С4Н8О2 |
1.3 |
С6Н3; С2Н3Cl |
1.13 |
С6Н6О; С3Н9N |
1.23 |
C3H6; С4Н8О |
1.4 |
С3Н7NO2; С5Н11Cl |
1.14 |
С5Н8; С4Н8О2 |
1.24 |
С4Н6; С3Н5О2Na |
1.5 |
С6Н14О6; (СН3)3N |
1.15 |
С3Н9N; NC3H7O2 |
1.25 |
С4Н10О; С6Н6 |
1.6 |
СН2О; С6Н12О6 |
1.16 |
С6Н3; СН2О |
1.26 |
С4Н8; С6Н5ОН |
1.7 |
С2Н7ОN; С6Н6 |
1.17 |
С8Н10; С2Н3О2Na; |
1.27 |
С12Н22О11; С3Н6 |
1.8 |
С2Н6О; С12Н22О11 |
1.18 |
С6Н4N3O6; C4H8O2 |
1.28 |
С6Н12О6; С3Н6Сl2 |
1.9 |
С6Н4N3O6; С6Н5Вr |
1.19 |
С9Н12; С4Н6Cl |
1.29 |
С2Н5NO2 ; С8Н18 |
1.10 |
С2Н3О2К; С5Н10 |
1.20 |
С5Н11Br; С6Н12 |
1.30 |
С4Н8О2; С6Н12Сl2 |
Задание 2. Охарактеризуйте ниже приведенные вещества по плану:
- определение класса,
- строение, получение
- химические свойства
- роль в жизнедеятельности человека
№ задачи |
Вещество |
№ задачи |
Вещество |
№ задачи |
Вещество |
2.1 |
Лактоза |
2.11 |
Уксусная кислота |
2.21 |
Сорбиновая кислота |
2.2 |
Валин |
2.12 |
Метан |
2.22 |
Ксилоза |
2.3 |
Крахмал |
2.13 |
Щавелевая кислота |
2.23 |
Пропен |
2.4 |
Этанол |
2.14 |
Уксусный альдегид |
2.24 |
Рибоза |
2.5 |
Бензол |
2.15 |
Глюкоза |
2.25 |
Ацетилен |
2.6 |
Анилин |
2.16 |
Масляная кислота |
2.26 |
Глицерин |
2.7 |
Мочевина |
2.17 |
Сахароза |
2.27 |
Молочная кислота |
2.8 |
Глицин |
2.18 |
Яблочная кислота |
2.28 |
Стеарат натрия |
2.9 |
Фенол |
2.19 |
Бензойная кислота |
2.29 |
Фруктоза |
2.10 |
Этилен |
2.20 |
Ацетон |
2.30 |
Целлюлоза |
Задание 3. Охарактеризуйте класс органических веществ (название класса, общая формула, гомологический ряд, номенклатура, изомерия, строение, получение, химические свойства)
№ задачи |
Функциональная группа |
№ задачи |
Функциональная группа |
3.1 |
|
3.16 |
|
3.2 |
> |
3.17 |
- С = С – С = С - |
3.3 |
- С С - |
3.18 |
R – O – R/ |
3.4
|
|
3.19 |
|
3.5 |
C C H2 – O – COOR/ CH2 – O –COOR// |
3.20 |
О R-
C
OH
|
3.6 |
R - SH |
3.21 |
R - OH |
3.7 |
|
3.22 |
|
3.8 |
R – NO2 |
3.23 |
R – SO2OH |
3.9 |
R - NO |
3.24 |
R – (OH)n |
3.10 |
|
3.25 |
|
3.11 |
(-СН2 – СН2- )n |
3.26 |
R – CH =CH – C =O R/ |
3.12 |
R – C = O Hal |
3.27 |
О О R – C – O – C – R/ |
3.13 |
|
3.28 |
|
3.14 |
R – NH2 |
3.29 |
R - OH |
3.15 |
НООС- R - СООН |
3.30 |
R- Hal |
Задание 4. Напишите уравнения реакций, характеризующие химические свойства ниже приведенных веществ, укажите условия протекания данных реакций и назовите продукты реакции
№ задачи |
вещества |
№ задачи |
вещества |
4.1 |
Ацетилен, ацетон; |
4.16 |
формальдегид, бутадиен -1,3 |
4.2 |
бутин, манноза |
4.17 |
бутанол, янтарная кислота |
4.3 |
Масляная кислота, ксилол |
4.18 |
фениламин, пентин |
4.4 |
аллиловой спирт; мальтоза |
4.19 |
сахароза, щавелевая кислота |
4.5 |
Этанол, крезол |
4.20 |
Масляная кислота; лизин |
4.6 |
пропанол -2 ; пропен |
4.21 |
ацетальдегид; пентанон |
4.7 |
бензол; лактоза |
4.22 |
этиламин; гексин-3 |
4.8 |
пропионовая кислота; фенол |
4.23 |
Анилин; метанол |
4.9 |
глицерин; лейцин |
4.24 |
метиламин; толуол |
4.10 |
пропанол; пентин |
4.25 |
Бутиламин, уксусный ангидрид |
4.11 |
Бутен, масляный альдегид |
4.26 |
Изобутилен, пропаналь |
4.12 |
муравьиная кислота, валин |
4.27 |
пропин; глюкоза |
4.13 |
Йодистый этил, пентен |
4.28 |
Манноза; бутаналь |
4.14 |
уксусная кислоты, бутан |
4.29 |
Лактоза ; 2,2-дибромбутан |
4.15 |
олеиновая кислота, гексин |
4.30 |
валин; валерьяновый альдегид |
Задание 5. Составьте уравнения качественных реакций на предложенные вещества
№ задачи |
Вещество |
№ задачи |
Вещество |
№ задачи |
Вещество |
5.1 |
Фенол |
5.11 |
Глицин |
5.21 |
Масляная кислота |
5.2 |
Уксусная кислота |
5.12 |
Ацетоуксусный эфир |
5.22 |
Изопропиловый спирт |
5.3 |
Этанол |
5.13 |
Пропен |
5.23 |
Лизин |
5.4 |
Глицерин |
5.14 |
Формальдегид |
5.24 |
Бутин |
5.5 |
Этиламин |
5.15 |
Пропанол |
5.25 |
Фруктоза |
5.6 |
Этилен |
5.16 |
Крахмал |
5.26 |
Бензол |
5.7 |
Глюкоза |
5.17 |
Пропиламин |
5.27 |
Бутанол |
5.8 |
Ацетилен |
5.18 |
Пентоза |
5.28 |
Щавелевая кислота |
5.9 |
Бутадиен |
5.19 |
Метан |
5.29 |
Ацетальдегид |
5.10 |
Бутиламин |
5.20 |
Белки |
5.30 |
Этиленгликоль |
Задание 6. Предложите схемы синтеза следующих веществ: напишите уравнения реакций, назовите образующиеся соединения, укажите условия протекания реакций.
№ задачи |
Вещества |
№ задачи |
Вещества |
6.1 |
Октина-2 из ацетилена |
6.16 |
Пентина-2 из пентанола-1 |
6.2 |
Ацетальдегида из бутанола-2 |
6.17 |
Аллилового спирта из пропилена |
6.3 |
Бутанона-2 из 1-бромбутана |
6.18 |
2,2-дихлорпропана из ацетилена |
6.4 |
Изопрена из 3-метилбутанола-1 |
6.19 |
Этилбензола из этилена |
6.5 |
2-бромэтанола-1 из бромистого этила |
6.20 |
Пропилбензола из бензола и пропилового спирта |
6.6 |
Полистирола из бензола и этилена |
6.21 |
Циклопропана из пропилена |
6.7 |
Циклогексена из этанола |
6.22 |
Пентина-2 из пентанона-2 |
6.8 |
1,2-дибромпентана из пентанола-1 |
6.23 |
Бутаналя из бутена-1 |
6.9 |
Гептина-1 из ацетилена |
6.24 |
Пентина-1 из ацетилена |
6.10 |
Янтарной кислоты из этиленгликоля |
6.25 |
Изовалериановой кислоты из ацетона |
6.11 |
Щавелевой кислоты из бензола |
6.26 |
Дифенилового эфира из бензола |
6.12 |
1,2-дибромпропана из пропанола-2 |
6.27 |
Масляной кислоты из пропанола-1 |
6.13 |
Бутандиола -1,3 из этанола |
6.28 |
Этилацетата из этанола |
6.14 |
Бутаналя из этанола |
6.29 |
Этиламина из бромистого пропила |
6.15 |
1,4-дибромбутена-2 из ацетилена |
6.30 |
Щавелевой кислоты из этилена |
Задание 7. Как различить следующие вещества. Напишите уравнения реакций
№ задачи |
Вещества |
№ задачи |
Вещества |
7.1 |
Олеиновую и лауриновую кислоты |
7.16 |
Глюкозу и крахмал |
7.2 |
Глюкозу и сахарозу |
7.17 |
Циклогексанол и циклогексен |
7.3 |
Гексанол и фенол |
7.18 |
Первичные и вторичные спирты |
7.4 |
D-глюкозу и D-галактозу |
7.19 |
Малеиновую и фумаровую кислоты |
7.5 |
Метиламин и фениламин |
7.20 |
Бутен и бутин |
7.6 |
D-глюкозу и D-сорбит |
7.21 |
Сахарозу и мальтозу |
7.7 |
п-крезол и бензиловый спирт |
7.22 |
Первичные и вторичные амины |
7.8 |
Пентозы и гексозы |
7.23 |
Аллиловый спирт и глицерин |
7.9 |
Фенол и циклогексен |
7.24 |
Щавелевую и уксусную кислоты |
7.10 |
Ацетальдегид и ацетон |
7.25 |
Бензол и циклогексан |
7.11 |
Бутан и бутен |
7.26 |
Сахарозу и крахмал |
7.12 |
Аллиловый спирт и пропиловый спирт |
7.27 |
Стеариновую и линолевую кислоты |
7.13 |
Этилацетат и ацетоуксусный эфир |
7.28 |
Толуол и фенол |
7.14 |
Восстанавливающие и невосстанавливающие олигосахариды |
7.29 |
Одноатомные и многоатомные спирты |
7.15 |
Глицерин и пропиловый спирт |
7.30 |
Щавелевую и янтарную кислоты |
Задание 8. Предложите схемы получения органических веществ из неорганических: напишите уравнения реакций, назовите образующиеся соединения, укажите условия протекания реакций.
№ задачи |
Вещества |
№ задачи |
Вещества |
8.1 |
п-крезол из карбоната кальция |
8.16 |
Акрилонитрил из углерода |
8.2 |
Поливинилацетат из карбида кальция |
8.17 |
Этиловый эфир аминоуксусной кислоты из углерода |
8.3 |
Этилацетат из углерода |
8.18 |
Глицин из углерода |
8.4 |
Винилацетат из карбида кальция |
8.19 |
Молочная кислоту из углерода |
8.5 |
Янтарная кислота из углерода |
8.20 |
Анилин из оксида кальция |
8.6 |
Глицерин из углерода |
8.21 |
Этилат натрия из оксида алюминия |
8.7 |
Муравьиная кислота из карбоната кальция |
8.22 |
Фенолформальдегидные смолы из карбида кальция |
8.8 |
Полиэтилен из оксида алюминия |
8.23 |
Фенол из карбоната кальция |
8.9 |
Триброманилин из карбоната кальция |
8.24 |
Акрилонитрил из карбоната кальция |
8.10 |
Этилмеркаптан из углерода |
8.25 |
Бутанол из оксида алюминия |
8.11 |
Толуол из карбида алюминия |
8.26 |
о-крезол из карбида кальция |
8.12 |
Диэтиловый эфир из углерода |
8.27 |
Хлоропрен из карбоната кальция |
8.13 |
Аланин из карбида алюминия |
8.28 |
Этилацетат из углерода |
8.14 |
Винилацетат из оксида кальция |
8.29 |
Циклогексен из карбида алюминия |
8.15 |
Бутанон из оксида алюминия |
8.30 |
Сульфат фениламмония углерода |
Задание 9. Ответьте на вопрос, ответ обоснуйте
9.1 Какое из соединений – фенол или тимол (2-изопропил-5-метилфенол) является более сильной кислотой и почему?
9.2 В чем сходство изомеров и таутомеров? Почему кислоты и основания ускоряют взаимные превращения таутомеров?
9.3 В каких реакциях проявляется сходство между группами >C=O; >C=S; >C=NR; -C N ? Объясните причину этого сходства.
9.4 Охарактеризуйте полярность и поляризуемость связей С – Н; С - Cl; C - Br; C - I. почему йодистые алкилы обладают наибольшей реакционной способностью?
9.5 Учитывая, что преобладающей кислотой триацилглицеридов оливкового масла является олеиновая кислота, а подсолнечного – линоленовая, определите, какое из масел в большей степени будет подвергаться окислению при длительном хранении?
9.6 Объясните понятия конформация и конфигурация на примере 1-хлор-1-бромэтана.
9.7 Объясните, почему при восстановлении D-глюкозы боргидридом натрия образуется один шестиатомный спирт D-глюцит (сорбит), а при восстановлении D-фруктозы – два спирта – D-глюцит и D- маннит.
9.8 Что называется константой основности амина КВ? Как влияют электронные эффекты радикалов и пространственные факторы на основность аминов?
9.9 Расположите в ряд по убыванию кислотности фенол; 2-этилфенол; 2,4-динитрофенол. Какова будет относительная реакционная способность этих веществ в реакциях электрофильного замещения по ароматическому кольцу?
9.10 Объясните изменение реакционной способности в реакциях электрофильного присоединения в рядах: а) этилен< пропилен < 1,1-диметилэтилен
б) хлор > бром > йод
9.11 Почему амиды кислот более слабые основания, чем амины?
9.12 От чего зависит способность карбонильного углерода к присоединению нуклеофильных реагентов? Расположите в ряд по убыванию способности к такому присоединению следующие группы: - СНО; - СООН; - СОО -; -СОNH2; -СООСН3; -СОСН3; - СОCl.
9.13 Объясните, почему скорость нитрования по SE концентрированной азотной кислотой резко падает при добавлении солей азотной кислоты (например, NaNO3) и увеличивается при добавлении концентрированной серной кислоты?
9.14 Расположите соединения в порядке уменьшения их кислотных свойств: третбутиловый спирт; бутиловый спирт; трис-(трихлорметил)метанол.
9.15 Расположите ароматические соединения в ряд по уменьшению реакционной способности в реакциях нитрования и укажите продукты реакции: нитрование этилбензола; бензойной кислоты; м-этилтолуола.
9.16 Расположите в ряд по легкости дегидратации следующие спирты: 4-метилпентанол-1; 3-метилбутанол-2; 2метилпентанол-2
9.17 Что такое мутаротация? Растворы гликозидов подвержены мутаротации в водной кислоте. Объясните это явление.
9.18 Карбонильные соединения с водой образуют гидраты. Какой гидрат устойчивее: уксусного или трихлоруксусного альдегида. Почему?
9.19 В четырех пробирках находятся: аллиловый спирт; пропиловый спирт; глицерин и о–крезол. Как идентифицировать каждое из веществ?
9.20 Расположите соединения в ряд по возрастанию их кислотных свойств: акриловая кислота; пропионовая кислота; п-нитробензойная кислота; винилуксусная кислота.
9.21 Какое из перечисленных веществ образует магнийорганическое соединение с наибольшим выходом: бромистый бутил; йодистый третбутил или бромистый изопропил?
9.22 Почему полиэтилен плавится при более низкой температуре, чем найлон?
9.23 Расположите соединения в порядке уменьшения их кислотных свойств: м-нитрофенол; фенол; п-крезол; 2,4,6-тринитрофенол.
9.24 Карбонильные соединения с водой образуют гидраты. Какой гидрат устойчивее: пропионового альдегида или метилглиоксаля? Почему?
9.25 С помощью электронных эффектов (индукционного и мезомерного) опишите взаимное влияние функциональных групп в следующих соединениях: ОСН-СООН; ОСН-СН2 – СООН; СН3–СО–СН2-СН2– СООН; СН3–СО–СН2– СООН
9.26 Расположите ароматические соединения в ряд по уменьшению реакционной способности в реакциях сульфирования и укажите продукты реакции: сульфирование этилбензола; фенола; нитробензола; бромбензола; п-ксилола.
9.27 Наиболее удобным методом синтеза вторичных спиртов является реакция альдегидов с реактивами Гриньяра. Почему при получении высоких выходов продуктов магнийорганического синтеза реакции проводят со свежеприготовленными реактивами Гриньяра, с перегнанными реагентами, в среде сухих растворителей, в атмосфере чистого инертного газа?
9.28 Каким образом можно отличить растительное масло (подсолнечное, льняное) от минеральных (машинного, солярового)?
9.29 Как объяснить факт, что температура кипения спиртов значительно выше, чем у галогеналканов с тем же углеводородным радикалом? Почему температура кипения этиленгликоля выше, чем у пропилового и изопропилового спиртов, хотя все три вещества имеют одинаковую молекулярную массу.
9.30 Расположите ароматические соединения в ряд по уменьшению реакционной способности в реакциях бромирования и укажите продукты реакции: бромирование бензола; м-ксилола; м-динитробензола; п-нитроизопропилбензола
Задание 10. Определите молекулярную формулу вещества по приведенным ниже данным.
№ задачи |
Исходные данные |
10.1 |
52,1% С; 13,1% Н; 34,8 % О; DH =23 |
10.2 |
92,2% С; 7,8% Н; DH =39 |
10.3 |
85,71% С; 14,29% Н; DH =21 |
10.4 |
29,8% С; 6,3% Н; 44,0 % Cl; М = 80,5 |
10.5 |
78,6% С; 8,4% Н; 12,92 % N; М=107 |
10.6 |
32,0% С; 4,0% Н; молекула содержит кислород; М=150 |
10.7 |
85,71% С; 14,29% Н; DH = 28, вещество обесцвечивает бромную воду и перманганат калия |
10.8 |
40,0% С; 6,67% Н; Dпо воздуху ≈ 1 |
10.9 |
20,0% С; 6,67% Н; 46,67 % N; остальное – кислород, М = 60 |
10.10 |
79,2% С; 5,5% Н; остальное - кислород; DH =53 |
10.11 |
48,7% С; 13,6% Н; 37,8 % N; M = 74 |
10.12 |
25,2% С; 2,8% Н; 49,6 % Cl; остальное – кислород, М = 143 |
10.13 |
67,9% С; 5,7% Н; 26,4 % N; М = 106 |
10.14 |
46,38% С; 5,9% Н; 27,01 % N; остальное – кислород, М = 155 |
10.15 |
Пенициллин G : 57,45% С; 5,4% Н; 8,45 % N; 9,61% S |
10.16 |
Витамин РР: 59,10% С; 4,92% Н; 22,91% N; остальное – кислород |
10.17 |
8,0% С; 92,0 % Cl; Dпо воздуху =5, 24 |
10.18 |
85,70% С; 14,30% Н; DH =21 |
10.19 |
80,0% С; 20,0% Н; DH =15 |
10.20 |
54,55% С; 9,09% Н; 36,36 % О; DH =22, вещество восстанавливает оксид серебра в аммиачном растворе, образуя кислоту. |
10.21 |
Первичный амин: 38,7% С; 16,15% Н; остальное азот. |
10.22 |
Одноосновная кислота: 26,1% С; 4,35% Н; 69,55 % О |
10.23 |
При сжигании 1,4г вещества получено 4,4г оксида углерода (IV) и 1,8г воды. DH = 28. Выведите формулу вещества. |
10.24 |
При сгорании 2,3г вещества образовалось 4,4г оксида углерода (IV) и 2,7 воды. Dпо воздуху = 1,59. Выведите формулу вещества |
10.25 |
52,0% С; 13,0% Н; остальное кислород, DH =23 |
10.26 |
При взаимодействии 0,32г предельного спирта с металлическим натрием выделилось 112мл водорода. Выведите структурную формулу спирта. |
10.27 |
При сгорании 4,8г вещества получено 6,6г оксида углерода (IV) и 5,4г воды. DH =16. Выведите формулу. |
10.28 |
Папаверин: 70,8% С; 4,1% Н; 4,1 % N; остальное – кислород |
10.29 |
При сжигании 29г вещества получено 44,8л оксида углерода (IV) и 45г воды. Dпо воздуху = 2. Выведите формулу вещества. |
10.30 |
Индиго (краситель): 73,3% С; 3,8% Н; 10,7% N; остальное - кислород. М = 262 |
Задание 11. Определить мольную долю компонентов в смеси по приведенным ниже данным.
11.1 При хлорировании метана объемом 17,92л (н.у.) получена смесь хлорметана и дихлорметана общей массой 61,1г. метан израсходован полностью. Определите мольную долю хлорметана (в%) в полученной смеси.
11.2 Для нейтрализации смеси фенола и уксусной кислоты потребовалось 23,4 мл 20%-ного раствора гидрооксида калия (плотность 1,2 г/мл). При взаимодействии исходной смеси с бромной водой образовалось 16,55 г осадка. Каков состав исходной смеси ( %).
11.3 При взаимодействии ацетилена объемом 3,36 л (н.у) с хлороводородом получена смесь винилхлорида (хлорэтена) и дихлорэтана общей массой 12,66 г. ацетилен израсходован полностью. Определите мольную долю винилхлорида (%) в полученной смеси.
11.4 При хлорировании этана объемом 16,8 л (н.у) получена смесь хлорэтана и дихлорэтанов общей массой 53,55 г. Этан израсходован полностью. Определите мольную долю хлорэтана (%) в полученной смеси
11.5 Смесь этана и этилена объемом 33,6 л подвергли гидрированию. При этом получили продукт массой 15 г. Какова объемная доля этилена в исходной смеси.
11.6 Для нейтрализации смеси фенола и уксусной кислоты израсходовано 23,4 мл раствора гидрооксида калия (ω = 40%; ρ = 1,2г/см3). При действии на исходную смесь азотной кислоты массой 18,9г образовался 2,4,6 – тринитрофенол. Вычислите массовую долю (%) уксусной кислоты в смеси.
11.7 Через смесь бензола, фенола и анилина массой 20г пропустили хлороводород. При этом выпал осадок массой 2,59г. при нейтрализации такой же массы смеси затрачен раствор гидрооксида натрия массой 10г (ω = 20%). Какова массовая доля (%) бензола в смеси?
11.8 На смесь массой 10г содержащую анилин, аминоуксусную и уксусную кислоты подействовали бромной водой массой 20г с массовой долей брома 2%. При этом выпал осадок массой 1,1г. при действии на такую же массу смеси израсходован хлороводород объемом 2,247 л (н.у). Какова массовая доля (%) уксусной кислоты в смеси?
11.9 При бромировании бензола объемом 35,5 мл получена смесь бромбензола и дибромбензолов общей массой 73,86г. Бензол израсходован полностью. Определите мольную долю бромбензола (%) в полученной смеси. Плотность бензола – 0,879г/мл.
11.10 Смесь содержит равное число молекул этанола и уксусной кислоты. Рассчитайте массовые доли веществ в такой смеси.
11.11 При нитровании бензола объемом 26,6 мл получена смесь нитробензола и динитробензолов общей массой 39,6г. Бензол израсходован полностью. Определите мольную долю нитробензола (%) в полученной смеси. Плотность бензола – 0,879г/мл.
11.12 При сгорании смеси этиламина и паров метанола образовалось 43,2 г воды и 4,48 л газа (н.у), нерастворимого в растворе щелочи. Вычислите массовую долю метанола в исходной смеси.
11.13 Смесь бензола и циклогексена обесцвечивает 75 г бромной воды с массовой долей брома 3%. При сжигании такого же количества исходной смеси в избытке кислорода образовавшиеся продукты пропустили через избыток известковой воды и получили 21 г осадка. Определите состав исходной смеси (% по массе).
11.14 При радикальном хлорировании циклогексана объемом 21,5мл получена смесь хлорциклогексана и дихлорциклогексанов общей массой 25,77г. Циклогексан израсходован полностью. Определите мольную долю хлорциклогексана (%) в полученной смеси.
11.15 При действии избытка натрия на смесь этилового спирта и фенола выделилось 6,72 л водорода (н.у). Для полной нейтрализации этой же смеси потребовалось 25 мл 40%-ного раствора гидрооксида калия (плотность 1,4 г/мл). Определите состав исходной смеси.
11.16 Смесь уксусной и аминоуксусной кислот обработана раствором, содержащим NaOH массой 80 г. Вычислите массу смеси, если на взаимодействие с такой же ее порцией затрачена соляная кислота массой 36,5 г.
11.17 При взаимодействии 300 г 9%-го раствора щавелевой кислоты НООС – СООН с раствором гидрооксида натрия получена смесь двух солей общей массой 36,24 г.Щавелевая кислота израсходована полностью. Определите мольную долю кислой соли (в%) в полученной смеси.
11.18 На нейтрализацию смеси муравьиной и уксусной кислот затрачен раствор гидрооксида калия массой 200г с ω=11,2%. При действии на такую же массу смеси аммиачным раствором оксида серебра, выделилось серебро массой 2,16г. Какова массовая доля (%) уксусной кислоты в смеси?
11.19 При бромировании этана объемом 13,44л (н.у) получена смесь бромэтана и дибромэтанов общей массой 77,25г. этан израсходован полностью. Определите мольную долю бромэтана (%) в полученной смеси.
11.20 Через 10г смеси бензола, фенола и анилина пропустили ток сухого хлороводорода, при этом выпало 2,59 г осадка. Его отфильтровали, а фильтрат обработали водным раствором гидрооксида натрия. Верхний органический слой отделили. Его масса уменьшилась на 4,7 г. Вычислите массовые доли веществ в исходной смеси.
11.21 При взаимодействии 260 г 8%-го раствора малоновой кислоты НООС –СН2 - СООН с раствором гидрооксида калия получена смесь двух солей общей массой 32,96 г. Малоновая кислота израсходована полностью. Определите мольную долю кислой соли (в%) в полученной смеси.
11.22 Смесь фенола и анилина прореагировала с 40г раствора, в котором массовая доля гидрооксида натрия 5%. Эта же смесь может прореагировать с бромной водой, содержащей 72г брома. Определите массы фенола и анилина в исходной смеси.
11.23 16 г раствора фенола и уксусной кислоты в диэтиловом эфире обработали избытком металлического натрия, при этом выделилось 493 мл газа (н.у). Такое же количество раствора обработали избытком 5%-ного раствора гидрокарбоната натрия; образовалось 269 мл газа. Вычислите массовые доли веществ в растворею
11.24 Через 50 г смеси фенола, анилина и бензола пропустили газообразный хлороводород, при этом выпал осадок массой 12,95г. С такой же смесью полностью прореагировал раствор, содержащий 8,4г едкого калия. Найдите массовые доли компонентов в смеси.
11.25 На нейтрализацию смеси муравьиной и уксусной кислот затратили раствор объемом 8 мл с массовой долей КОН 40% и плотностью 1,4 г/мл. К такому же образцу смеси кислот прибавили избыток аммиачного раствора оксида серебра. Выделился металлический осадок массой 10,8 г. Определите массовые доли кислот в смеси.
11.26 На нейтрализацию смеси фенола с этанолом израсходован раствор объемом 50 мл с массовой долей гидрооксида натрия 18% (плотность 1,2 г/мл). Такая же масса смеси прореагировала с металлическим натрием массой 9,2г. Определите массовую (%) фенола и этанола в смеси.
11.27 При нагревании смеси этанола и уксусной кислоты с каталитическим количеством серной кислоты получили этилацетат массой 13,2 г. Выход эфира составил 60%. При действии избытка гидрокарбоната натрия на исходную смесь такой же массы образовался газ объемом 7,84 л (н.у). Определите массовые доли веществ в смеси.
11.28 При действии металлического натрия на смесь массой 17,45г, состоящую из фенола и 2-хлорэтанола, выделился водород в количестве, необходимом для восстановления оксида меди (I) массой 14,4 г. Вычислите массовые доли веществ в исходной смеси.
11.29 Для каталитического гидрирования 17,8 г смеси муравьиного и уксусного альдегидов до соответствующих спиртов потребовалось 11,2 л водорода (н.у). Определить состав смеси альдегидов (в % по массе)
11.30 При взаимодействии фталевой кислоты НООС –С6Н4 - СООН со 170 г 8%-ного раствором гидрооксида натрия получена смесь двух солей общей массой 40,68 г. Кислота и щелочь израсходованы полностью. Определите мольную долю кислой соли (в%) в полученной смеси.


 С = С <
С = С <


 H2
– O –COOR
H2
– O –COOR