- •Электродные потенциалы и электродвижущие силы
- •Понятие об электродном потенциале
- •Стандартный водородный электрод
- •Гальванический элемент
- •Ряд стандартных потенциалов металлических электродов (ряд напряжений)
- •Уравнение Нернста
- •Электролиз солей
- •Электролиз расплавов солей
- •Электролиз водных растворов солей с инертными электродами
- •Законы Фарадея
- •Применение электролиза
- •Коррозия металлов
- •Химическая коррозия
- •Электрохимическая коррозия
- •Виды электрохимической коррозии
- •Методы защиты металлов от коррозии
Электродные потенциалы и электродвижущие силы
Понятие об электродных потенциалах. Механизм возникновения электродного потенциала. Измерение электродных потенциалов. Гальванические элементы. Ряд стандартных потенциалов металлических электродов. Уравнение Нернста
Электрохимия – область химии, которая изучает получение электрического тока за счёт химических реакций (гальванические элементы) и возникновение химических реакций за счёт затраты электрической энергии (электролиз).
Процессы взаимного превращения химической и электрической форм энергии называют электрохимическими процессами. Электрохимические процессы являются окислительно-восстановительными. В окислительно-восстановительных реакциях переход электронов от восстановителя к окислителю происходит при непосредственном контакте между реагирующими веществами. При этом энергия химической реакции превращается в теплоту. Однако процессы окисления и восстановления могут быть пространственно разделены в электрохимической системе, которая состоит их двух электродов, соединенных друг с другом металлическим проводником. В этом случае электроны переходят от восстановителя к окислителю не непосредственно, а по металлическому проводнику. В металлическом проводнике, соединяющем окислитель и восстановитель, возникает электрический ток. Таким образом, в этом процессе происходит непосредственное преобразование энергии окислительно-восстановительной реакции в электрическую энергию. Взаимные превращения химической и электрической энергий непосредственно связаны с возникновением электродного потенциала.
Понятие об электродном потенциале
Рассмотрим процессы, протекающие при погружении металлической пластинки в воду или раствор электролита, содержащего ионы погруженного в раствор металла. Металлы имеют кристаллическую металлическую решётку, в узлах которой находятся, как атомы, так и положительно заряженные ионы. В металле существует подвижное равновесие, которое можно выразить уравнением
Me Men+ + ne, (4.2)
где Me – атом металла, Men+- ион металла, n - заряд иона металла.
Если опустить металлическую пластинку в раствор какой-либо соли этого металла, то полярные молекулы воды (диполи) своими отрицательными полюсами будут действовать на положительные ионы в
пластинке. За счёт ион-дипольного взаимодействия ионы отрываются с поверхности металла и в гидратированном виде переходят в раствор. Переход ионов металла в раствор можно выразить уравнением
Men+ + mH2O Men+ mH2O, (4.3)
где Men+ mH2O– гидратированный ион металла в растворе.
Равновесия (4.2) и (4.3) могут быть представлены в суммированном виде
Me + mH2O Men+ mH2O + ne (4.4)
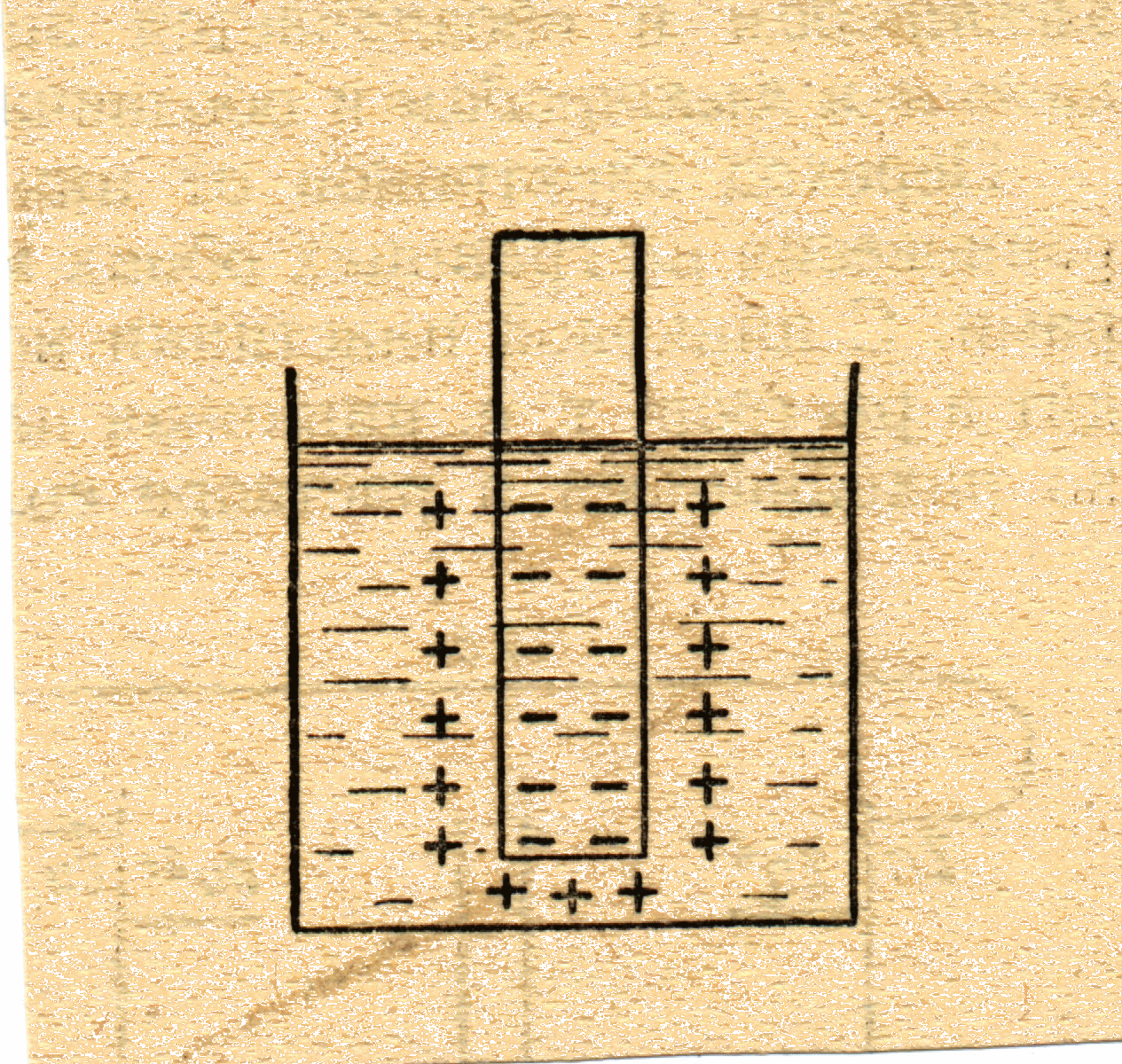
В результате перехода ионов металла в раствор он заряжается положительно, а металл – отрицательно, поскольку на нём появляется избыток электронов. Ионы металла, попавшие в раствор вместе с гидратными оболочками, притягиваются к отрицательно заряженной поверхности металлической пластинки. В результате образуются два слоя, с противоположными зарядами – так называемый двойной электрический слой (рис. 4.4).
Рис 4.4 Схема двойного электрического слоя на границе металл-раствор
|
На границе соприкосновения металла и раствора возникает определённая разность потенциалов, так как двойной электрический слой можно уподобить конденсатору с определённой разностью потенциалов. Процесс перехода ионов металла в раствор является обратимым. Часть ионов металла за счёт притяжения к отрицательно заряженной пластинке могут снова переходить на пластинку. Устанавливается подвижное равновесие, которое выражается уравнением (4.4). |
Разность потенциалов на границе металл – раствор при наступлении равновесия называется равновесным электродным потенциалом металла. Значение электродного потенциала зависит от трёх факторов: 1) от природы (активности) металла, из которого изготовлен электрод; 2) от концентрации ионов металла, образующихся при взаимодействии электрода с раствором, и 3) от температуры.
Непосредственно измерить абсолютную величину потенциала отдельного электрода не представляется возможным. Однако можно определить разность электродных потенциалов. Поэтому для определения потенциала отдельного электрода измеряют разность потенциалов между данным электродом и каким-либо электродом с постоянным потенциалом, который условно принимают равным нулю. Электроды с постоянными потенциалами называют стандартными или электродами сравнения. В качестве электрода сравнения используется стандартный водородный электрод.