
- •Аоо «Назарбаев Зияткерлік мектептері »
- •Химия – биология бағытындағы негізгі мектепті бітірту үшін қорытынды аттестациясының бақылау жұмысы Химия
- •Экзамен құрылымы
- •Экзаменнің өтілу уақыты:
- •Б) мырыш гидроксидінің в) күкірт қышқылының қышқылдық, негіздік және екідайлық қасиеттерді дәлелдеу.
- •Бақылау жұмысы тапсырмалары:
- •Бақылау жұмысының дұрыс жауаптары:
Бақылау жұмысы тапсырмалары:
I.1. Паули принципі, Гунд ережесі, Клячковский ережесіне сәйкес № 19 элемент атомының электрондық конфигурациясын жаз. Электронды-графикалық формуласын валенттілік электрондары үшін жазып:а) валенттіліктері мен тотығу дәрежелерін анықта; б) квант сандарын анықта
2. Д.И Менделеев жасаған химиялық элементтердің периодтық жүйесіндегі 3 –ші период элементтерінің: а) тотықсыздандырғыштық- тотықтырғыштық; б) негіздік –қышқылдық қасиеттерінің өзгеруін көрсет.
3. Бор хлоридіндегі: а) бордың гибридтену типін анықта; б) молекуланың кеңістіктегі геометриялық формасын анықта; б) химиялық байланыстардың түзілу механизмдерін жаз.
II.1. Химиялық кинетика. Химиялық реакциялардың жылдамдығына әсер ететін факторларға реакция теңдеулерінен мысалдар келтіре отырып, әсерін көсрет: а) әрекеттесуші заттардың табиғаты; б) температура ( Вант-Гофф ережесі); в)концентрация; г) қысым; д)өршіткі . Химия және биохимиядағы катализатордың рөлі (гомогенді (біртекті) және гетерогенді( әртекті)).
II.2. Химиялық тепе -теңдік. Химиялық тепе –теңдіктің ығысуын Ле – Шателье ұстанымына сүйене отырып, мысалдар келтіріп түсіндір: а) температура; б) қысым; в) әрекеттесуші заттармен реакция өнімдерінің концентрациясы.
2CO +O2 = 2CO2 ; ∆H = -566,4 кДж
III. Төменде берілген өзгерістерді жүзеге асыруға болатын реакция теңдеулерін жазып, жұлдызшамен көрсетілген реакцияның (*)механизмін түсіндір және (**)тұздың гидролиз реакциясының молекулалық, толық және қысқартылған иондық теңдеулерін жаз.
NaCl(ер-ді) *→ Cl2 →HCl →C2H5Cl → C2H5OH
↓ ↑
NaOH→ **Na2CO3→NaHCO3 →CO2→C6H12O6
IV. Көлемі 300 мл 10 % -дық , тығыздығы 1,109 г/мл натрий гидроксиді ерітіндісіне 500мл 30% -дық тығыздығы 1,180 г/мл азот қышқылы ерітіндісін қосқанда массасы 65 г тұз түзіледі.Реакция өнімінің шығымын есепте.
V. Массасы 20,5 г сусыз натрий ацетатын натрий гидроксидімен қосып қыздырғанда бөлінген газ, жарықтың әсерінен хлормен әрекеттесті.Бұл хлор 130,5 г марганец диоксидін қолданып алынған. Хлорлау реакциясы толық жүріп өткеннен кейін барлық газ тәрізді заттарды суда еріткен. Сонда алынған ерітінді бейтараптау үшін қажетті натрий гидроксидінің зат мөлшері тап. ( 2моль)
Бақылау жұмысының дұрыс жауаптары:
1- тапсырма
№19 калий 4-ші периодтың 1-ші тобының негізгі топша элементі.+19 )2e )8e )8e )1e 1s22s22p63s23p64s1
4
↑
s1Валенттілігі – 1, тотығу дәрежесі: 0;+1
Квант сандары: n = 4; l= 0; m = 0; s = +1/2
Паули принципі: Атомда барлық квант саны бірдей екі электрон болмайды.
Мысалы: калий атомының 3-ші энергетикалық деңгейдегі 3s2 электронын алып қарастырсақ:
↑↓

n = 4 n = 4
l= 0 l= 0
m = 0 m = 0
s = +1/2 s = -1/2
спин квант сандары өзгеше
Гунд ережесі: бір деңгейшеде орналасқан электрондардың спин квант сандарының қосындысы максимал болуы шарт, ол үшін электрондар энергетикалық деңгейлерге алдымен бір –бірден толады, соңынан жұптасып орналасады.
М
↑
↓
ыс: 4s1 4s1
S1 = +1/2 S2 = -1/2 S1 > S2
Клечковский ержесі:
Электрондардың энергетикалық деңгейшелерге орналасуы бас және қосымша квант сандарының қосындысының ( n+l) артуымен болады.Егер бас және қосымша квант сандарының қосындысы бірдей болса, электрондардың деңгейшелерге толуы бас квант санының мәнімен анықталады. Алдымен бас квант санының мәні кішісіне сай орбиталь электрондармен толады
Мыс: n+l = 4 n =3 l = 1 (3p)
n=4 l = 0 (4s)
1.2) Д.И Менделеев жасаған химиялық элементтердің периодтық жүйесіндегі 3 –ші период элементтері: Na , Mg, Al, Si, P, S, Cl , Ar
а) атом ядро зарядтары артқан сайын тотықсыздандырғыш ( металдық) қасиеті кеміп, тотықсыздандырғыштық- тотықтырғыштық (бейметалдық) қасиеті артады.
Мысалы: натрий электронды оңай береді Na -1e → Na+ ал хлор электронды оңай қосып алады Cl+1e → Cl-
б )Na2O
, MgO, Al2O3,
SiO2,
P2O5,
SO3,
Cl2O7
)Na2O
, MgO, Al2O3,
SiO2,
P2O5,
SO3,
Cl2O7
NaOH, Mg(OH)2 , Al(OH)3, H2SiO3, H3PO4, H2SO4, HClO4 негіздік қасиеті кеміп, қышқылдық қасиеті артады.
сілті негіз екідайлы негіз әлсіз қышқыл күшті қышқыл
Na2O күшті негіздік оксид
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
Na2O + H2SO4 = Na2SO4+H2O
Al2O3 екідайлы оксид
Al2O3 +3H2SO4 = Al2(SO4)3+3 H2O
Al2O3 + 2NaOH = 2NaAlO2+H2O
SO3 күшті қышқылдық оксид
SO3 +H2O = H2SO4
SO3 + 2KOH = K2SO4+ H2O
SO3 + K2O = K2SO4
1.3) BCl3 Бор хлориді:

 а)
+5
)2e)3e
B 2s2
2p1
B*
2s2
2p1
а)
+5
)2e)3e
B 2s2
2p1
B*
2s2
2p1
B гибридтену типі – sp2
б )
молекуланың кеңістіктегі геометриялық
формасы: жазық үшбұрыш
)
молекуланың кеңістіктегі геометриялық
формасы: жазық үшбұрыш


в )
химиялық байланыстардың түзілу
механизмі:ВБ B* 2s2
2p1
)
химиялық байланыстардың түзілу
механизмі:ВБ B* 2s2
2p1


 3s2
3p5
3s2
3p5
 3s2
3p5
3s2
3p5
3s2 3p5
Дара электрондардың жұптасуы:
C
 l•
+ •B• + •Cl Cl :B:
Cl
Cl – B – Cl
l•
+ •B• + •Cl Cl :B:
Cl
Cl – B – Cl
• ..
+ Cl Cl
Cl•
2- тапсырма
Химиялық реакциялардың жылдамдығын зерттейтін химияның бөлімін-
химиялық кинетика деп атайды.
Химиялық реакцияның жылдамдығы деп уақыт бірлігінде әректтесетін заттардың немесе реакция өнімдерінің біреуінің концентрацияларының өзгеруін айтады.
υ
=
 ;
моль/л•мин
(сек)
;
моль/л•мин
(сек)
Химиялық реакциялар бір фазаның көлемінде немесе фазааралық бетте жүреді. Сондықтан химиялық реакциялардың жылдамдығы біртекті (гомогенді)және әртекті (гетерогенді) ортаға тәуелді болады.
Гомoгенді реакцияның жылдамдығы, жұйенің белгілі бір көлемінде уақыт бірлігінде реакцияға қатысқан немесе реакция кезінде түзілген өнімнің біреуінің мөлшерімен анықталады.
υгом
=

Гетерогенді реакцяның жылдамдығы, фаза бетінің аудан бірлігінде белгілі бір уаықт ішінде реакцияға қатысатын немесе реакция кезінде түзілетін заттың бірінің мөлшерімен сипатталады.
υгетер
=

Химиялық реакциялардың жылдамдығына әсер ететін факторлар:
Әрекеттесуші заттардың табиғаты;
Концентрация;
Температура;
Катализатор ;
Қатты заттар үшін жанасу бетінің ауданы;
а) әрекеттесуші заттардың табиғаты – оттектің сутекаен әрекеттесуі өте жылдам ,ал сутекпен азоттың әрекеттесуі баяу жүреді.Оттек атомдарының арасындағы байланыс энергиясы 494 кДж/моль болса, азот атомдарының арасындаға байланыс энергиясы 942 кДж/моль. Азот атомдарының байланыс энергиясы жоғары болғандықтан беріктеу азот молекуласы реакцияға қиынырақ түседі.
б) температура- температураны әрбір 100С-қа көтергенде реакция жылдамдығы 2-4 есе артады ( Вант-Гофф ережесі).
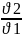 =
=
 ;
;
в)концентрация.Ә рекеттесуші массалар заңы:химиялық реакцияның жылдамдығы әрекеттесуші заттардың концентрацияларының көбейтіндісіне пропорционал.
г) Қысым . Менделеев-Клапейрон теңдеуінен көрініп тұрғандай қысым мен концентрация реакция жыдлдамдығына тура пропорционал. Яғни химиялық реакцияның жылдамдығы әрекеттесуші заттардың қысымын арттырған сайын жылдамыдығы артады.
д)Катализатор(өршіткі) -химиялық реакциялардың жылдамдығын арттырып , бірақ реакция нәтижесінде өзгермей қалатын заттар.катализатор қатыса жүретін реакцияларды каталидік үрдістер деп атайды.
Гомогенді катализде әрекеттесуші заттар мен реакция өнімі және катализатор
NO(г)
б ірдей
агрегаттық күйде болады. Мыс: 2SO2(г)+O2(г)
2SO3(г)
ірдей
агрегаттық күйде болады. Мыс: 2SO2(г)+O2(г)
2SO3(г)
Гомогенді катализ аралық қосылыстар теориясымен жақсы түсіндіріледі.Мұнда катализатор реагенттердің біреуімен әрекеттесіп тұрақсыз, аралық қосылыс түзеді. Бұл реакция жылдам жүреді, себебі процестің белсендіру энергиясы төмен. Аралық қосылыс екінші реагентпен әрекеттесіп, катализатор босап шығады.
гетерогенді катализде реагенттер мен өнім және катализатор әр түрлі агрегаттық күйде болады.
V2O5(қ)
М ыс : 2SO2(г)+O2(г) 2SO3(г).
Гетерогенді катализіді түсіну үшін адсорбциялық теорияны қолданады. Адсорбция деп газтектес немесе еріген заттардың басқа қатты заттардың бетіне топтасуын (концентрленуін) айтамыз.бетінде адсорбция жүретін заттар – адсорбенттер деп аталады.
Химия және биохимиядағы катализатордың рөлі.Химиялық өнеркәсіпте кталаизатордың рөлі жоғары.Көптеген заттарды алу үшін катализатордың қатысуы қажет болады. Ал күрделі биохимиялық процестерде ферменттердің ( биологиялық катализаторлар) қатысуы ерекше рөл атқарады.Олардың қатысында өсімдіктер мен тірі ағзаларда күрделі химиялық процестер жүреді.
II.2 Химиялық тепе –теңдік. Тура және кері реакциялардың жылдамдығын теңескен жүйе күйін химиялық тепе –теңдік деп аталады.
Химиялық тепе- теңдік Ле Шателье ұстаныма сәйкес ығысады. Ле -Шателье ұстанымы: химиялық тепе –теңдікте тұрған жүйе күйіне сыртқы факторлардың біреуімен( қысым, температура , концентрация ) әсер етсек, тепе – теңдік сол факторды әлсірету бағытына қарай ығысады.
а) температура химиялық реакцияның жылу эффектісіне қарай әсер етеді. Температураны төмендеткенде химиялық тепе –теңдік экзотермиялық реакция бағытына қарай ығысады, ал температураны жоғарылатқанда эндотермиялық реакция бағытына ығысады. Бізге берілген реакция экзотермиялық болғандықтан тура реакция бағыты үшін температураны төмендету керек. Ал кері реакция бағыты үшін температураны жоғарылату қажет.
б) Қысым .Газ тәрізді заттардың арасында жүретін реакцияларды реакция нәтижесінде газдардың көлемдерінің өзгеруіне байланысты әсер етеді.Берілген реакция үшін реакцияға дейін 3 көлем(3 моль) ,ал реакциядан кейін 2 көлем(2моль) қысымды арттырғанда тепе –теңдік газ көлемдерінің азаю жағына қарай, яғни оңға қарай ығысады және керісінше ;
в) Концентрация. Әрекеттесуші заттардың концентрациясын арттыру немесе реакция өнімдерінің концентрациясын азайту тепе –теңдікті оңға қарай ығыстырады.берілген реакция үшін иіс газы мен оттегінің концентрацияларын арттырып, немесе көмірқышқыл газының концентрациясын кеміту реакцияның тепе- теңдігін оңға қарай ығыстырады. :
3-тапсырма
N aCl(еріт) электролиз NaOH + Cl2↑ +H2↑
Cl2+H2 →2HCl
HCl+C2H4→ C2H5Cl
C2H5Cl+H2O→ C2H5OH+HCl
N aCl(еріт) электролиз NaOH + Cl2↑ +H2↑
2NaOH+CO2→Na2CO3+H2O
Na2CO3+H2CO3→2NaHCO3
2 NaHCO3 t CO2+H2O+Na2CO3
6 CO2+H2O фотосинтез С6Н12О6
1 0) С6Н12О6 спирттік ашу 2С2Н5ОН+2СО2
Электролиз үрдісінің механизмі
К
 (-)
: Na+
,
H+
2H+
+2e → H2
(-)
: Na+
,
H+
2H+
+2e → H2
A (+): Cl- , OH- 2Cl- -2e → Cl2а
NaCl(еріт) электролиз NaOH + Cl2↑ +H2↑
Тұз гидролизінің молекулалық, толық және қысқартылған иондық теңдеуі:
**Na2CO3+H2O→NaHCO3+NaOH
2Na++CO32-+H2O→Na++HCO3-+Na++OH-
CO32-+H2O→ HCO3-+ OH-
NaHCO3+H2O→H2O+CO2↑+NaOH
Na++HCO3-+H2O→ H2O+CO2↑+Na++OH-
HCO3-+H2O→ H2O+CO2↑+ OH-
рН > 7 сілтілік орта
4-тапсырма
Б ерілгені: Шешуі:
ω
ω(еріген
зат)
=
 m
(еріген
зат)
=
m
(еріген
зат)
=

m(NaOH)
=

m(HNO3)
=

(NaOH) =10%
V(NaOH) = 300 мл
ρ = 1,109
г/мл
= 1,109
г/мл
ω(HNO3)= 30%
v(HNO3) = 500 мл
ρ = 1,180 г/мл
m(NaNO3)= 65 г
т/к : η=?
NaOH+HNO3→NaNO3+H2O
ν,моль 1 1 1 1
Mr 40 63 85 18
M,г/моль 40 63 85 18
m ,г 40 63 85 18
Мф(NaOH)=
Мф(HNO3)=
m(NaNO3)= η=
η= =
= Жауабы:
η=91,95%
Жауабы:
η=91,95%
5 -тапсырма:
Берілгені: шешуі:1) Натрий ацетаты мен балқыған натрий
m(CH3COONa)=20,5 гидроксиді арасындағы реакция теңдеуін
m(MnO2)=130,5 жазып , түзілген метанның массасын( көлемін,
зат мөлшерін) есептеу
т/к ν(NaOH)=? 20,5 г х,г
CH3COONa + NaOH→ CH4 + Na2CO3
ν,моль 1 1
Mr 82 16
M,г/моль 82 16
m 82 16
m(CH4)
= = 4г
= 4г
2) Тұз қышқылы мен марганец диоксиді арасындағы
реакция теңдеуін жазып, бөлінген хлордың
массасын (көлемін , зат мөлшерін ) есептеу
130,5 х,г
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
ν,моль 1 1
Mr 87 71
M,г/моль 87 71
m 87 71
m(Cl2)=
3) Метанның хлорлану реакция теңдеуін жазып, түзілген хлорсутектің массасын (көлемін , зат мөлшерін ) есептеу
4г х,г
CH4+4Cl2→CCl4+4HCl
ν,моль 1 4 4
Mr 16 71 36,5
M,г/моль 16 71 36,5
m 16 284 146
Mf (CH4)
=

Mf(Cl2)
=

Mf (CH4) < Mf(Cl2)
болғандықтан есептеуді метаннан жүргіземіз
m(HCl)
=
 ν(HCl) =
ν(HCl) =
 моль
моль
4) Реакцияға түспей қалған хлордың массасын (көлемін ,
зат мөлшерін ) есептеу
4г х,г
CH4+4Cl2→CCl4+4HCl
ν,моль 1 4
Mr 16 71
M,г/моль 16 71
m 16 284
m(Cl2)
=
 реакцияға түскен хлордың
реакцияға түскен хлордың
массасы
Реакцияға қатыспай қалған хлордың массасы:
m(Cl2) = 106,5 – 71= 35,5г
ν(Cl2)=
 моль
моль
5) Хлордың сумен реакция теңдеуін жазып, түзілген хлорсутектің және хлорлылау қышқылының массасын (көлемін , зат мөлшерін ) есептеу.
0,5 моль х у
Cl2 + H2O = HCl + HClO
ν,моль 1 1 1
ν(HCl)
=
 моль
моль
ν(HClO)
=
 = 0,5 моль
= 0,5 моль
6)Реакция нәтижесінде түзілген тұз қышқылының жалпы массасын (көлемін , зат мөлшерін ) есептеу.
∑ν(HCl) = 1+0,5 = 1,5 моль
ν(HClO) = 0,5 моль
бірнегізді қышқыл мен бірнегізді сілті болғандықтан қышқыл мен сілтінің бейтараптануына
1 моль қышқылға 1моль сілті жұмсалады.
HClO + NaOH = NaClO + H2O
ν, моль 1 1
HCl +NaOH = NaCl + H2O
ν, моль 1 1
Ендеше сілтіні бейтараптауға жұмсалатын қышқылдардың моль саны; ∑ν(HCl) + ν(HClO) = 1,5+0,5 = 2 моль
2 моль қышқылдарды бейтараптауға 2 моль сілті жұмсалады.
Жауабы:ν (NaOH) = 2 моль
