
ЛАБОРАТОРНАЯ РАБОТА №7.
ГАЗОВАЯ КОРРОЗИЯ СТАЛИ.
ЦЕЛЬ И ЗАДАЧИ РАБОТЫ. Изучить закономерности протекания химического гетерогенного процесса с точки зрения термодинамики и кинетики на примере газовой коррозии стали при высоких температурах, установить контролирующую стадию процесса окисления стали при заданной температуре (в случае диффузионного контроля процесса определить значение коэффициента диффузии).
7.1.Теоретическая часть.
Термодинамика газовой коррозии металлов..
Газовая коррозия - самопроизвольное взаимодействие металла с газовой средой при высоких температурах. При температуре более 1000С на поверхности металла даже во влажной атмосфере воздуха не происходит конденсация паров воды. В этих условиях среда эксплуатации металла не является электропроводной. Поэтому газовая коррозия протекает по химическому механизму, то есть как обычная окислительно-восстановительная реакция взаимодействия металла с окислителем, содержащимся в коррозионной среде. При этом окисление металла и восстановление окислителя протекают в одном акте, то есть одновременно и на одном и том же участке поверхности. Например, коррозия стали в атмосфере воздуха при высоких температурах:
4Fе + 3О2 = 2Fе2О3
2 2Fе - 6е = 2Fе2+ - окисление,
3 О2 + 4е = 2О2- - восстановление
Fе2О3 - фазовая пленка труднорастворимого продукта коррозии.
Если представить, что при некоторой температуре процесс химической коррозии является обратимым, то есть протекает в двух взаимнопротивоположных направлениях (окисление металла и диссоциация оксида), то в соответствии с уравнением изотермы Вант-Гоффа изменение энергии Гиббса будет равно:
G = -RТlnКр, где
R - универсальная газовая постоянная,
Т - абсолютная температура,
Кр - константа равновесия.
Для рассматриваемой реакции:
Sfe2O3
Кр = —————
SFеР O23 ,
где S - площадь поверхности твердой фазы,
РО2 - парциальное давление кислорода.
Если принять S = const , то
Кр1 = 1/Р O23.
В результате перехода системы из исходного состояния в равновесное происходит изменение свободной энергии системы:
G = Gравн - Gисх,
где Gисх - свободная энергия системы в исходном состоянии,
Gравн - свободная энергия системы в равновесном состоянии.
Таким образом, для процесса химической коррозии стали изотерму Вант -Гоффа можно записать:
G = -RТln(Р O2)исх3/(Р O2)равн3,
Если (Р O2)исх > (Р O2)равн, то G < 0 , следовательно, равновесие процесса будет смещено в сторону прямой реакции.
Сплавы на основе железа по этой причине неустойчивы в широком интервале температур.
Однако, термодинамика отвечает лишь на вопрос о возможности протекания процесса, но не дает представления о скорости и механизме протекания химической коррозии.
Кинетика газовой коррозии металлов.
Газовая коррозия - это гетерогенный процесс, протекающий на поверхности металла в газовой атмосфере.
Все гетерогенные процессы являются многостадийными и протекают, как минимум, в три стадии.
4
1.Диффузия реагентов к поверхности твердой фазы.
2.Химическая реакция, которая, в свою очередь, также может быть многостадийной.
3.Диффузия продуктов реакции от поверхности твердой фазы в объем системы.
Третья стадия легче протекает в том случае, если продукты реакции жидкие или газообразные. В случае химической коррозии продукт коррозии чаще всего твердое вещество, которое образует на поверхности металла адсорбционные или фазовые пленки различного состава и структуры. Диффузия реагентов через такие пленки затруднена.
Скорость процесса химической коррозии металлов будет определятся скоростью наиболее медленной стадии процесса.
П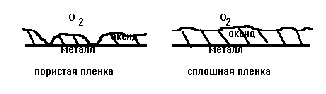 ленка
продукта коррозии может быть пористой
или сплошной.
ленка
продукта коррозии может быть пористой
или сплошной.
В случае пористых пленок реакция идет непосредственно на границе металла с газовой атмосферой, то есть окислитель (в частности, кислород воздуха) через поры пленки проходит к поверхности металла.
Если на поверхности металла образовалась сплошная пленка продуктов коррозии, то происходит встречная диффузия атомарного кислорода к поверхности металла и ионов металла и электронов от поверхности металла через пленку.
Природа частиц, участвующих во встречной диффузии через пленку, может быть различной, но в соответствии с размерами частиц, можно предположить, что преимущественно идет диффузия более мелких частиц (электронов, ионов металла и атомов кислорода).
В зависимости от структуры пленки восстановление атомов кислорода может происходить на различных по глубине участках пленки:
О + 2е = О2-
Ме - nе = Меn+
Далее идет реакция:
2Меn+ + nО2- = 2МеОn/2
В результате этой реакции образуется фазовая оксидная пленка.Рост оксидной пленки может происходить на различных расстояниях от внешней или внутренней поверхности пленки в зависимости от скорости встречной диффузии реагирующих частиц.
