
- •2 Тарау. Молекулалық физика және термодинамика
- •Молекуланың массасы мен өлшемдері
- •Температура
- •§8.Газ заңдары. Изопроцестер
- •8.1.Авогадро заңы
- •8.2.Клапейрон теңдеуі
- •8.3.Идеал газ күйінің теңдеуі
- •8.4.Дальтон заңы
- •§9.Газдардың молекула-кинетикалық теориясы
- •9.1.Молекула –кинетикалық теорияның негізгі теңдеуі
- •9.2.Газ молекуласының еркіндік дәрежесі
- •9.3.Максвелл таралуы
- •9.4.Больцман таралуы
- •§10.Термодинамиканың бірінші заңы
- •10.1.Ішкі энергия
- •10.2.Термодинамикалық жұмыс
- •10.3.Жылу мөлшері
- •10.4.Термодинамиканың і заңын процестерге қолдану
- •§11.Термодинамиканың екінші заңы
- •11.1.Тұйық процестер
- •11.2.Карно циклі
- •11.3.Энтропия
- •Дененің ішкі энергиясының есебінен шексіз жұмыс атқару мүмкін емес. .
- •§12.Тасымалдау құбылыстары
- •12.1.Диффузия құбылысы
- •12.2.Жылу өткізгіштік құбылысы
- •12.3.Ішкі үйкеліс құбылысы
- •§13.Нақты газдар
§9.Газдардың молекула-кинетикалық теориясы
Газдардың физикалық қасиеттерін зерттеуге статистикалық әдісті қолданайық.
Молекула –кинетикалық теорияның негізгі қағидалары:
Барлық заттар бөлшектерден тұрады (молекулалар мен атомдардан);
Осы бөлшектер тәртіпсіз, хаостық қозғалыста болады. Бұл қозғалыс жылулық қозғалыс деп аталады;
Бөлшектер бір-бірімен өзара әсерлеседі.
Зат бөлшектерінің жылулық қозғалысын қөрнекі түрде көрсететін тәжірибені ағылшын ғалымы Броун жасады. Броун микроскоптың көмегімен сұйықта қалқыған гүл тозаңдарының жылдам, тәртіпсіз қозғалысын бақылады. Осындай зат бөлшектерінің жылулық қозғалысын Броундық қозғалыс деп атайды.

9.1.Молекула –кинетикалық теорияның негізгі теңдеуі
Макроскопиялық параметрлердің (қысым, көлем) микроскопиялық параметрлермен (молекулалардың массасы, жылулық қозғалыс жылдамдығы, кинетикалық энергиясы) арасындағы байланысты көрсететін өрнекті молекула-кинетикалық теорияның негізгі теңдеуі деп атайды.
Молекулалардың орташа жылдамдығы:
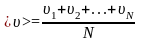
өрнегімен анықталады.
Молекулалар
концентрациясы -
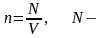 молекулалар
саны. Концентрация деп бірлік көлемдегі
бөлшектер санын айтамыз. Өлшем бірлігі
молекулалар
саны. Концентрация деп бірлік көлемдегі
бөлшектер санын айтамыз. Өлшем бірлігі
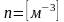 .
.
Бір
бағытта қозғалатын бөлшектер саны-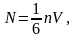
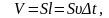
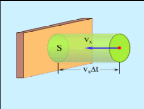
Соныменен
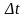 -уақытта
ауданы S-қабырғаға
соқтығысатын молекулалар саны-
-уақытта
ауданы S-қабырғаға
соқтығысатын молекулалар саны-
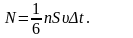
Әрбір
молекула қабырғаға F1-күшпен
әсер етеді:
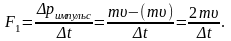
Соқтығысатын
барлық молекулалардың қабырғаға әсер
ететін қысым күші:
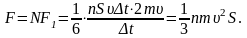
Әр
түрлі молекулалардың түрліше
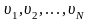 жылдамдықтармен қозғалатынын ескерсек,
өрнекке молекулалардың
жылдамдығының квадратының орташа мәні
койылады.
жылдамдықтармен қозғалатынын ескерсек,
өрнекке молекулалардың
жылдамдығының квадратының орташа мәні
койылады.
Молекулалардың орташа квадраттық жылдамдығы:
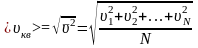 .
.
Қысым күштің күш әсер ететін ауданына қатынасымен анықталады:
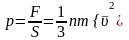 немесе
немесе
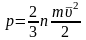 ,
,
осыдан
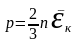 екенін анықтаймыз,
екенін анықтаймыз,
мұндағы:
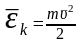 -
газ молекуласының ілгерлемелі қозғалысының
кинетикалық энергиясының орташа мәні.
-
газ молекуласының ілгерлемелі қозғалысының
кинетикалық энергиясының орташа мәні.
Осы алынған өрнекті молекула-кинетикалық теорияның негізгі теңдеуі немесе Клаузиус теңдеуі деп атайды.
Газдың қысымы газ молекулаларының жылулық қозғалысының орташа кинетикалық энергиясына тура пропорционал болады.
Температураның
негізгі физикалық мағынасын көрсететін
өрнек-
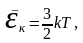
мұндағы-
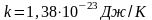 Больцман тұрақтысы деп аталады.
Больцман тұрақтысы деп аталады.
Температура газ молекуласының орташа кинетикалық энергиясының сандық мөлшері болып табылады. Больцман тұрақтысы температура 1 Кельвинге өзгергенде газ молекуласының орташа кинетикалық энергиясы қаншаға өзгеретінін көрсетеді.
9.2.Газ молекуласының еркіндік дәрежесі
Газ молекуласының еркіндік дәрежесі деп молекуланың кеңістіктегі орнын анықтайтын тәуелсіз параметрлердің жиынтығын айтамыз. Егер кез-келген дене кеңістікте қозғалатын болса, онда осы қозғалысты тәуелсіз алты қозғалыстың жиынтығы түрінде қарастыруға болады: үш ілгерлемелі қозғалыстың (тікбұрышты координаталар жүйесінің осьтері бойымен), үш айналмалы қозғалыстың (дененің массалар центрі арқылы өтетін өзара перпендикуляр үш осьтің айналасында) жиынтығы.
Қалыпты жағдайда газ молекулаларының еркіндік дәрежесі:

Жоғары температураларда бұл еркіндік дәрежесіне тербелмелі қозғалыстың бұл еркіндік дәрежесі қосылады.
Бір
атомды газ үш бағытта ілгерлемелі
қозғала алады. Сондықтан бір атомды
газдың еркіндік дәрежесі
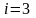 -ке
тең.
-ке
тең.
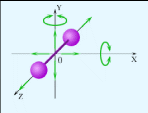
Екі
атомды газ үш бағытта ілгерлемелі және
екі бағытта айналмалы қозғала алады
(сурет). Сондықтан екі атомды газдың
еркіндік дәрежесі
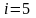 -ке
тең болады.
-ке
тең болады.
2-атомды газ үшін 3-атомды газ үшін
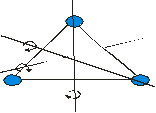
Үш
атомды
газ үш бағытта ілгерлемелі және
үш бағытта
айналмалы қозғала алады Сондықтан үш
атомды газдың еркіндік дәрежесі
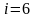 -ға
тең болады.
-ға
тең болады.
