
- •Основы аналитической химии
- •Предмет и задачи аналитической химии
- •Стадии аналитического процесса
- •Классификация методов анализа
- •1. По диапазонам определяемых содержаний и количеству пробы
- •2. По аппаратурному оформлению
- •3. По характеру вещества:
- •Классификация методов анализа по природе энергии возмущения
- •Химические методы анализа Качественный химический анализ.
- •Деление катионов на группы по сероводородному методу.
- •2. Количественный анализ
- •2.1. Гравиметрический анализ.
- •2. 2. Титриметрические методы анализа
- •Физико-химические и физические методы анализа
- •1. Атомно-эмиссионная спектроскопия (аэс.)
- •3. Интерференционные устройства.
- •2. Абсорбционная спектроскопия (спектрофотометрия, фотоколориметрия, ик-спектрометрия, атомно-абсорбционная спектроскопия)
- •3. Электрохимические методы.
- •Хроматография
- •Поерхностные явления и адсорбция
- •1. Общая характеристика поверхностных явлений
- •2. Поверхностные явления на подвижных границах раздела фаз
- •Уравнение Лэнгмюра имеет вид
- •Уравнение Фрейндлиха
- •3. Поверхностные явления на неподвижных границах раздела фаз
- •3.1. Адсорбция на грнице раздела тердое тело – газ
- •3.2. Адсорбция на границе раздела твердое тело – раствор
- •Ионообменная адсорбция. Особый случай представляет адсорбция ионов электролитов из водных растворов на поверхности специальных ионообменных смол. Этот вид получил название ионообменной адсорбции.
- •Вопросы для самоконтроля
- •Физико-химия дисперсных систем
- •1. Классификация дисперсных систем
- •Классификация дисперсных систем по степени дисперсности
- •Классификация дисперсий по агрегатному состоянию
- •2. Методы получения коллоидных систем
- •Исходные растворы должны быть разбавленными и содержать избыток одного из реагентов.
- •3. Методы очистки коллоидных растворов
- •4. Молекулярно-кинетические свойства коллоидных систем
- •5. Оптические свойства дисперсных систем
- •6. Электрические свойства дисперсных систем
- •7. Строение коллоидных частиц - мицелл
- •8. Устойчивость и коагуляция коллоидных систем
- •9. Лиофильные коллоидные системы. Коллоидные пав
- •Вопросы для самоконтроля
- •Основная литература
- •Дополнительная литература
3. Электрохимические методы.
Электрохимические методы анализа основаны на изучении и использовании процессов, протекающих на поверхности электрода или в приэлектродном пространстве. Аналитический сигнал – электрический параметр (потенциал, сила тока, сопротивление), который зависит от концентрации определяемого вещества.
Потенциометрия – электрохимический метод анализа и исследования, основанный на определении зависимости между равновесным электродным потенциалом (Е) и термодинамической активностью (а) или концентрацией (С) компонентов реакции.
Связь потенциала электрода и активностью веществ описывается уравнением Нернста:
E
= E0
+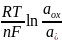 ,
,
Где Е0 – стандартный потенциал редокс-системы;
R = 8,312 Дж/(моль∙К) - универсальная газовая постоянная;
Т – абсолютная температура, К;
F = 96500 Кл/моль, постоянная Фарадея;
n – число электронов, участвующих в электродной реакции;
aox, ared – активности окислительной и восстановительной форм редокс-системы.
На практике используют концентрации (С). А не активности (а).
При потенциометрических измерениях составляют гальванический элемент с индикаторным электродом и лектродом сравнения и измеряют электродвижущую силу (ЭДС). Электрод сравнения – это электрод с постоянным потенциалом, нечувствительный к ионам раствора. Используют хлорсеребряный и каломельный электроды. Хлорсеребряный электрод – это серебряная проволока, покрытая слоем AgCl и помещенная в раствор KCl. Каломельный электрод состоит из металлической ртути, каломели (Hg2Cl2) и раствора KCl. Индикаторный электрод – это регирующий на концентрацию определяемых ионов электрод. Индикаторный электрод изменяет свой потенциал с изменением концентрации потенциал-определяющих ионов.
Кондуктометрия – основана на измерении удельной электропроводности исследуемого раствора (χ). Прямая кондуктометрия основана на том, что в области разбавленных растворов электропроводность растет с увеличением концентрации электролита. На практике используют метод градуировочного графика. В кондуктометрическом титровании измеряют электропроводность раствора после добавления небольших порций титранта и находят точку эквивалентности графическим методом с помощью кривой в координатах χ – V( титранта).
Электрогравиметрический анализ основан на использовании процесса электролиза, в результате которого определяемое вещество выделяется на одном из электродов в виде осадка, по массе которого рассчитывается исходная концентрация вещества. Расчеты основаны на законах Фарадея.
Кулонометрия – группа методов, основанных на измерении количества электричества, необходимого для электрохимического превращения определяемого вещества. В основе определения лежит закон Фарадея. Прямая кулонометрия основана на поддержании постоянства потенциала рабочего электрода на протяжении всего электрохимического процесса. Применяется для определения любых электрохимически активных веществ: катионов металлов, анионов, органических соединений. При кулонометрическом титровании титрант образуется в электролитической ячейке из добавленного в нее вещества в количестве, точно эквивалентном содержанию анализируемого вещества. Через анализируемый раствор пропускают постоянный ток до тех пор, пока индикатор не укажет завершение реакции. По количеству электричества рассчитывают содержание определяемого вещества.
Вльтамперометрия – основана на изучении поляризационных или вольтамперометричесих кривых (зависимостей силы тока от напряжения). Электролиз проводят с использованием легко поляризуемого электрода с небольшой поверхностью, на котором происходит электровосстановление или электроокисление.
Полярография – электролиз на ртутном капающем электроде и вольтамперометрия, связанная с использованием ртутного капающего электрода
