
- •Конспект лекций по дисциплине «Поверхностные физико-химические процессы»
- •Мариуполь - 2014 .
- •Введение.
- •2. Все адсорбционные места полагаются одинаковыми. В случае, если адсорбция осуществляется на некоторой поверхности, то это положение означает однородность поверхности.
- •3. Между адсорбированными молекулами отсутствует взаимодействие.
- •Интерметаллиды.
- •Упрочняющие фазы металлоидного типа.
- •Карбиды.
- •Принципы карбидообразования.
- •Нитриды.
- •Оксиды.
- •Рекомендуемая литература
- •Общие сведения о физической адсорбции и хемосорбции.
- •Адсорбция из раствора.
- •Смачивание и растекание.
Министерство образования и науки Украины
Приазовский государственный технический университет
Кафедра металлургии и технологии сварочного производства
Составитель: Алистратов В.Н.
Конспект лекций по дисциплине «Поверхностные физико-химические процессы»
галузь знань: 0505 – Машинобудування та матеріалообробка,
напрям підготовки: 6.050504– зварювання,
ОКР «бакалавр»
Мариуполь - 2014 .
СОДЕРЖАНИЕ
Стр.
Введение. 3
Модуль1. Поверхневі фізико-хімічні явища на межі фаз.
Физическое состояние поверхности материала. Пленки на металлах.
Геометрия неровностей поверхностного слоя. 4
Общие сведения о физической адсорбции и хемосорбции. 8
Основы теории физической адсорбции и хемосорбции. 11
Адсорбция из раствора 14
Смачивание и растекание. 16
Общие понятия диффузии. Законы диффузии. 21
Особенности процесов диффузии в условиях сварки плавлением. 25
Некоторые примеры диффузионных процессов при сварке. 28
Модуль 2. Поверхневі явища в умовах зварювання та споріднених
процесів.
Влияние поверхностных сил на процесс образования сварного
соединения. 28
Происхождение и строение поверхностных слоев 34
Служебные характеристики. 37
12. Конструкционная прочность и пути ее повышения. 38
13. Свойства интерметаллидных упрочняющих фаз. Карбиды.
14. Бориды. Нитриды. Оксиды. 44
15. Самораспространяющийся высокотемпературный синтез 45
Рекомендуемая литература 47
Введение.
Курс «Поверхностные физико-химические процесси» является общетехнической дисциплиной, которая знакомит с теоретическими основами процессов протекающих на границе фаз, а также основами получения заданих свойств поверхностей в условиях сварки и родственных процессов.
Граничные слои между двумя фазами, в которых межфазные или межмолекулярные силы не находятся в равновесии, образуют так называемые поверхностные области. Поскольку вещества могут находиться в одном из трех состояний, возможны следующие варианты граничных поверхностей: жидкость - газ, твердое тело - газ, твердое тело - жидкость, твердое тело - твердое тело, жидкость - жидкость. Свойства и поведение поверхности определяется и тем, что по одну сторону, и тем, что по другую сторону от нее, - это основное положение, на котором строится наука о поверхности. Физико-химические свойства поверхности раздела фаз резко отличаются от свойств внутренних частей системы. Подобное отличие имеет место на границе раздела жидкость - газ, в том числе на границе вода - воздух. Поведение расплавов металлов на границе с газовой или воздушной средой существенно определяет такие технологические процессы в металлургии, как разливка металла, литье, спекание в порошковой металлургии, пайку и металлизацию поверхности, использование жидких металлов как теплоносителей в энергетических установках и в других случаях. Между тем свойства поверхностей жидкостей - и воды, и металлов - подчиняется одним и тем же законам.
Проблема исследования поверхности является одной из центральных научных проблем материаловедения. Уровень знаний о структуре, составе и свойствах свободных поверхностей и поверхностей раздела, о процессах и явлениях, протекающих на этих поверхностях и составляющих содержание фундаментальных проблем физико-химии поверхности, обусловливает возможность успешного развития прикладных исследований по разработке новых материалов, созданию новых машин и приборов и технологических процессов.
В последние десятилетия установлено резко специфическое влияние и особая роль поверхностных слоев в процессах хрупкого и усталостного разрушения, ползучести, трения и износа, схватывания материалов и др. В работах А.Ф. Иоффе, А.В. Степанова, П.А. Ребиндера, Н.Н. Давиденкова, И.А. Одинга, И. Крамера, М.Х. Шоршорова, В.П. Алехина, А. Вествуда, Е. Махлина, Т. Судзуки, Е. Махерауха, К. Сумино и др. отмечается существенное влияние поверхности на величину и форму проявления предела текучести, а также на общий характер кривой напряжение - деформация и различные стадии деформационного упрочнения.
В мировом современном машиностроении сложилось приоритетное направление - поверхностное упрочнение и нанесение упрочняющих защитных покрытий, получившее общее наименование «инженерия поверхности» (surface engineering). Применение поверхностных упрочняющих технологий позволяет повысить долговечность деталей машин в 2... 100 раз, снижая при этом расход топлива, обеспечивая возможность интенсификации многих производственных процессов.
Одной из важнейших задач при обеспечении качества выпускаемых и ремонтируемых машин является повышение эксплуатационных показателей их качества. Эти показатели в значительной мере определяются параметрами качества поверхностного слоя. Это подтверждается и тем, что до 70% и более причин выхода из строя машин и механизмов связано с изнашиванием их деталей. Особенно велик износ деталей и рабочих органов машин, которые эксплуатируются в абразивной и агрессивной средах. Например, зубья ковшей экскаваторов, ножи скреперов и бульдозеров работают 3…6 месяцев.
Наглядным примером служат прокатные валки. Валки горячей прокатки в работе подвержены разнообразным по характеру и величине воздействиям: нагреваются от прокатываемого металла и охлаждаются водой и воздухом, испытывают большие удельные давления и напряжения от изгиба и кручения и др. Работа валков в таких условиях приводит к их износу, который проявляется в искажении формы рабочей поверхности бочки валка или калибра, в уменьшении диаметра и образовании сетки трещин с последовательным выкрашиванием частиц поверхностного слоя. Определение основных причин, вызывающих разрушение рабочей поверхности, позволит прогнозировать долговечность и надежность прокатных валков при работе в условиях термоциклического воздействия, а также наметить пути эффективного повышения их стойкости. Внедрение упрочняющих технологий позволит решать сложные вопросы повышения устойчивости процесса прокатки за счет обеспечения условий равноизнашивания валков по длине бочки.
Модуль1. Поверхневі фізико-хімічні явища на межі фаз.
Лекции 1-4. Основы теории физической адсорбции и хемосорбции.
Лекция 1. Физическое состояние поверхности материала. Пленки на металлах.
Геометрия неровностей поверхностного слоя.
Физическое состояние поверхности материала.
Наружный слой детали с измененными - структурой, фазовым и химическим составом, по сравнению с основным металлом, из которого изготовлена деталь, называется поверхностным слоем. Внешняя поверхность слоя граничит с окружающей средой или с сопряженной деталью.
Поверхностный слой металла обладает большой активностью. Это обусловлено тем, что внутри твердого тела каждый атом кристалла окружен другими атомами и связан с ними прочно по всем направлениям, а у атомов, расположенных на поверхности, нет с внешней стороны «соседей». Поэтому в поверхностном слое у атомов остаются свободные связи, наличие которых создает атомное (молекулярное) притяжение. Поверхностные атомы вследствие наличия свободных связей, обладают большей энергией, нежели атомы внутри тела. Этот избыток энергии называется поверхностной энергией и она тем больше, чем больше площадь свободной поверхности.
Взаимосвязь поверхностного слоя с физико-химическими и эксплуатационными свойствами детали показана на рис.1.1. Поверхностный слой неоднороден по строению - рис. 1.2.
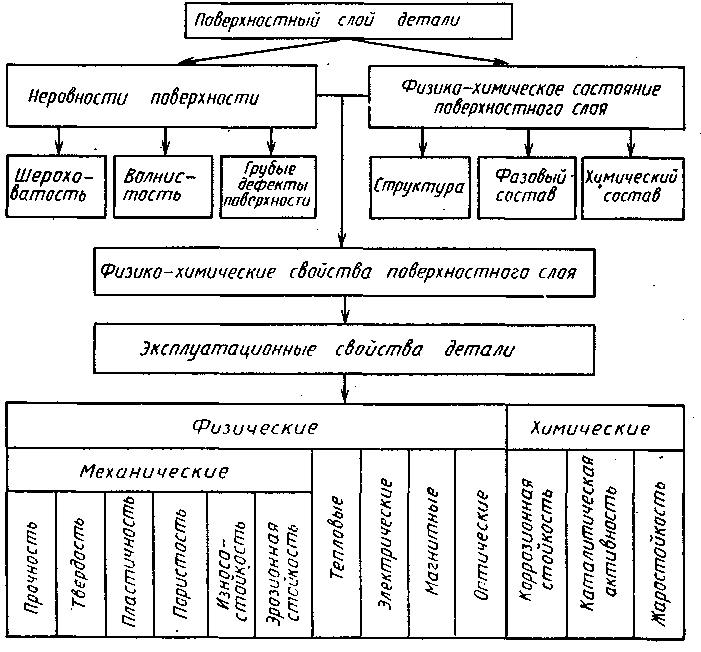
Рис 1.1 Взаимосвязь поверхностного слоя с эксплуатационными свойствами деталей.
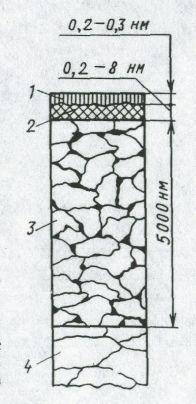
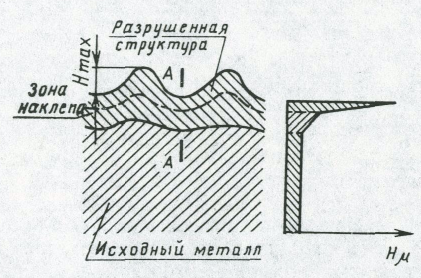
Рис. 1.1 – Структура поверхностного слоя детали из углеродистой стали.
Граничный слой 1 состоит из адсорбированной пленки газов, влаги и смазочно-охлаждающей жидкости. Слой 2 – деформированный, сильно раздробленный металл, с обезуглероженными участками; в нем находятся оксиды, нитриды, пустоты, надрывы и трещины. Слой 3 состоит из зерен, деформированных под действием рабочего инструмента; в нем содержится структурно свободный цементит, образовавшийся под действием высоких температур. Слой 4 – металл с исходной структурой.
Качество поверхности определяется: геометрией поверхности, остаточными напряжениями, структурой и служебными характеристиками. Глубина поверхностного слоя и качество поверхности зависят от основного материала, вида обработки, основных параметров инструмента, режима обработки и рода смазочно-охлаждающей жидкости.
Качество поверхности деталей машин влияет на такие их служебные свойства, как сопротивление усталости, износо-, коррозие-, и эрозионную стойкость.
Пленки на металлах
Продукт взаимодействия кислорода с металлом — оксид образует на поверхности металла оксидную (окисную) пленку, которая снижает его химическую активность.
В зависимости от толщины пленки на металлах принято подразделять на:
а) тонкие (невидимые) толщиной от мономолекулярного слоя до 40 нм;
б) средние (видимые как цвета побежалости), имеющие толщину 40—500 нм;
в) толстые (видимые) толщиной более 500 нм.
Для определения толщины, структуры и свойств оксидных пленок используют различные современные методы, в том числе интерференционные, рентгенографию, электронную микроскопию и др.
Оксидные пленки могут быть сплошными либо несплошными. Пиллинг и Бедвортс сформулировали условие, при котором образуются сплошные пленки, способные препятствовать дальнейшему окислению металла.
Условие сплошности состоит в том, что молекулярный объем оксида должен быть больше объема металла, израсходованного на образование молекулы оксида, иначе оксида не хватит, чтобы покрыть металл сплошным слоем. Следовательно, обозначив молекулярный объем оксида Vок, а объем металла, из которого образовалась молекула оксида, Vме, можно записать:
при Vок / Vме >1 образуется сплошная пленка;
при Vок / Vме <1 пленка не получается сплошной.
Значения указанного соотношения для некоторых оксидов металлов таковы: К2О 0,48; СаО 0,63; А12О3 1,31; Сг2О3 2,02; FeO 1,77; Fe3O4 2,09; Fe2O3 2,14; Nb2O5 2,81; WO3 3,36; МоОз 3,45.
В реальных условиях, когда Vок / Vме » 1, может происходить такое возрастание внутренних напряжений, которое приводит к вспучиванию и отслаиванию пленки, что обусловливает снижение ее защитных свойств. Оптимальное соотношение Vок / Vме должно быть в определенных пределах: 2,5 > Vок / Vме > 1.
Если исключить адсорбированную пленку, то поверхностных слой состоит из наружного, очень тонкого слоя разрушенных зерен металла и наклепанного слоя. Упрочнение поверхностного слоя можно оценить путем замера микротвердости по сравнению с исходной. Толщина упрочненного слоя может достигать 0,2…2,0 мм.
Геометрия неровностей поверхностного слоя.
Идеально правильную поверхность нельзя получить с помощью какого-либо метода обработки. Всякое реальное тело имеет отклонения от идеальной геометрической формы, именуемые погрешностями. Реальная поверхность детали несовершенна: суждение о степени несовершенства зависит от масштаба рассмотрения. Можно рассматривать отклонения от геометрической правильности поверхности макро-, микро- и субмикроскопического порядка.
Макрогеометрические отклонения рассматриваются на больших участках реальной поверхности детали (они характеризуют ее точность), микрогеометрические отклонения — на малых участках реальной поверхности с длиной стороны квадрата 10-2... 101 мм. Совокупность неровностей поверхности на этой длине принято называть шероховатостью поверхности. Субмикроскопические неровности рассматривают на участках поверхности с размером стороны квадрата 1…10 мкм. Геометрические несовершенства этой области определяются молекулярной структурой поверхности.
Например, круговой цилиндр может иметь: овальность, огранку, бочкообразность, конусность, криволинейность оси. У плоских поверхностей возможны выпуклость, вогнутость и т.п. Возникновение таких погрешностей происходит в основном из-за неточностей станка, на котором происходит обработка детали.
Под волнистостью поверхности понимают совокупность более или менее повторяющихся возвышений и впадин с шагом волны, значительно превышающим ее высоту. Волнистость в направлении главного движения при резании называют продольной, а в перпендикулярном направлении – поперечной. От шероховатости волнистость поверхности отличается значительно большим шагом: нередко бывает, что высота волны при чистовом точении доходит до 15 мкм при шаге до 14 мм. Волнистость определяется в перпендикулярном сечении поверхностей, исключая при этом шероховатость и отклонения геометрической формы. Волнистость может образоваться на поверхности детали при изготовлении (технологическая волнистость) вследствие вибраций из-за недостаточной жесткости системы станок — приспособление — инструмент — заготовка, геометрических, кинематических и динамических погрешностей процесса обработки и в процессе эксплуатации машины (эксплуатационная волнистость).
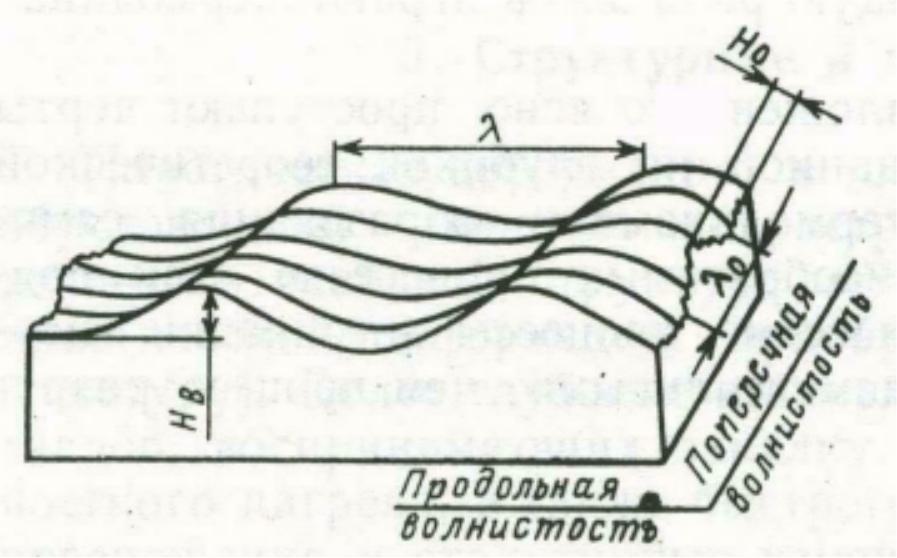
l – шаг волны;
HВ – высота волны.
Рис. 1.3 – Схема волнистости поверхности.
Реальная поверхность не является гладкой, она имеет неровности: выступы и впадины с относительно малым расстоянием между ними. Шероховатость поверхности — это совокупность неровностей с относительно малыми шагами, образующих рельеф поверхности. Шероховатость является следствием наличия зазубрин на кромке резца металлорежущего инструмента. Также как и волнистость, она может быть продольной и поперечной. Шероховатость – размерная характеристика. ГОСТ предусматривает шесть параметров, характеризующих шероховатость поверхности: три высотных – Ra, Rz и Rmax, два шаговых – S и Sm и относительная опорная длина профиля tp. Все эти характеристики можно определить, имея профилограмму поверхности, представляющую собой поперечное сечение поверхности. Одна из таких профилограмм представлена на рисунке 1.4.
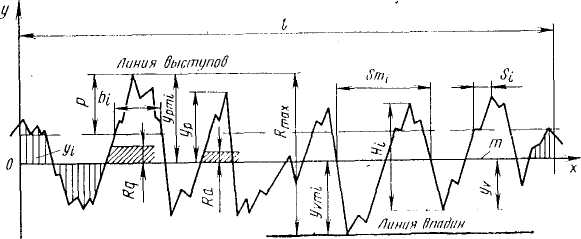
Рис. 1.4 – Параметры шероховатости поверхности
Шероховатость обработанной поверхности обусловлена не только геометрией процесса резания, а и пластическими деформациями материала при этом процессе, и вибрацией инструмента. Например, при точении пластичных материалов наблюдается следующее. При скоростях резания 1…2 м/мин образуется стружка скалывания. Она легко отделяется при малом тепловыделении и без заметной пластической деформации обработанной поверхности. Микронеровности незначительны, а форма их впадин близка к форме вершины резца. При увеличении скорости резания до 20…30 м/мин изменяется характер стружкообразования и шероховатость поверхности возрастает. Рост скорости резания сопровождается повышением температуры в зоне резания и значительным давлением. Это давление вызывает пластическое течение, как в отделяемом металле, так и в заготовке выше и ниже линии реза (Рис 1.5).
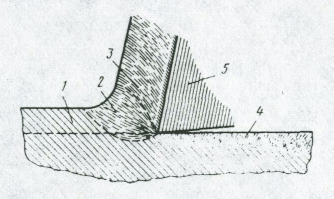
1 – основная структура обрабатываемого металла;
2 – зона пластической деформации;
3 – стружка;
4 – пластически деформированный поверхностный слой;
5 – инструмент (резец).
Рис 1.5 – Образование деформированного слоя
В процессе резания стружка обтекает вершину резца. Наиболее удаленный от резца слой стружки имеет скорость, близкую к скорости резания, а слой, непосредственно соприкасающийся с передней гранью резца, подвержен сильному тормозящему действию сил трения. В итоге слои, наиболее близкие к передней грани резца, прилипают к ней, и образуют застойную зону или нарост на лезвии инструмента. Металл начинает течь по наросту. В процессе резания к наросту привариваются новые слои, пока он не достигнет максимально возможных размеров в данных условиях. Вершина нароста, выступая впереди лезвия инструмента, режет металл, оставляя глубокие борозды на обрабатываемой поверхности. Время от времени вершина нароста обламывается и уносится частично со стружкой, а частично вдавливается в обработанную поверхность. Далее процесс образования нароста повторяется. Для углеродистой стали нарост имеет максимальную высоту и стойкость при температуре около 200°С. При превышении этой температуры прочность нароста снижается и он разрушается при меньшей высоте. При скорости резания более 80 м/мин нарост не образуется (Рис. 1.6).
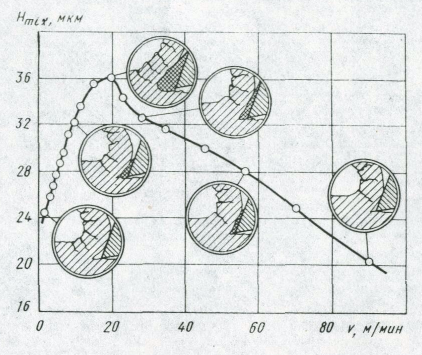
Рис. 1.6 – Высота неровностей в зависимости от скорости резания стали 45.
Отсутствие нароста не означает, что действительный профиль обработанной поверхности будет совпадать с теоретическим. Пластическое течение материала в зоне резания вызывает дополнительное увеличение высот неровностей. Кроме того, перемещение задней грани инструмента по свежеобразованной поверхности, не успевшей покрыться слоем оксидов, сопровождается задирами, играющими существенную роль в образовании дополнительных неровностей. Таким образом, при механической обработке деталей в их поверхностном слое происходят изменения механических свойств и структуры металла под давлением режущего инструмента и под влиянием выделяющейся теплоты. Кроме того, в деталях развиваются остаточные напряжения. [1]
Лекция 2. Общие сведения о физической адсорбции и хемосорбции.
В большинстве случаев поверхности твердых тел не являются атомарно чистыми. Они покрыты слоями оксидов или других видов пленок, возникающих при взаимодействии с окружающей средой вследствие физической или химической адсорбции. Под окружающей средой подразумевается либо обычная атмосфера, либо специально созданная среда, например, смазочный материал.
Поверхность кристалла, полученная путем его раскалывания или нагревания при достаточно высоких температурах в сверхвысоком вакууме (для десорбции имевшегося адсорбционного слоя) вначале является чистой. Однако далее поверхность в присутствии газовой атмосферы адсорбирует атомы или молекулы из окружающей среды. В результате образуется моно - или полиатомное или же молекулярное покрытие.
Адсорбция - это частный случай сорбции, которая объединяет и поверхностное поглощение - адсорбцию, и объемное поглощение вещества жидкостью или твердым телом - абсорбцию. Адсорбция происходит на границе фаз и характеризуется различной концентрацией составляющих одной из фаз в ПС и в глубине этой фазы (рис. 2.1). Если в ПС молекул одной составляющей больше, чем внутри фазы, то имеет место положительная адсорбция, в противном случае - отрицательная адсорбция, например адсорбция газа или жидкости на поверхности твердого тела, на которой существует поле сил, зависящее от его химического строения. При соприкосновении поверхности твердого тела с молекулами окружающего его газа или жидкости в результате взаимодействия молекулы газовой (или жидкой) фазы приклеиваются к поверхности твердого тела.
Твердое тело, на котором адсорбируются молекулы, называется адсорбентом. Вещество, адсорбированное на адсорбенте, называется адсорбатом. Процесс обратный адсорбции, т.е. освобождение адсорбированных молекул, называется десорбцией.
Если адсорбат десорбируется с поверхности твердого тела растворителем, то этот процесс называется элюированием, а растворитель, вымывающий адсорбат, - элюентом.
Адсорбция газов может возникать под действием молекулярных сил, вызывающих отклонения от законов идеальных газов и явление конденсации. Этот тип адсорбции часто называют молекулярной, или адсорбцией Ван-дер-Ваальса. Присоединение молекул к поверхности межмолекулярными (ван-дер-ваальсовыми) силами называется физической адсорбцией, а химическое соединение молекул с поверхностью - хемосорбцией. Химическая адсорбция (хемосорбция) вызывается силами химического сродства. Адсорбирующееся вещество (адсорбат) образует при этом поверхностные соединения. При химической адсорбции имеет место обмен электронами между адсорбирующей молекулой и адсорбентом (энергия связи более 1 эВ). Часто скорость химической адсорбции мала при низкой температуре и растет с температурой. Это связано с тем, что процесс взаимодействия между молекулами газа и атомами поверхности твердого тела характеризуется активационным барьером. Химическую адсорбцию рассматриваемого типа часто называют активированной.
Оба эти вида адсорбции нельзя резко отделить друг от друга, т.к. они взаимосвязаны. Адсорбционные процессы можно охарактеризовать путем определения изотерм адсорбции. Под изотермой адсорбции понимают зависимость количества адсорбированного вещества от давления газа или пара (или от концентрации растворенного вещества при адсорбции из раствора) при постоянной температуре. Существование процесса адсорбции можно доказать экспериментально, определяя, например, убыль объема газовой фазы над поверхностью твердого тела волюмометрическим методом или увеличение массы адсорбирующего вещества с помощью взвешивания. Применяют также измерения проводимости.
При физической адсорбции молекулы адсорбата ВС охраняют свою индивидуальность, а силы, ответственные за адсорбцию, аналогичны ван-дер-ваальсовым силам в реальных газах. При химической адсорбции адсорбируемая молекула образует химическое соединение с твердым телом ABC (рис. 2.1, а) благодаря силам обменного взаимодействия, включающим в себя в той или иной мере ионное взаимодействие. Двум видам взаимодействия соответствуют различные кривые потенциальной энергии U(x). Кривая 2 на рис. 2.1, а характеризует ван-дер-ваальсову физическую адсорбцию, а кривая 1, обладающая более глубоким минимумом, - химическую адсорбцию. Равновесное расстояние хг, определяющее положение минимума потенциальной энергии, при физической адсорбции всегда больше х». Пересечение кривых 1 и 2 приводит к образованию потенциального барьера, высота которого часто отождествляется с энергией активации.
При повышении температуры физическая адсорбция может схематически переходить в хемосорбцию, если тепловая энергия к0Т > ∆u. Схематически это показано на рис. 2.1, б. При низких температурах изобара V(t) описывает физическую адсорбцию, когда количество (объем) адсорбированного газа уменьшается с ростом температуры. При несколько более высоких температурах количество адсорбированного газа увеличивается, т.к. начинается хемосорбция, но затем вновь падает. Адсорбция в области 1обратима, а в области 2 необратима, при охлаждении процесс переходит из области 3 в область 4.
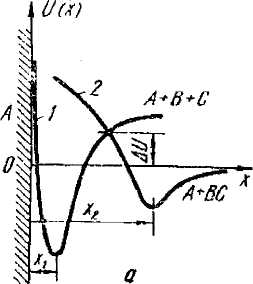
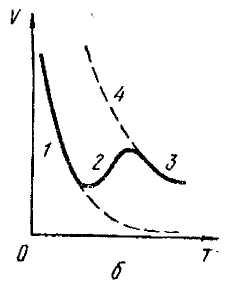
Рис. 2.1. Кривые потенциальной энергии системы адсорбент-молекулы ВС (а) и изобара (б) реакции на поверхности
Принципиальное значение для процесса адсорбции на чистой поверхности металлов имеет факт существования газа свободных электронов. Неравномерность распределения электронов вблизи поверхности связана с особенностями их движения, в частности с эмиссией электронов с поверхности. Эмиссия приводит к обеднению приповерхностных слоев электронами и возникновению двойного электрического слоя (рис. 2.2). При этом у свободной поверхности образуется область отрицательного заряда, а в приповерхностном объеме материала - положительного. Фактически можно говорить о возникновении электрических диполей. Взаимодействие адсорбирующейся молекулы с двойным электрическим слоем обусловливает физическую адсорбцию. Оно носит название ван-дер-ваальсового взаимодействия и характеризуется небольшой энергией связи.
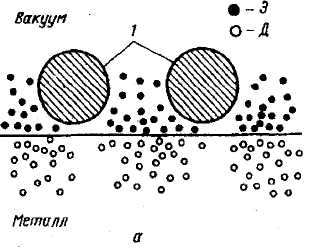
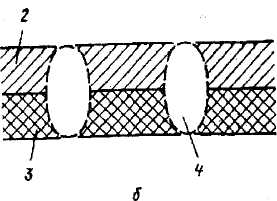
Рис. 2.2 . Схема распределения электронов в приповерхностных слоях металла при физической адсорбции молекул: а - схема физической адсорбции: 1 - адсорбированные молекулы; Э - электроны; Д - дырки; б - распределение заряда у поверхности: 2 - отрицательно заряженный слой; 3 - положительно заряженный слой; 4 - воображаемый диполь
Адсорбция - динамический обратный процесс, т.е. молекулы адсорбата не навсегда связаны с поверхностью адсорбента, а подвергаются непрерывному обмену с молекулами газовой фазы. При адсорбционном равновесии количество молекул, оседающих на поверхности в единицу времени, равно количеству молекул, переходящих в газовую фазу. В результате количество молекул на поверхности остается постоянным.
Для физической адсорбции характерны легкая обратимость процесса адсорбции (десорбция) и заменяемость уже имеющегося адсорбционного слоя другим газом (обменная адсорбция). Причем газ на данной кристаллической поверхности адсорбируется тем легче, чем выше его точка кипения, т.е. чем легче он превращается в жидкость. Например, имеющийся адсорбционный слой водорода, азота или окиси углерода очень легко может быть вытеснен молекулами СО2 или некоторыми углеводородами. По той же причине инертные газы проявляют очень слабую склонность к адсорбции или она совершенно отсутствует. Легкая адсорбируемость газов с высокой точкой кипения может быть доказана экспериментально. Если в вакууме или в атмосфере инертного газа изготовляется активный (пирофорный) железный порошок и его выставляют на воздух, то он самопроизвольно сгорает. Если же на порошке железа предварительно адсорбируют углекислый газ СО2, то последующая реакция с кислородом или не идет или ослабляется.
Обычно молекула адсорбата на некоторое время задерживается на поверхности адсорбента. Поэтому поверхность всегда (по крайней мере, частично) покрыта слоем адсорбата. Толщина слоя адсорбата растет с увеличением среднего пребывания молекул на поверхности, которое зависит от сил взаимодействия между поверхностью и прилегающими к ней молекулами.
Для частиц, расположенных в ПС, характерна нескомпенсированность связей, поэтому частицы, расположенные на поверхности, обладают сильной адсорбционной способностью. Молекулы воздуха (адсорбата), находящиеся в хаотическом тепловом движении и при обычных температурах обладающие значительными скоростями, приближаясь к поверхности твердого тела (адсорбента) на достаточно близкое, сравнимое с радиусом межмолекулярных взаимодействий расстояние, притягиваются к ней. Если угол между траекторией движения молекулы и перпендикуляром к поверхности в точке соприкосновения ее с поверхностью твердого тела (угол падения) достаточно велик, то есть нормальная составляющая скорости движения молекулы невелика, то молекула остается в поле поверхностных сил (адсорбируется на поверхности твердого тела). Если угол падения мал, то молекула подходит к поверхности твердого тела, как бы прилипает к ней, а затем отскакивает от нее. Скорость отскока зависит от скорости, с которой подходит молекула, и температуры поверхности твердого тела. При физической адсорбции проявляются только межмолекулярные взаимодействия и молекулы адсорбата сохраняют свою индивидуальность. Физическая адсорбция является обратимой. Наряду с адсорбцией происходит десорбция молекул, которые в результате тепловых или иных процессов уходят с поверхности твердого тела. В течение определенного промежутка времени между адсорбцией и десорбцией наступает динамическое равновесие. Это время зависит от давления газов и паров над поверхностью твердого тела и обычно составляет 10-10 ...10-5 с. При обычном атмосферном давлении на поверхности твердого тела, помещенного в воздушную или иную газовую среду, мгновенно возникают пленки адсорбируемых молекул. При очень низком давлении равновесное состояние достигается за несколько часов. В газовых смесях в адсорбированных слоях наблюдается перераспределение молекул. Наиболее активные сильно адсорбирующиеся молекулы вытесняют с поверхности твердого тела слабо адсорбирующиеся.
Адсорбция молекул приводит к уменьшению поверхностной энергии. В результате этого в окружающую среду выделяется некоторое количество энергии, называемое энергией адсорбции, следовательно, адсорбция - изотермический процесс. Теплота физической адсорбции примерно равна теплоте конденсации адсорбата (обычно меньше 41,8 Дж/моль). Теплота хемосорбции может достигать 627 Дж/моль.
Измерение величины адсорбции газов на твердом адсорбенте может проводиться двумя группами методов - статическими и динамическими. В статических методах изучается равновесие неподвижной системы газ - адсорбент. В динамических методах смесь изучаемого и мало адсорбирующегося газа (например, гелия) пропускается через слой адсорбента.
Теплота адсорбции газа на твердом адсорбенте всегда положительна. Поэтому в соответствии с требованиями термодинамики равновесное значение адсорбированного количества всегда падает с ростом температуры. Молекулярная адсорбция в соответствии с этим всегда уменьшается с ростом температуры при постоянном давлении. В случае активированной адсорбции имеют место более сложные соотношения. На рис. 2.3 схематически показана изобара адсорбции для случая, когда протекают
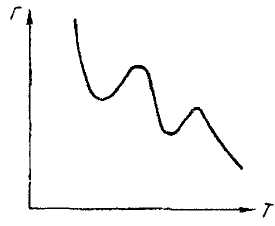
Рис. 2.3. Изобара адсорбции для случая активированной адсорбции
активированные процессы. При низкой температуре с ее возрастанием падает величина адсорбции. Адсорбция при этом является молекулярной. Химическая активированная адсорбция при этих температурах не осуществляется из-за медленности процесса, хотя равновесие для этого процесса сдвинуто в сторону адсорбции. При повышении температуры скорость химической адсорбции и ее величина, пройдя через минимум, начинают возрастать. Это возрастание вызвано тем, что при измерении не достигается равновесия. Однако при повышении температуры убывание равновесной величины адсорбции вызовет падение адсорбции и появление максимума Г. При дальнейшем повышении температуры может начаться химический процесс с большей энергией активации, что вызывает появление нового максимума Г. Наличие такого рода максимумов свидетельствует об участии в адсорбции активированных процессов. Такие максимумы имеются, например, для случаев адсорбции кислорода на угле и металлах, азота - на железе. Активированная адсорбция имеет особое значение для гетерогенного катализа.
Химическая адсорбция не всегда бывает активированной и ее скорость может быть достаточно велика при низких температурах. Так, адсорбция непредельных органических соединений, например этилена, на алюмогеле и силикагеле либо адсорбция окиси углерода на дегидратированных алюмосиликатах (так называемые молекулярные сита) являются примерами химической неактивированной адсорбции, протекающей достаточно быстро при низких температурах.
Процесс адсорбции развивается последовательно, по мере убывания энергетического уровня поверхности. Адсорбция начинается прежде всего на тех участках поверхности, энергия которых максимальна. Такими участками являются вершины, углы, ребра или в широком смысле - активные центры. Только когда эти предпочтительные в энергетическом отношении места адсорбции будут насыщены, начнется адсорбция на плоских участках поверхности, на которых при адсорбции высвобождается меньшее количество энергии. Здесь происходит взаимодействие между адсорбированными атомами или молекулами.
Незначительная величина энтальпии при физической адсорбции (около 10 ккал/моль) указывает на низкую энергию взаимодействия между адсорбированными атомами и поверхностью кристалла. Поэтому физическая адсорбция не является специфической для поверхности кристаллов, т.е. количества газа, адсорбированные на различных гранях кристалла, сравнимы между собой.
Если трущиеся поверхности разделены адсорбционными слоями, то не будет происходить металлического контактирования металлов, что обусловит низкий коэффициент трения и малый износ. Наличие оксидных и различных адсорбционных пленок резко снижает прочность образовавшихся «мостиков» схватывания.
Адсорбция влияет на структуру тонкого поверхностного слоя и ряд свойств, таких, как модуль упругости, параметр кристаллической решетки и его прочность. Эта совокупность явлений иногда называют эффектом силового поля. [2]
Лекция 3. Основы теории физической адсорбции и хемосорбции.
Теория адсорбции Лангмюра
Интенсивность процесса адсорбции оценивается количеством (объемом или массой) адсорбированного вещества. Процесс адсорбции можно рассматривать во времени, определяя время, необходимое для адсорбции некоторого количества вещества. При адсорбции газообразного вещества на твердом адсорбенте объем адсорбированного вещества зависит от давления газа р и температуры Т (для смеси газов р - парциальное давление).
Классический метод изучения адсорбции заключается в установлении зависимости между количеством адсорбированного газа, температурой и давлением. Обычно при исследовании адсорбции поддерживают постоянную температуру и по форме полученных изотерм V(p) судят о характере адсорбции.
По Фрейндлиху объем адсорбированного вещества
Vadc = kp п (3.1)
где к, п — константы; р - давление газа (парциальное давление). Значение п лежит в пределах 0,1- 0,9, оно возрастает с увеличением температуры, стремясь к единице. Значение к изменяется в зависимости от вида адсорбента и адсорбата.
Ограниченность числа адсорбционных центров при любом виде адсорбции должна приводить к адсорбционному насыщению, т.е. величина адсорбции при повышении давления не может неограниченно возрастать, а должна стремиться к некоторому пределу. Это стремление к пределу выражено в теории адсорбции Лангмюра (1916 г.). В основе этой теории лежат три положения.
1. Адсорбент представляет для адсорбата ограниченное число независимых адсорбционных мест. В каждом месте может адсорбироваться одна молекула. Такие места могут существовать и при химической и при молекулярной адсорбции. В первом случае это отдельные ненасыщенные валентности поверхностных атомов адсорбента, во втором - это площадки на поверхности или «пещерки» внутри адсорбента. Независимость мест означает, что адсорбция на одном месте не изменяет условия адсорбции на другом. Ж. Ленгмюр предположил, что на поверхности может образоваться только мономолекулярный слой адсорбированного вещества, потому что поле поверхностных сил имеет слишком маленький радиус действия, чтобы удерживать мультимолекулярный слой. Место во втором слое не может быть заполнено, если не заполнено соответствующее место в первом слое.
