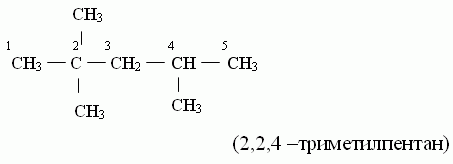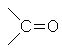- •1. Предельные углеводороды
- •1.1. Насыщнные неразветвленные соединения
- •1.1.1. Одновалентные радикалы
- •1.2. Насыщенные разветвленные соединения с одним заместителем
- •1.3. Насыщенные разветвлнные соединения с несколькими заместителями
- •Урок 7. Классификация и номенклатура органических соединений (2-3 часа)
- •Названия неразветвленных алканов
- •Самостоятельная работа. Номенклатура алканов
- •1. Классификация органических соединений.
- •2. Номенклатура органических соединений.
- •3. Структурная изомерия.
Классификация и номенклатура органических соединений.
1. Правила и особенности классификации: В основе классификации лежит структура органических соединений. Основа описания структуры — структурная формула. Атомы элементов обозначаются латинскими символами, как они обозначены в периодической таблице химических элементов (таблице Менделеева). Ковалентные связи обозначаются прямой чертой, количество связей характеризуется валентностью элементов. Водородные и электронодефицитные связи обозначаются пунктирной линией, ионные связи обозначаются указанием зарядов частиц, входящих в состав молекулы. Поскольку в подавляющее большинство органических молекул входит водород, его обычно не обозначают при изображении структуры. Таким образом, если в структуре у одного из атомов изображена недостаточная валентность, значит, возле этого атома расположен один или несколько атомов водорода. Атомы могут образовывать циклические и ароматические системы. 2. Основные классы органических соединений: Углеводороды — соединения, состоящие только из атомов углерода и водорода. Они в свою очередь делятся на: o Насыщенные — максимальное количество атомов водорода на один атом углерода. o Ненасыщенные — имеют в своем составе хотя бы одну двойную и/или тройную связь. o С открытой цепью o С замкнутой цепью — содержат цикл К ним относятся алканы, алкены, алкины, диены, циклоалканы, арены. Соединения с гетероатомами в функциональных группах — соединения, в которых углеродный радикал R связан с функциональной группой. По характеру функциональных групп делятся на: o Галогенсодержащие o Спирты, фенолы o Простые эфиры (этеры) o Сложные эфиры (эстеры) o Соединения, содержащие карбонильную группу Альдегиды Кетоны Хиноны o Соединения, содержащие карбоксильную группу (Карбоновые кислоты, сложные эфиры) o Серосодержащие соединения o Азотсодержащие соединения o Металлоорганические соединения Гетероциклические — содержат гетероатомы в составе кольца. Различаются по числу атомов в цикле, по виду гетероатома, по количеству гетероатомов в цикле. Органического происхождения — как правило соединения очень сложной структуры, зачастую принадлежат сразу к нескольким классам органических веществ, часто полимеры. Из-за этого их сложно классифицировать и их выделяют в отдельный класс веществ. Полимеры — вещества очень большой молекулярной массы, которые состоят из периодически повторяющихся фрагментов — мономеров. |
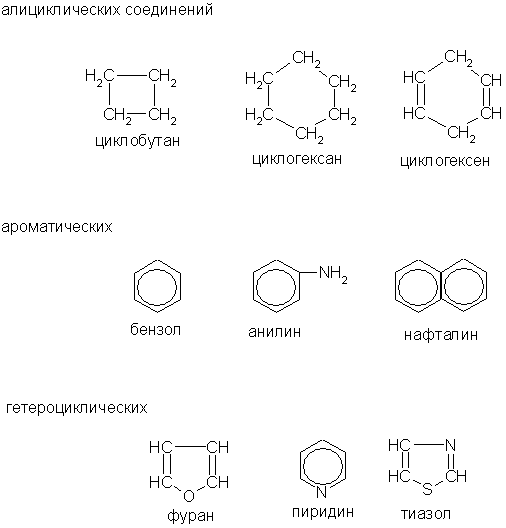
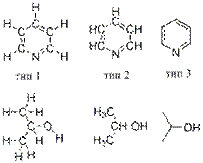
Все органические соединения в зависимости от природы углеродного скелета можно разделить на ациклические и циклические.
Ациклические (нециклические, цепные) соединения называют также жирными или алифатическими. Эти названия связаны с тем, что одними из первых хорошо изученных соединений такого типа были природные жиры. Среди ациклических соединений различают предельные, например:
CH3 - CH3 этан |
|
|
||||||||||||||||||||||||||||||||||||||||||
и непредельные, например:
CH2 = CH2 |
CH ≡ CH |
|
|||||||||||||||
этилен |
ацетилен |
изопрен |
|
|
Среди циклических соединений обычно выделяют карбо-циклические, молекулы которых содержат кольца из углеродных атомов, и гетероциклические, кольца которых содержат кроме углерода атомы других элементов (кислорода, серы, азота и др.).
Карбоциклические соединения подразделяются на алициклические (предельные и непредельные), похожие по свойствам на алифатические, и ароматические, которые содержат бензольные кольца.
Примеры
Рассмотренную классификацию органических соединений можно представить в виде краткой схемы
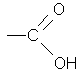
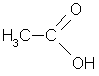
В состав многих органических соединений кроме углерода и водорода входят и другие элементы, причем в виде функциональных групп - групп атомов, определяющих химические свойства данного класса соединений. Наличие этих групп позволяет подразделить указанные выше типы органических соединений на классы и облегчить их изучение. Некоторые наиболее характерные функциональные группы и соответствующие им классы соединений приведены в таблице
Функциональная группа |
Название группы |
Классы соединений |
пример |
-OH
|
Гидроксид Карбонил |
Спирты |
C2H5OH Этиловый спирт |
Фенолы
Альдегиды |
фенол
уксусный альдегид |
||
кетоны |
ацетон |
||
|
Карбоксил |
Карбоновые кислоты |
уксусная кислота |
-NO2 |
Нитрогруппа |
Нитросоединения |
CH3NO2 Нитрометпн |
-NH2 |
Аминогруппа |
Первичные амины |
анилин |
|
Амидогруппа |
Амиды кислот |
амид уксусной кислоты |
-F, -Cl, -Br, -I |
Галогены |
Галогенопроиз-водные |
CH3Cl Хлористый метил |
В состав молекул органических соединений могут входить две или более одинаковых или различных функциональных групп, например:
CH2OH |
|
NH2CH2 - COOH |
|||
| |
|
аминоуксусная кислота |
|||
CHOH |
|
|
|||
| |
|
|
|||
CH2OH |
|
|
|||
глицерин |
|
|
|||
|
Органические вещества |
|
|||
|
Углеводороды |
Алканы · Алкены · Арены · Алкины · Диены · Циклоалканы |
|
||
|
Кислородсодержащие |
Спирты · Простые эфиры · Альдегиды · Кетоны · Кетены · Карбоновые кислоты · Сложные эфиры · Ортоэфиры · Углеводы · Жиры · Хиноны · Фенолы · Енолы · Оксикислоты · Оксокислоты |
|
||
|
Азотсодержащие |
Амины · Окиси аминов · Амиды · Гидразиды · Нитросоединения · Нитрозосоединения · Оксимы · Нитрилы · Изонитрилы · Аминокислоты · Белки · Пептиды |
|
||
|
Серосодержащие |
Меркаптаны · Тиоэфиры · Сложные тиоэфиры · Дисульфиды · Сульфокислоты · Тиоальдегиды · Тиокетоны · Тиокарбоновые кислоты |
|
||
|
Фосфорсодержащие |
Фосфины · Фосфонистые кислоты · Фосфиновые кислоты · Фосфоновые кислоты · Нуклеиновая кислота · Нуклеотиды |
|
||
|
Галогенорганические |
Фторорганические соединения · Хлорорганические соединения · Броморганические соединения · Иодорганические соединения |
|
||
|
Кремнийорганические |
Силаны · Силазаны · Силтианы · Силоксаны · Силиконы |
|
||
|
Элементоорганические |
Германийорганические · Борорганические · Оловоорганические · Свинецорганические · Алюминийорганические · Ртутьорганические · Другие металлоорганические |
|
||
|
Другие важные классы |
Галогенуглеводороды · Гетероциклические соединения · Перфторуглеводороды |
|
||
Содержание 1. Введение 2. Классификация органических соединений 3. Виды связи 4. Структурные формулы 5. Специфические свойства органических соединений 6. Изомерия Введение Трудно представить прогресс в какой бы то ни было области хозяйства без химии – в частности, без органической химии. Все сферы хозяйства связаны с современной химической наукой и технологией. Органическая химия изучает вещества, содержащие в своем составе углерод, за исключением окиси углерода, углекислого газа и солей угольной кислоты (эти соединения по свойствам ближе к неорганическим соединениям). Как наука органическая химия до середины XVIII века не существовала. К тому времени различали три вида химии: химию животных, растительную и минеральную. Химия животных изучала вещества, входящие в состав животных организмов; растительная – вещества, входящие в состав растений; минеральная – вещества, входящие в состав неживой природы. Этот принцип, однако, не позволял отделить органические вещества от неорганических. Например, янтарная кислота относилась к группе минеральных веществ, так как ее получали перегонкой ископаемого янтаря, поташ входил в группу растительных веществ, а фосфат кальция – в группу животных веществ, так как их получали прокаливанием соответственно растительных (древесина) и животных (кости) материалов. В первой половине XIX века было предложено выделить соединения углерода в самостоятельную химическую дисциплину – органическую химию. Среди ученых в то время господствовало виталистическое мировоззрение, согласно которому органические соединения образуются только в живом организме под влиянием особой, сверхъестественной "жизненной силы". Это означало, что получить органические вещества путем синтеза из неорганических невозможно, что между органическими и неорганическими соединениями лежит непреодолимая пропасть. Витализм настолько укрепился в умах ученых, что долгое время не предпринималось никаких попыток синтеза органических веществ. Однако витализм был опровергнут практикой, химическим экспериментом. Развитие органической химии в настоящее время достигло уровня, позволяющего начать решение такой основополагающей проблемы органической химии, как проблема количественного соотношения структуры вещества и его свойства, в качестве которого может выступать любое физическое свойство, биологическая активность любого строго заданного типа решение задач такого типа осуществляется с использованием математических методов. Классификация органических соединений. Огромное количество органических соединений классифицируют с учетом строения углеродной цепи (углеродного скелета) и наличия в молекуле функциональных групп. На схеме представлена классификация органических соединений в зависимости от строения углеродной цепи.
|
|
Органические соединения |
|
|
|||||
|
|
¯ |
|
|
¯ |
|
|
||
Ациклические (алифатические) (соединения с открытой цепью) |
Циклические (соединения с замкнутой цепью) |
||||||||
|
¯ |
¯ |
|
|
¯ |
¯ |
|
||
Насыщенные (предельные) |
Ненасыщенные (непредельные) |
Карбоциклические (цикл состоит только из атомов углерода) |
Гетероциклические (цикл состоит из атомов углерода и других элементов) |
||||||
|
|
|
|
¯ |
¯ |
|
|
||
|
|
|
Алициклические (алифатические циклические) |
Ароматические |
|
||||
В качестве основы при классификации приняты углеводороды, их считают базовыми соединениями в органической химии. Все остальные органические соединения рассматривают как их производные. При систематизации углеводородов принимают во внимание строение углеродного скелета и тип связей, соединяющих атомы углерода. I. АЛИФАТИЧЕСКИЕ (aleiphatos. греч. масло) углеводороды представляют собой линейные или разветвленные цепочки и не содержат циклических фрагментов, они образуют две крупные группы. 1. Предельные или насыщенные углеводороды (названы так потому, что не способны что-либо присоединять) представляют собой цепочки атомов углерода, соединенных простыми связями и окруженных атомами водорода. В том случае, когда цепочка имеет разветвления, к названию добавляют приставку изо. Простейший насыщенный углеводород – метан, с него начинается ряд этих соединений. НАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ ОБЪЕМНЫЕ МОДЕЛИ НАСЫЩЕННЫХ УГЛЕВОДОРОДОВ. Валентности углерода направлены к вершинам мысленного тетраэдра, в результате цепочки насыщенных углеводородов представляют собой не прямые, а ломаные линии. Основные источники насыщенных углеводородов – нефть и природный газ. Реакционная способность насыщенных углеводородов очень низкая, они могут реагировать только с наиболее агрессивными веществами, например, с галогенами или с азотной кислотой. При нагревании насыщенных углеводородов выше 450 С° без доступа воздуха разрываются связи С-С и образуются соединения с укороченной углеродной цепью. Высокотемпературное воздействие в присутствии кислорода приводит к их полному сгоранию до СО2 и воды, что позволяет эффективно использовать их в качестве газообразного (метан – пропан) или жидкого моторного топлива (октан). При замещении одного или нескольких атомов водорода какой-либо функциональной (т.е. способной к последующим превращениям) группой образуются соответствующие производные углеводородов. Соединения, содержащие группировку С-ОН, называют спиртами, НС=О – альдегидами, СООН – карбоновыми кислотами (слово «карбоновая» добавляют для того, чтобы отличить их от обычных минеральных кислот, например, соляной или серной). Соединение может содержать одновременно различные функциональные группы, например, СООН и NH2, такие соединения называют аминокислотами. Введение в состав углеводорода галогенов или нитрогрупп приводит соответственно к галоген- или нитропроизводным. НЕНАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ в виде объемных моделей. Валентности двух атомов углерода, соединенных двойной связью, расположены в одной плоскости, что можно наблюдать при определенных углах поворота, в этот момент вращение молекул приостанавливается. Наиболее характерно для ненасыщенных углеводородов присоединение по кратной связи, что позволяет синтезировать на их основе разнообразные органические соединения. АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ. Из-за определенной направленности связей у атома углерода молекула циклогексана представляет собой не плоский, а изогнутый цикл – в форме кресла (/-/ ), что отчетливо видно при определенных углах поворота (в этот момент вращение молекул приостанавливается) Помимо показанных выше существуют иные варианты соединения циклических фрагментов, например, они могут иметь один общий атом, (так называемые, спироциклические соединения), либо соединяться таким образом, чтобы два или более атомов были общими для обоих циклов (бициклические соединения), при объединении трех и более циклов возможно также образование углеводородных каркасов. ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ. Их названия сложились исторически, например, фуран получил название от фуранового альдегида – фурфурола, получаемого из отрубей (лат. furfur – отруби). Для всех показанных соединений реакции присоединения затруднены, а реакции замещения проходят достаточно легко. Таким образом, это ароматические соединения небензольного типа. Ароматический характер этих соединений подтверждается плоским строением циклов, что отчетливо заметно в тот момент, когда их вращение приостанавливается Разнообразие соединений этого класса увеличивается дополнительно за счет того, что гетероцикл может содержать два и более гетероатомов в цикле
СТРУКТУРНАЯ
ФОРМУЛА
Структурная
формула
— это разновидность химической формулы,
графически описывающая расположение
и порядок связи атомов в соединении,
выраженное на плоскости. Связи в
структурных формулах обозначаются
валентными черточками.
Часто
используются структурные формулы, где
связи с атомами водорода не обозначаются
валентными черточками (тип 2). В другом
типе структурных формул (скелетных),
применяемых для крупных молекул в
органической химии, не указываются
атомы водорода связанные с углеродными
атомами и не обозначаются атомы углерода
(тип 3).
 С
помощью разных типов условных обозначений,
используемых в структурных формулах,
указываются также координационные
связи, водородные связи, стереохимия
молекул, делокализованные связи,
локализация зарядов и т.д.
СПЕЦИФИЧЕСКИЕ
СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Реакции
органических соединений имеют некоторые
специфические особенности. В реакциях
неорганических соединений обычно
участвуют ионы; эти реакции протекают
очень быстро, иногда мгновенно при
нормальной температуре. В реакциях
органических соединений обычно участвуют
молекулы; при этом одни ковалентные
связи разрываются, а другие образуются.
Такие реакции протекают медленнее
ионных (например, десятки часов), и для
их ускорения часто требуется повысить
температуру или добавить катализатор.
Наиболее часто используют в качестве
катализаторов кислоты и основания.
Обычно протекает не одна, а несколько
реакций, так что выход нужного продукта
очень часто составляет менее 50%. В связи
с этим в органической химии употребляют
не химические уравнения, а схемы реакций
без указания стехиометрических
соотношений.
Реакции органических
соединений могут протекать очень сложным
образом и вовсе не обязательно
соответствовать простейшей относительной
записи. Как правило, простая стехиометрическая
реакция на самом деле происходит в
несколько последовательных стадий. В
качестве промежуточных соединений
(интермедиатов) в многостадийных
процессах могут возникать карбкатионы
R+, карбанионы R-, свободные радикалы ,
карбены: СХ2, катион-радикалы (например,
анион-радикалы (например, Аr ) и другие
нестабильные частицы, живущие доли
секунды. Подробное описание всех
изменений, которые происходят на
молекулярном уровне в процессе превращения
реагентов в продукты, называется
механизмом реакции.
Исследование
влияния строения органических соединений
на механизм их реакций изучает физическая
органическая химия, основы которой
заложили К.Инголд, Робинсон и Л.Гаммет
(1930-е гг.).
Реакции органических
соединений могут классифицированы в
зависимости от способа разрыва и
образования связей, метода возбуждения
реакции, ее молекулярности и
др.
ИЗОМЕРИЯ
ИЗОМЕРИЯ
(греч. isos – одинаковый, meros – часть) –
одно из важнейших понятий в химии,
главным образом, в органической. Вещества
могут иметь одинаковый состав и
молекулярную массу, но различное строение
и соединения, содержащие в своем составе
одни и те же элементы в одинаковом
количестве, но различающиеся
пространственным расположением атомов
или групп атомов, называют изомерами.
Изомерия является одной из причин того,
что органические соединения так
многочисленны и разнообразны.
Изомерия
была впервые обнаружена Ю.Либихом в
1823, который установил, что серебряные
соли гремучей и изоциановой кислот:
Ag-О-N=C и Ag-N=C=O имеют одинаковый состав,
но разные свойства. Термин «Изомерия»
в 1830 ввел И.Берцелиус, предположивший,
что различия в свойствах соединений
одинакового состава возникают из-за
того, что атомы в молекуле расположены
в неодинаковом порядке. Представления
об изомерии окончательно сформировались
после создания A.M.Бутлеровым теории
химического строения (1860-е). Основываясь
на положениях этой теории, он предположил,
что должно существовать четыре различных
бутанола. К моменту создания теории был
известен лишь один бутанол (СН3)2СНСН2ОН,
получаемый из растительного
сырья.
Последовавший затем синтез
всех изомеров бутанола и определение
их свойств стали убедительным
подтверждением теории.
Согласно
современному определению два соединения
одинакового состава считают изомерами,
если их молекулы нельзя совместить в
пространстве так, чтобы они полностью
совпадали. Совмещение, как правило,
проделывают мысленно, в сложных случаях
используют пространственные модели,
либо расчетные методы. Есть несколько
причин возникновения изомерии.
Структурная
изомерия
Обусловлена,
как правило, различиями в строении
углеводородного скелета либо неодинаковым
расположением функциональных групп
или кратных связей.
С
помощью разных типов условных обозначений,
используемых в структурных формулах,
указываются также координационные
связи, водородные связи, стереохимия
молекул, делокализованные связи,
локализация зарядов и т.д.
СПЕЦИФИЧЕСКИЕ
СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Реакции
органических соединений имеют некоторые
специфические особенности. В реакциях
неорганических соединений обычно
участвуют ионы; эти реакции протекают
очень быстро, иногда мгновенно при
нормальной температуре. В реакциях
органических соединений обычно участвуют
молекулы; при этом одни ковалентные
связи разрываются, а другие образуются.
Такие реакции протекают медленнее
ионных (например, десятки часов), и для
их ускорения часто требуется повысить
температуру или добавить катализатор.
Наиболее часто используют в качестве
катализаторов кислоты и основания.
Обычно протекает не одна, а несколько
реакций, так что выход нужного продукта
очень часто составляет менее 50%. В связи
с этим в органической химии употребляют
не химические уравнения, а схемы реакций
без указания стехиометрических
соотношений.
Реакции органических
соединений могут протекать очень сложным
образом и вовсе не обязательно
соответствовать простейшей относительной
записи. Как правило, простая стехиометрическая
реакция на самом деле происходит в
несколько последовательных стадий. В
качестве промежуточных соединений
(интермедиатов) в многостадийных
процессах могут возникать карбкатионы
R+, карбанионы R-, свободные радикалы ,
карбены: СХ2, катион-радикалы (например,
анион-радикалы (например, Аr ) и другие
нестабильные частицы, живущие доли
секунды. Подробное описание всех
изменений, которые происходят на
молекулярном уровне в процессе превращения
реагентов в продукты, называется
механизмом реакции.
Исследование
влияния строения органических соединений
на механизм их реакций изучает физическая
органическая химия, основы которой
заложили К.Инголд, Робинсон и Л.Гаммет
(1930-е гг.).
Реакции органических
соединений могут классифицированы в
зависимости от способа разрыва и
образования связей, метода возбуждения
реакции, ее молекулярности и
др.
ИЗОМЕРИЯ
ИЗОМЕРИЯ
(греч. isos – одинаковый, meros – часть) –
одно из важнейших понятий в химии,
главным образом, в органической. Вещества
могут иметь одинаковый состав и
молекулярную массу, но различное строение
и соединения, содержащие в своем составе
одни и те же элементы в одинаковом
количестве, но различающиеся
пространственным расположением атомов
или групп атомов, называют изомерами.
Изомерия является одной из причин того,
что органические соединения так
многочисленны и разнообразны.
Изомерия
была впервые обнаружена Ю.Либихом в
1823, который установил, что серебряные
соли гремучей и изоциановой кислот:
Ag-О-N=C и Ag-N=C=O имеют одинаковый состав,
но разные свойства. Термин «Изомерия»
в 1830 ввел И.Берцелиус, предположивший,
что различия в свойствах соединений
одинакового состава возникают из-за
того, что атомы в молекуле расположены
в неодинаковом порядке. Представления
об изомерии окончательно сформировались
после создания A.M.Бутлеровым теории
химического строения (1860-е). Основываясь
на положениях этой теории, он предположил,
что должно существовать четыре различных
бутанола. К моменту создания теории был
известен лишь один бутанол (СН3)2СНСН2ОН,
получаемый из растительного
сырья.
Последовавший затем синтез
всех изомеров бутанола и определение
их свойств стали убедительным
подтверждением теории.
Согласно
современному определению два соединения
одинакового состава считают изомерами,
если их молекулы нельзя совместить в
пространстве так, чтобы они полностью
совпадали. Совмещение, как правило,
проделывают мысленно, в сложных случаях
используют пространственные модели,
либо расчетные методы. Есть несколько
причин возникновения изомерии.
Структурная
изомерия
Обусловлена,
как правило, различиями в строении
углеводородного скелета либо неодинаковым
расположением функциональных групп
или кратных связей.
Изомерия углеводородного скелета. Насыщенные углеводороды, содержащие от одного до трех атомов углерода (метан, этан, пропан), не имеют изомеров. Для соединения с четырьмя атомами углерода С4Н10 (бутан) возможно существование двух изомеров, для пентана С5Н12 – трех изомеров, для гексана С6Н14 – пяти
С увеличением числа атомов углерода в молекуле углеводорода количество возможных изомеров резко возрастает. Для гептана С7Н16 существует девять изомеров, для углеводорода С14Н30 – 1885 изомеров, для углеводорода С20Н42 – свыше 366 000.
В сложных случаях вопрос о том, являются ли два соединения изомерами, решают, используя различные повороты вокруг валентных связей (простые связи это допускают, что в определенной степени соответствует их физическим свойствам). После перемещения отдельных фрагментов молекулы (не допуская при этом разрыва связей) накладывают одну молекулу на другую. Если две молекулы полностью совпадают, то это не изомеры, а одно и то же соединение:
 Изомеры,
отличающиеся структурой скелета, обычно
имеют разные физические свойства
(температура плавления, температура
кипения и т.п.), что позволяет отделить
один от другого. Изомерия такого типа
существует и у ароматических углеводородов.
Изомеры,
отличающиеся структурой скелета, обычно
имеют разные физические свойства
(температура плавления, температура
кипения и т.п.), что позволяет отделить
один от другого. Изомерия такого типа
существует и у ароматических углеводородов.
Классификация соединений по строению углеродной цепи
В зависимости от строения углеродной цепи органические соединения делят на ациклические и циклические.

Ациклические соединения - соединения с открытой (незамкнутой) углеродной цепью. Эти соединения называются также алифатическими.
Среди
ациклических соединений различают
предельные
(насыщенные),
содержащие в скелете только одинарные
связи C-C и непредельные
(ненасыщенные), включающие кратные связи
C=C и C![]() C.
C.
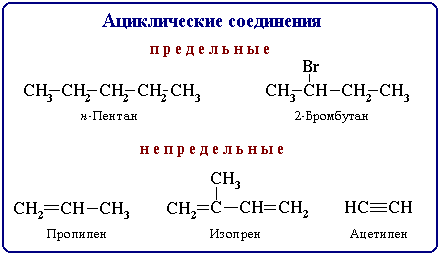
Ациклические соединения подразделяют также на соединения с неразветвленной и разветвленной цепью. В этом случае учитывается число связей атома углерода с другими углеродными атомами.
Циклические соединения - соединения с замкнутой углеродной цепью.
В зависимости от природы атомов, составляющих цикл, различают карбоциклические и гетероциклические соединения. Карбоциклические соединения содержат в цикле только атомы углерода. Они делятся на две существенно различающихся по химическим свойствам группы: алифатические циклические - сокращенно алициклические - и ароматические соединения.

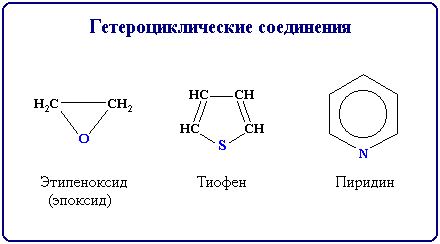
Гетероциклические соединения содержат в цикле, кроме атомов углерода, один или несколько атомов других элементов - гетероатомов (от греч. heteros - другой, иной) - кислород, азот, серу и др.
Органических соединений много, но среди них имеются соединения с общими и сходными свойствами. Поэтому все они по общим признакам классифицированы, объединены в отдельные классы и группы. В основе классификации лежат углеводороды – соединения, которые состоят только из атомов углерода и водорода. Остальные органические вещества относятся к «Другим классам органических соединений».
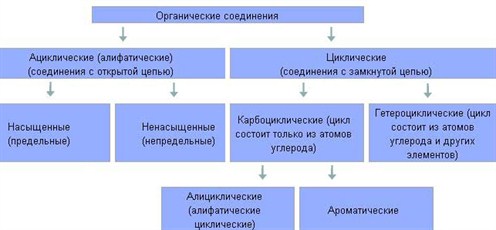
Углеводороды делятся на два больших класса: ациклические и циклические соединения.
Ациклические соединения (жирные или алифатические) – соединения, молекулы которых содержат открытую (незамкнутую в кольцо) неразветвленную или разветвленную углеродную цепь с простыми или кратными связями. Ациклические соединения подразделяются на две основные группы:
• насыщенные (предельные) углеводороды (алканы), у которых все атомы углерода связаны между собой только простыми связями;
• ненасыщенные (непредельные) углеводороды, у которых между атомами углерода кроме одинарных простых связей, имеются также и двойные, и тройные связи.
Ненасыщенные (непредельные) углеводороды делятся на три группы: алкены, алкины и алкадиены.
Алкены (олефины, этиленовые углеводороды) – ациклические непредельные углеводороды, которые содержат одну двойную связь между атомами углерода, образуют гомологический ряд с общей формулой CnH2n. Названия алкенов образуются от названий соответствующих алканов с заменой суффикса «-ан» на суффикс «-ен». Например, пропен, бутен, изобутилен или метилпропен.
Алкины (ацетиленовые углеводороды) – углеводороды, которые содержат тройную связь между атомами углерода, образуют гомологический ряд с общей формулой CnH2n-2. Названия алкенов образуются от названий соответствующих алканов с заменой суффикса «-ан» на суффикс «-ин». Например, этин (ацителен), бутин, пептин.
Алкадиены – органические соединения, которые содержат две двойные связи углерод-углерод. В зависимости от того, как располагаются двойные связи относительно друг друга диены делятся на три группы: сопряженные диены, аллены и диены с изолированными двойными связями. Обычно к диенам относят ациклические и циклические 1,3-диены, образующие с общими формулами CnH2n-2 и CnH2n-4. Ациклические диены являются структурными изомерами алкинов.
Циклические соединения в свою очередь делятся на две большие группы:
карбоциклические соединения – соединения, циклы которых состоят только из атомов углерода; Карбоциклические соединения подразделяются на алициклические – насыщенные (циклопарафины) и ароматические;
гетероциклические соединения – соединения, циклы которых состоят не только из атомов углерода, но атомов других элементов: азота, кислорода, серы и др.
В молекулах как ациклических, так и циклических соединений атомы водорода можно замещать на другие атомы или группы атомов, таким образом, с помощью введения функциональных групп можно получать производные углеводородов. Это свойство ещё больше расширяет возможности получения различных органических соединений и объясняет их многообразие.
Наличие тех или иных групп в молекулах органических соединений обуславливает общность их свойств. На этом основана классификация производных углеводородов.
К «Другим классам органических соединений» относятся следующие:
Спирты получаются замещением одного или нескольких атомов водорода гидроксильными группами – OH. Это соединение с общей формулой R – (OH)х, где х – число гидроксильных групп.
Альдегиды содержат альдегидную группу (С = О), которая всегда находится в конце углеводородной цепи.
Карбоновые кислоты содержат в своём составе одну или несколько карбоксильных групп – COOH.
Сложные эфиры – производные кислородосодержащих кислот, которые формально являются продуктами замещения атомов водорода гидроокислов – OH кислотной функции на углеводородный остаток; рассматриваются также как ацилпроизводные спиртов.
Жиры (триглицериды) – природные органические соединения, полные сложные эфиры глицерина и односоставных жирных кислот; входят в класс липидов. Природные жиры содержат в своём составе три кислотных радикала с неразветвлённой структурой и, обычно, чётное число атомов углерода.
Углеводы – органические вещества, которые содержат содержащими неразветвленную цепь из нескольких атомов углерода, карбоксильную группу и несколько гидроксильных групп.
Амины содержат в своём составе аминогруппу – NH2
Аминокислоты – органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы.
Белки – высокомолекулярные органические вещества, которые состоят состоящие из альфа – аминокислот, соединённых в цепочку пептидной связью.
Нуклеиновые кислоты – высокомолекулярные органические соединения, биополимеры, образованные остатками нуклеотидов.
Названия углеводородов с разветвленными цепями строятся следующим образом
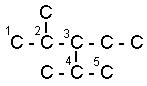
![]()
1. За основу названия данного соединения берут название углеводорода, соответствующее числу углеродных атомов главной цепи:
главной цепью углеродных атомов считают самую длинную;
если в углеводороде можно выделить две или несколько одинаково длинных цепей, то за главную выбирают ту из них, которая имеет наибольшее число разветвлений.
2. После установления главной цепи необходимо пронумеровать углеродные атомы. Нумерацию начинают с того конца цепи, к которому ближе примыкает любой из алкилов. Если разные алкилы находятся на равном удалении от обоих концов цепи, то нумерацию начинают с того конца, к которому ближе радикал с меньшим числом углеродных атомов (метил, этил, пропил и т. д.).
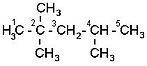
2,2,4-триметилпентан
Неправильно! Радикалы называются в алфавитном порядке! 2.3 — If two or more side chains of different nature are present, they are cited in alphabetical order. (http://www.acdlabs.com/iupac/nomenclature/79/r79_36.htm) Если же одинаковые радикалы, определяющие начало нумерации, находятся на равном удалении от обоих концов цепи, но с одной стороны их имеется большее число, чем с другой, то нумерацию начинают с того конца, где число разветвлений больше. Называя соединение, сначала перечисляют заместители в алфавитном порядке (числительные не принимают во внимание), причем перед названием радикала ставят цифру, соответствующую номеру углеродного атома главной цепи, при котором находится данный радикал. После этого называют углеводород, соответствующей главной цепи углеродных атомов, отделяя слово от цифр дефисом.

Если углеводород содержит несколько одинаковых радикалов, то число их обозначают греческим числительным (ди, три, тетра и т. д.) и ставят перед названием этих радикалов, а их положение указывают, как обычно, цифрами, причем цифры разделяют запятыми, располагая в порядке их возрастания и ставят перед названием данных радикалов, отделяя их от него дефисом. Для простейших углеводородов изостроения сохраняются их несистематические названия (изобутан, изопентан, неопентан, изогексан).
Радикалы называют, заменяя суффикс -ан в названии углеводорода на -ил:
метил CH3-
этил CH3-CH2-
пропил CH3-CH2-CH2-
бутил CH3-CH2-CH2-CH2-
пентил CH3-CH2-CH2-CH2-CH2-
Название амил для радикала С5H11 теперь не применяется.[источник не указан 494 дня]
При построении названия сложных радикалов нумерацию их атомов начинают от углеродного атома со свободной валентностью. Двухвалентные радикалы называют, добавляя к названию углеводорода суффикс -илен (кроме «метилен»).
[править] См. также
В соответствии с правилами ИЮПАК при построении алкенов наиболее длинная углеродная цепь, содержащая двойную связь, получает название соответствующего алкана, в котором суффикс -ан заменён на -ен.

Бутен-1 (бутилен-1)
Эта цепь нумеруется таким образом, чтобы углеродные атомы, участвующие в образовании двойной связи, получили номера, наименьшие из возможных. Радикалы называются и нумеруются, как и в случае алканов. Для алкенов сравнительно простого строения разрешается применять более простые названия. Так, некоторые наиболее часто встречающиеся алкены называют, добавляя суффикс -ен к названию углеводородного радикала (этилен, пропилен, бутилен и другие). Углеводородные радикалы, образованные из алкенов, получают суффикс -енил. Нумерация в радикале начинается от углеродного атома, имеющего свободную валентность. Однако, для простейших алкенильных радикалов вместо систематических названий разрешается использовать тривиальные (винил (этенил), аллил (2-пропенил)).
Согласно номенклатуре ИЮПАК при построении названий алкинов в названиях соответствующих насыщенных углеводородов суффикс -ан заменяется суффиксом -ин. Для указания положения тройной связи и замещающих групп цепь нумеруют также, как в соответствующих алкенах. Этин также возможно именовать тривиально — ацетилен.
Углеводороды, имеющие две или больше тройных связей, называются алка- диинами, триинами и т. д. Углеводороды, содержащие одновременно двойные и тройные связи, называются алкенинами, алкадиенинами, алкендиинами и т. п. в соответствии с числом двойных и тройных связей.
![]()
Гексадиен-1,3-ин-5
Если двойная и тройная связи расположены на равных расстояниях от концов цепи, то нач
ало нумерации определяет двойная связь. Углеводородные заместители, образуемые из алкинов, именуются алкинильными группами; наиболее простые имеют тривиальные названия (этинил, пропаргил).
Материал из Википедии — свободной энциклопедии
Перейти к: навигация, поиск
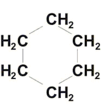

Циклогексан
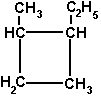
1-метил-2-этилциклобутан
Названия циклоалканов образуют добавлением префикса цикло- к названию соответствующего неразветвлённого предельного углеводорода с тем же числом углеродных атомов. Заместители же нумеруются в соответствии с их положением в цикле таким образом, чтобы сумма чисел в названии вещества была минимальной.
|
Это заготовка статьи по химии. Вы можете помочь проекту, исправив и дополнив её. |
Первый гомолог бензола — метилбензол, или толуол, C7H8 не имеет изомеров положения, как и все однозамещённые производные. Второй гомолог C8H10, может существовать в четырёх формах: этилбензол C6H5-C2H5 и три диметилбензола, или ксилола, C6H4(CH3)2 (орто-, мета-, пара-ксилол, или 1,2-, 1,3-, 1,4-диметилбензол):
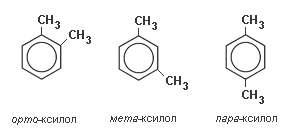
орто-, мета- и пара- положение заместителей
Радикал бензола C6H5- носит название фенил (и часто обозначается как Ph); названия радикалов гомологов бензола происходят от названий соответствующих углеводородов, при добавлении к корню суффикса -ил (толил, ксилил) и обозначая буквами (о-, м-, п-) или цифрами положение боковых цепей. Общее название для всех ароматических радикалов — арилы аналогично названию алкилы для радикалов алканов. Радикал C6H5-CH2- называется бензил.
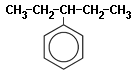
3-фенилпентан
Называя более сложные производные бензола, как и в случае алициклических соединений, из возможных порядков выбирают тот, при котором сумма цифр номеров заместителей в названии соединения будет наименьшей. Названия высших гомологов часто производят не от названия ароматического ядра, а от названия боковой цепи, то есть рассматривают их как производные алканов.
Галогеналканы (алкилгалогениды) — органические соединения, которые содержат в своём составе связь «углерод-галоген». Их строение можно представить, исходя из строения углеводорода, в котором связь С-Н заменена на связь С-Х, (Х — фтор, хлор, бром, иод). В силу того, что атомы галогенов являются более электроотрицательными, чем атом углерода, связь С-Х поляризована таким образом, что атом галогена приобретает частичный отрицательный заряд, а атом углерода — частичный положительный. Соответственно, алкилгалогениды являются ярко выраженными электрофилами, и на этом свойстве основано их применение в органическом синтезе.
Содержание [убрать]
|
[править] Номенклатура
Согласно номенклатуре ИЮПАК галогенопроизводные органических соединений рекомендовано называть по заместительной номенклатуре. К соответствующей изначальной структуре вещества добавляется префикс «фтор-», «хлор-», «бром-» или «йод-», с указанием перед ним номера углерода в цепи, с которым связан галоген. Например, вещество CH3-CHBr-CH2-CH3 будет называться «2-бромбутан». В случае наличия в составе молекулы нескольких атомов одного и того же галогена, указываются номера всех углеродов в цепи, к которым привязаны атомы галогена, а так же количество атомов галогена — «дибром-», «трифтор-», «тетрахлор-». Так, CH2Br-CHBr-CH2-CH3 называется «1,2-дибромбутан». При отсутствии вариантов, номера углеродов могут опускаться, как в гексахлорэтане или трихлорметане.
При наличии нескольких разных галогенов в составе префиксы указываются по очереди, в порядке возрастания атома углерода, к которому привязан соответствующий галоген.
Спиртами называют производные углеводородов, содержащие группу (или несколько групп) -ОН, называемую гидроксильной группой или гидроксилом. По числу гидроксильных групп, содержащихся в молекуле, спирты делятся на одноатомные (с одним гидроксилом), двухатомные (с двумя), трёхатомные (с тремя гидроксилами) и многоатомные. Подобно предельным углеводородам, одноатомные спирты образуют закономерно построенный ряд гомологов с общей формулой CnH2n+1OH. В зависимости от того, при каком атоме углерода находится гидроксил, различают первичные, вторичные и третичные спирты.
![]()
4-бром-2-метилбутен-3-ол-1
В соответствии с номенклатурой ИЮПАК при построении названия одноатомного спирта к названию родоначального углеводорода добавляется суффикс -ол. При наличии в соединении более старших функций гидроксильная группа обозначается префиксом гидрокси- (в русском языке часто используется префикс окси-). В качестве основной цепи выбирается наиболее длинная неразветвленная цепь углеродных атомов, в состав которой входит атом углерода, связанный с гидроксильной группой; если соединение является ненасыщенным, то в эту цепь включается также и кратная связь, Следует заметить, что при определении номера нумерации гидроксильная функция обычно имеет преимущество перед галогеном, двойной связью и алкилом, следовательно нумерацию начинают с того конца цепи, ближе к которому расположена гидроксильная группа. Простейшие спирты называют по радикалам, с которыми соединена гидроксильная группа: (СН3)2СНОН — изопропиловый спирт, (СН3)3СОН — трет-бутиловый спирт.
[править] Систематическая номенклатура двуатомных спиртов
При названии двухатомных спиртов к названию родоначального углеводорода добавляются номера атомов углерода, связанных с OH-группой и суффикс -диол. Для вицдиолов-также возможно применение названия алкена, двойная связь в котором связана со спиртовыми атомами C и суффикс -гликоль, либо префикс диокси-:
HO—CH2—CH2—OH — этиленгликоль (этандиол-1,2; 1,2-диоксиэтан) и т. п.
[править] Систематическая номенклатура трёхатомных спиртов
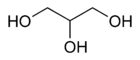
Глицерин
Трёхатомные спирты, называемые также глицеринами, содержат три гидроксильные группы. При названии трёхатомных спиртов к названию родоначального углеводорода добавляется суффикс -триол, либо префикс триокси-: HOCH2CH(OH)-CH2OH — 1,2,3-триоксипропан (пропантриол-1,2,3). Пропантриол-1,2,3 также именуется глицерином.
|
Систематическая номенклатура альдегидов
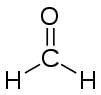
Метаналь
Алифатические альдегиды называют по самой длинной углеродной цепи, прибавляя к названию алифатического углеводорода окончание -аль. Наличие в соединении двух альдегидных групп обозначается окончанием -диаль. Нумерацию цепи начинают от углеродного атома, принадлежащего альдегидной группе. В названии номер при альдегидной группе, как правило, не ставят.
![]()
2-формилпентандионовая кислота
Если в соединении имеется другая группа, имеющая преимущество в перечислении как главная группа, то альдегидную группу в алициклических соединениях называют, используя префикс формил-:
Циклические соединения с альдегидной группой в боковой цепи рассматривают как замещённые алифатические альдегиды. Название производят от названия алифатического альдегида и радикала в качестве приставки (допускается тривиальное название альдегида).
Для альдегидов допускаются тривиальные названия, если соответствующая кислота имеет тривиальное название:
CH2O - формальдегид
CH3-CHO - ацетальдегид
CH3-CH2-CHO - пропиональдегид
CH3-CH2-CH2-CHO - бутиральдегид
(CH3)2-CH-CHO - изобутиральдегид
CH3-(CH2)3-CHO - валеральдегид
(CH3)2CH-CH2-CHO - изовалеральдегид
CH2=CH-CHO - акролеин (акрилальдегид)
CH3-CH=CH-CHO - кротональдегид
С6H5-CHO - бензальдегид
Однако, имеются исключения, например глиоксаль: O=CH-CH=O.
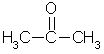
[править] Систематическая номенклатура кетонов
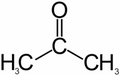
Ацетон
Названия алифатических и алициклических кетонов образуют, прибавляя суффикс -он или -дион (для дикетонов) к названию родоночального углеводорода. Допускается название кетонов по радикальному признаку, при этом называют радикалы при кетогруппе в порядке возрастания сложности и в конце названия ставят -кетон (например, метилэтилкетон — CH3-CO-CH2-CH3).
![]()
3-оксопентановая кислота
Если в соединении имеется другая группа, имеющая преимущество в перечислении как главная, то для обозначения карбонильной группы используется префикс оксо-:
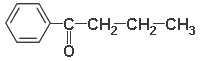
Бутирофенон (1-фенилбутанон-1)
Карбоциклические кетоны с кетонной группой в боковой цепи называют по радикалам. Кроме того, допускаются названия по алифатическому кетону или по циклической структуре. В последнем случае боковая цепь называется как остаток кислоты. Название имеет суффикс -офенон, -онафтон (допустимо только для бензола и нафталина соответственно).
Для некоторых кетонов допускаются тривиальные названия:
CH3-CO-CH3 - ацетон
(CH3)2C=CH-CO-CH3 - окись мезитила
CH3-CO-CO-CH3 - диацетил
C6H5-CO-CO-C6H5 - бензил (дибензоил)
Сохраняются тривиальные названия радикалов:
CH3-CO-CH2- - ацетонил
C6H5-CO-CH2- - фенацил
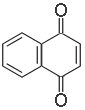
1,4-нафтохинон
Дикетоны ароматического ряда с кетонными группами в ядре называют сокращённым названием углеводорода, добавляя суффикс -хинон. Положения кетонных групп указывают номерами или соответствующими терминами (о-, м-,
К классу карбоновых кислот относятся соединения, содержащие карбоксильную группу. Соединения, содержащие одну карбоксильную группу, называются одноосновными карбоновыми кислотами, две- двухосновные и т. д. Номенклатура ИЮПАК разрешает сохранять их тривиальные названия. Для более сложных случаев названия кислот производят от названия углеводородов с тем же числом атомов углерода, что и в молекуле кислоты, с добавлением окончания -овая и слова кислота.
ХИМИЯ ОРГАНИЧЕСКАЯ. НОМЕНКЛАТУРА СОЕДИНЕНИЙ
Для наименования органических соединений используется несколько систем, но ни одна из них не подходит для всех соединений. Сохранились многие тривиальные названия, которые либо применялись еще в начальный период органической химии и отражают источник получения или характерные качества, либо являются более новыми несистематическими названиями, которые используются по причине удобства. Так, спирт CH3OH иногда называют "древесным спиртом", потому что его когда-то получали сухой перегонкой дерева; систематическое название для этого спирта - метанол. Алкалоид морфин назван по его наркотическому действию, но в этом случае тривиальное название является единственным обычно используемым, поскольку систематическое название сложно и громоздко. Тривиальные названия часто дают промышленным продуктам, особенно в фармацевтической промышленности, где продукты продаются под патентованными названиями, причем одно и то же соединение различные фирмы могут выпустить под различными названиями. Часто используются квазисистематические названия, которые не могут адекватно описать структуру соединения без дополнительной информации. Например, инсектицид ДДТ иногда называют дихлордифенилтрихлорэтаном, чего недостаточно, чтобы написать единственную структуру этого соединения, поскольку название ничего не говорит о положении атомов хлора. Полное название для главного активного компонента - 2,2-ди(4-хлорфенил)-1,1,1-трихлорэтан.
 <>
Система
ИЮПАК.
Процесс создания международной
номенклатуры был начат в 1892 (Женевская
номенклатура), продолжен в 1930 (Льежская
номенклатура), с 1947 дальнейшее развитие
связано с деятельностью комиссии ИЮПАК
(Международный союз теоретической и
прикладной химии) по номенклатуре
органических соединений. Публиковавшиеся
в разные годы правила ИЮПАК собраны в
1979 в "голубой книге" [[Nomenclature of
Organic Chemistry, Section A, B, C, D, E, F and H, Oxford Pergamon
Press, 1979]]. Своей задачей комиссия ИЮПАК
считает не создание новой, единой системы
номенклатуры, а упорядочение, "кодификацию",
имеющейся практики. Результатом этого
является сосуществование в правилах
ИЮПАК нескольких номенклатурных систем,
а следовательно, и нескольких допустимых
названий для одного и того же вещества.
Правила ИЮПАК опираются на следующие
системы: заместительную,
радикало-функциональную, аддитивную
(соединительную), заменительную
номенклатуру и т.д. В заместительной
номенклатуре основой названия служит
один углеводородный фрагмент, а другие
рассматриваются как заместители водорода
(например, (C6H5)3CH - трифенилметан). В
радикало-функциональной номенклатуре
в основе названия лежит название
характеристической функциональной
группы, определяющей химический класс
соединения, к которому присоединяют
наименование органического радикала
(например, метиловый спирт, метилэтилкетон,
метилхлорид, бутилцианид, диэтиловый
эфир). В соединительной номенклатуре
название составляют из нескольких
равноправных частей (например, C6H5-C6H5
бифенил) или добавляя обозначения
присоединенных атомов к названию
основной структуры (например,
1,2,3,4-тетрагидронафталин, гидрокоричная
кислота, этиленоксид, стиролдихлорид).
Заменительную номенклатуру применяют
при наличии неуглеродных атомов
(гетероатомов) в молекулярной цепи:
корни латинских названий этих атомов
с окончанием "а" (а-номенклатура)
присоединяют к названиям всей структуры,
которая получилась бы, если бы вместо
гетероатомов был углерод (например,
CH3-O-CH2-CH2-NH-CH2-CH2-S-CH3 2-окса-8-тиа-5-азанонан).
Система ИЮПАК является общепризнанной
в мире, и лишь адаптируется соответственно
грамматике языка страны (например,
однотипные заместители перечисляются
в алфавитном порядке). Полный набор
правил применения системы ИЮПАК ко
многим менее обычным типам молекул
длинен и сложен. Здесь представлено
лишь основное содержание системы, но
это позволяет осуществлять наименование
соединений, для которых применяется
система. Названия по системе ИЮПАК
образуются путем видоизменения названий
насыщенных углеводородов (табл. 1).
Отметим, что все эти названия оканчиваются
на "ан"; это окончание характерно
для всех насыщенных углеводородов -
алканов. Такой ряд соединений, в котором
соседние члены отличаются на одну
метиленовую группу (CH2), называется
гомологическим рядом. Необходимо знать
также названия замещающих групп, которые
могут находиться в разветвлениях главной
углеводородной цепи. Если из углеводорода
удалить один атом водорода, полученная
таким путем группа называется
углеводородным радикалом; его название
получают, заменяя в названии алкана
окончание "ан" на "ил" (табл.
2).
Основные правила наименования
соединений по системе ИЮПАК даны ниже:
1. Находят самую длинную непрерывную
цепь углеродных атомов в молекуле.
Название соответствующего углеводорода
используют как основу названия соединения.
2. Атомам (иным, чем водород) и группам
вдоль этой цепи даются наименования, и
эти наименования пишут перед названием
основного углеводорода. 3. Атомы углерода
основной углеводородной цепи нумеруют
последовательно, начиная с конца,
выбранного так, чтобы атомы углерода,
несущие заместители, получили наиболее
низкие номера. 4. Положения заместителей
указывают локантами - числами перед
названиями заместителей, обозначающими
порядковые номера атомов углерода, к
которым они присоединены. 5. Если имеется
несколько одинаковых групп, перед их
названием ставится приставка "ди",
"три", "тетра", "пента",
"гекса" и т.д., обозначающая число
присутствующих групп. 6. Двойные
углерод-углеродные связи указывают
суффиксом "ен" ("диен", если
их две, и т.п.), а тройные - суффиксом "ин"
("диин" для двух и т.д.); при
использовании этих суффиксов окончание
"ан" опускают. Положение кратных
связей обозначают порядковыми номерами
углеродных атомов, подобно тому, как
это делается для заместителей. 7. Все
название пишется одним словом. Несколько
примеров иллюстрируют эти правила:
<>
Система
ИЮПАК.
Процесс создания международной
номенклатуры был начат в 1892 (Женевская
номенклатура), продолжен в 1930 (Льежская
номенклатура), с 1947 дальнейшее развитие
связано с деятельностью комиссии ИЮПАК
(Международный союз теоретической и
прикладной химии) по номенклатуре
органических соединений. Публиковавшиеся
в разные годы правила ИЮПАК собраны в
1979 в "голубой книге" [[Nomenclature of
Organic Chemistry, Section A, B, C, D, E, F and H, Oxford Pergamon
Press, 1979]]. Своей задачей комиссия ИЮПАК
считает не создание новой, единой системы
номенклатуры, а упорядочение, "кодификацию",
имеющейся практики. Результатом этого
является сосуществование в правилах
ИЮПАК нескольких номенклатурных систем,
а следовательно, и нескольких допустимых
названий для одного и того же вещества.
Правила ИЮПАК опираются на следующие
системы: заместительную,
радикало-функциональную, аддитивную
(соединительную), заменительную
номенклатуру и т.д. В заместительной
номенклатуре основой названия служит
один углеводородный фрагмент, а другие
рассматриваются как заместители водорода
(например, (C6H5)3CH - трифенилметан). В
радикало-функциональной номенклатуре
в основе названия лежит название
характеристической функциональной
группы, определяющей химический класс
соединения, к которому присоединяют
наименование органического радикала
(например, метиловый спирт, метилэтилкетон,
метилхлорид, бутилцианид, диэтиловый
эфир). В соединительной номенклатуре
название составляют из нескольких
равноправных частей (например, C6H5-C6H5
бифенил) или добавляя обозначения
присоединенных атомов к названию
основной структуры (например,
1,2,3,4-тетрагидронафталин, гидрокоричная
кислота, этиленоксид, стиролдихлорид).
Заменительную номенклатуру применяют
при наличии неуглеродных атомов
(гетероатомов) в молекулярной цепи:
корни латинских названий этих атомов
с окончанием "а" (а-номенклатура)
присоединяют к названиям всей структуры,
которая получилась бы, если бы вместо
гетероатомов был углерод (например,
CH3-O-CH2-CH2-NH-CH2-CH2-S-CH3 2-окса-8-тиа-5-азанонан).
Система ИЮПАК является общепризнанной
в мире, и лишь адаптируется соответственно
грамматике языка страны (например,
однотипные заместители перечисляются
в алфавитном порядке). Полный набор
правил применения системы ИЮПАК ко
многим менее обычным типам молекул
длинен и сложен. Здесь представлено
лишь основное содержание системы, но
это позволяет осуществлять наименование
соединений, для которых применяется
система. Названия по системе ИЮПАК
образуются путем видоизменения названий
насыщенных углеводородов (табл. 1).
Отметим, что все эти названия оканчиваются
на "ан"; это окончание характерно
для всех насыщенных углеводородов -
алканов. Такой ряд соединений, в котором
соседние члены отличаются на одну
метиленовую группу (CH2), называется
гомологическим рядом. Необходимо знать
также названия замещающих групп, которые
могут находиться в разветвлениях главной
углеводородной цепи. Если из углеводорода
удалить один атом водорода, полученная
таким путем группа называется
углеводородным радикалом; его название
получают, заменяя в названии алкана
окончание "ан" на "ил" (табл.
2).
Основные правила наименования
соединений по системе ИЮПАК даны ниже:
1. Находят самую длинную непрерывную
цепь углеродных атомов в молекуле.
Название соответствующего углеводорода
используют как основу названия соединения.
2. Атомам (иным, чем водород) и группам
вдоль этой цепи даются наименования, и
эти наименования пишут перед названием
основного углеводорода. 3. Атомы углерода
основной углеводородной цепи нумеруют
последовательно, начиная с конца,
выбранного так, чтобы атомы углерода,
несущие заместители, получили наиболее
низкие номера. 4. Положения заместителей
указывают локантами - числами перед
названиями заместителей, обозначающими
порядковые номера атомов углерода, к
которым они присоединены. 5. Если имеется
несколько одинаковых групп, перед их
названием ставится приставка "ди",
"три", "тетра", "пента",
"гекса" и т.д., обозначающая число
присутствующих групп. 6. Двойные
углерод-углеродные связи указывают
суффиксом "ен" ("диен", если
их две, и т.п.), а тройные - суффиксом "ин"
("диин" для двух и т.д.); при
использовании этих суффиксов окончание
"ан" опускают. Положение кратных
связей обозначают порядковыми номерами
углеродных атомов, подобно тому, как
это делается для заместителей. 7. Все
название пишется одним словом. Несколько
примеров иллюстрируют эти правила:
 <>
Наименование
таких сложных радикалов, как CH3CHCH2Cl в
последнем примере, осуществляется по
следующим правилам: 1. Углеродный атом
со "свободной" связью получает
номер 1'. Самая длинная углеродная цепь,
начиная с этого места, последовательно
нумеруется и используется для основного
названия (в приведенном примере - этан).
2. С заместителями вдоль этой цепи
поступают, как описано выше при
наименовании соединений. 3. Полное
название сложного радикала заключают
в скобки, чтобы избежать путаницы с
номерами для остальной части молекулы.
Названия по системе ИЮПАК и обычные
названия для нескольких часто встречающихся
сложных радикалов даны в табл. 2.
Циклические углеводороды называют,
прибавляя к названию углеводорода с
прямой цепью приставку "цикло".
Для указания положения заместителей
атомы кольца нумеруют последовательно,
начиная с главного заместителя (табл.
3).
<>
Наименование
таких сложных радикалов, как CH3CHCH2Cl в
последнем примере, осуществляется по
следующим правилам: 1. Углеродный атом
со "свободной" связью получает
номер 1'. Самая длинная углеродная цепь,
начиная с этого места, последовательно
нумеруется и используется для основного
названия (в приведенном примере - этан).
2. С заместителями вдоль этой цепи
поступают, как описано выше при
наименовании соединений. 3. Полное
название сложного радикала заключают
в скобки, чтобы избежать путаницы с
номерами для остальной части молекулы.
Названия по системе ИЮПАК и обычные
названия для нескольких часто встречающихся
сложных радикалов даны в табл. 2.
Циклические углеводороды называют,
прибавляя к названию углеводорода с
прямой цепью приставку "цикло".
Для указания положения заместителей
атомы кольца нумеруют последовательно,
начиная с главного заместителя (табл.
3).
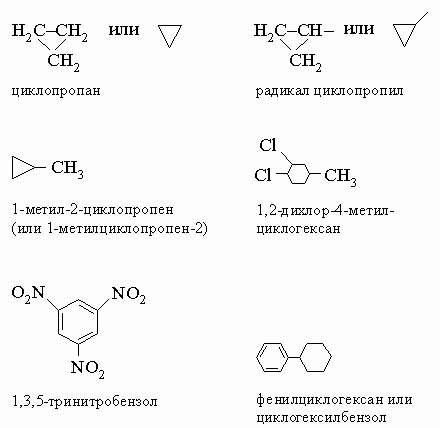 <>
Отметим,
что в последнем примере углеводород
просто называют бензолом (а не
1,3,5-циклогексатриеном), а соответствующий
радикал - фенилом.
Более сложным
циклическим соединениям обычно дают
тривиальные названия и системы нумерации.
К соединениям этого типа относятся
полициклические ароматические
углеводороды (в которых бензольные
кольца соединены двумя общими атомами)
и гетероциклические соединения (у
которых в состав колец входят гетероатомы).
Важнейшие циклические системы и их
нумерация приведены в табл. 4. Отметим,
что в гетероциклах нумерация начинается
с гетероатома и производится так, чтобы
другие гетероатомы получили наименьшие
номера. Наименование заместителей в
этих кольцах следует основным правилам
ИЮПАК, приведенным выше.
<>
Отметим,
что в последнем примере углеводород
просто называют бензолом (а не
1,3,5-циклогексатриеном), а соответствующий
радикал - фенилом.
Более сложным
циклическим соединениям обычно дают
тривиальные названия и системы нумерации.
К соединениям этого типа относятся
полициклические ароматические
углеводороды (в которых бензольные
кольца соединены двумя общими атомами)
и гетероциклические соединения (у
которых в состав колец входят гетероатомы).
Важнейшие циклические системы и их
нумерация приведены в табл. 4. Отметим,
что в гетероциклах нумерация начинается
с гетероатома и производится так, чтобы
другие гетероатомы получили наименьшие
номера. Наименование заместителей в
этих кольцах следует основным правилам
ИЮПАК, приведенным выше.
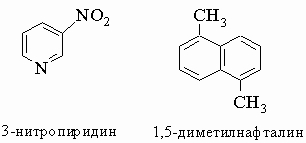 <>
<>
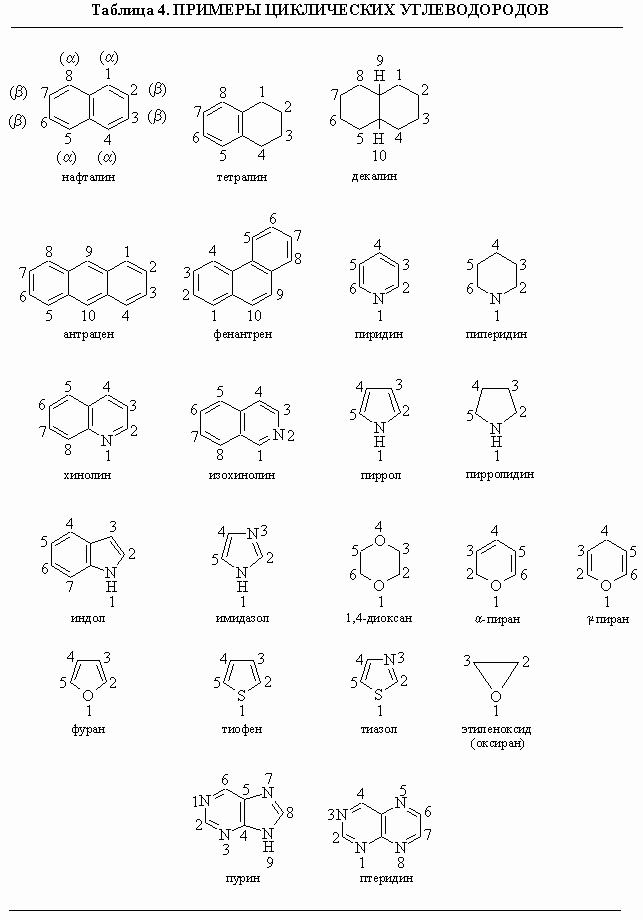 Таблица
4. ПРИМЕРЫ ЦИКЛИЧЕСКИХ УГЛЕВОДОРОДОВ
Таблица
4. ПРИМЕРЫ ЦИКЛИЧЕСКИХ УГЛЕВОДОРОДОВ
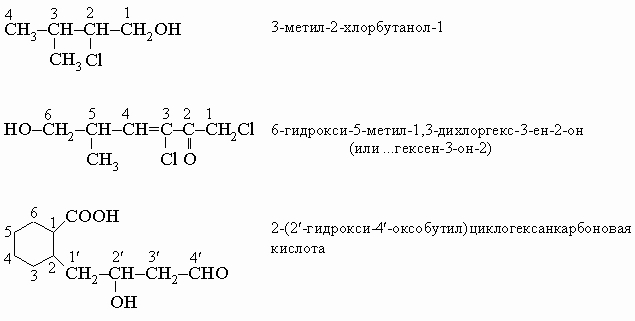
Наиболее широко для построения названий органических соединений правила ИЮПАК рекомендуют использовать заместительную номенклатуру. Общая схема таких названий: 1) префиксы - боковые цепи, затем младшие функции (см. табл. 3) в алфавитном порядке; 2) корень - главная цепь или цикл; 3) суффиксы - кратные связи, главная функция. Например
 <>
Геометрическую
изомерию обозначают приставками цис-
и транс- (см. выше). Оптическую изомерию
обозначают символами D-, L- или мезо -
перед названием соединения, чтобы
указать ряд, к которому оно принадлежит.
Другие системы используются реже.
Направление вращения плоскополяризованного
света часто указывают знаком (+) для
правовращающих и знаком (-) для левовращающих
изомеров. Для кислот, кроме их
систематических наименований, в научной
литературе широко используются
тривиальные названия. Некоторые важные
органические кислоты перечислены ниже
(табл. 5 и 6).
Производные бензола
часто имеют тривиальные названия,
которые широко распространены. Так,
аминобензол называется анилином, а
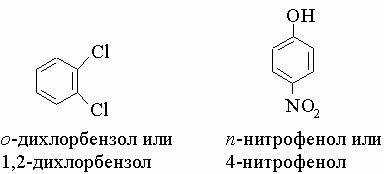
гидроксибензол - фенолом. Дизамещенные
бензольные кольца можно называть,
номеруя атомы углерода кольца, как это
обсуждалось выше, или используя приставки
орто (о-), мета (м-) и пара (п-) для групп,
стоящих рядом, через один или два
незамещенных углерода соответственно.
Так,
<>
Геометрическую
изомерию обозначают приставками цис-
и транс- (см. выше). Оптическую изомерию
обозначают символами D-, L- или мезо -
перед названием соединения, чтобы
указать ряд, к которому оно принадлежит.
Другие системы используются реже.
Направление вращения плоскополяризованного
света часто указывают знаком (+) для
правовращающих и знаком (-) для левовращающих
изомеров. Для кислот, кроме их
систематических наименований, в научной
литературе широко используются
тривиальные названия. Некоторые важные
органические кислоты перечислены ниже
(табл. 5 и 6).
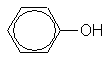
Производные бензола
часто имеют тривиальные названия,
которые широко распространены. Так,
аминобензол называется анилином, а
гидроксибензол - фенолом. Дизамещенные
бензольные кольца можно называть,
номеруя атомы углерода кольца, как это
обсуждалось выше, или используя приставки
орто (о-), мета (м-) и пара (п-) для групп,
стоящих рядом, через один или два
незамещенных углерода соответственно.
Так,
 <>
(Подробнее
см. ниже "Реакции органических
соединений", разд. IV-3.A)
Промежуточные
частицы.
Во многих реакциях принимают участие
промежуточные частицы, обладающие
чрезвычайно высокой реакционной
способностью. В карбанионах углерод
заряжен отрицательно; карбанионы
-сильные основания, они имеют тенденцию
захватывать протон или атаковать
положительные атомные центры. В
карбений-ионах (карбкатионах) углерод
заряжен положительно; карбкатионы
стремятся атаковать центры с высокой
электронной плотностью (атомы, олефиновые
связи, ароматические системы). Карбены
являются незаряженными частицами,
имеющими всего лишь шесть электронов
при углероде; они вступают в химические
реакции, стремясь дополнить свой секстет
до октета. Свободные радикалы также не
заряжены, но имеют неподеленный и
неспаренный электрон и также весьма
реакционноспособны. Эти четыре типа
реакционноспособных частиц представлены
ниже простейшими их представителями,
производными метана:
<>
(Подробнее
см. ниже "Реакции органических
соединений", разд. IV-3.A)
Промежуточные
частицы.
Во многих реакциях принимают участие
промежуточные частицы, обладающие
чрезвычайно высокой реакционной
способностью. В карбанионах углерод
заряжен отрицательно; карбанионы
-сильные основания, они имеют тенденцию
захватывать протон или атаковать
положительные атомные центры. В
карбений-ионах (карбкатионах) углерод
заряжен положительно; карбкатионы
стремятся атаковать центры с высокой
электронной плотностью (атомы, олефиновые
связи, ароматические системы). Карбены
являются незаряженными частицами,
имеющими всего лишь шесть электронов
при углероде; они вступают в химические
реакции, стремясь дополнить свой секстет
до октета. Свободные радикалы также не
заряжены, но имеют неподеленный и
неспаренный электрон и также весьма
реакционноспособны. Эти четыре типа
реакционноспособных частиц представлены
ниже простейшими их представителями,
производными метана:
 <>
<>
В основу научной классификации и номенклатуры органических соединений положены принципы теории химического строения А. М. Бутлерова.
Все органические соединения подразделяют на следующие основные ряды:
I. Ациклические соединения — с открытой цепью углеродных атомов (их называют также алифатическими соединениями, или соединениями жирного ряда):
1. Предельные (насыщенные).
2. Непредельные (ненасыщенные).
II. Циклические соединения — с замкнутой в кольцо цепью атомов.
1. Карбоциклические (изоциклические),— в кольцевую систему которых входят только углеродные атомы:
а) алициклические (предельные и непредельные), б) ароматические.
2. Гетероциклические соединения — в их кольцевую систему, кроме углеродных атомов, входят атомы других элементов — гетероатомы (кислород, азот, сера и т. д.).
В рядах ациклических и карбоциклических соединений основными классами являются углеводороды.
В основе гетероциклических соединений лежат гетероциклы, в которых атомы, образующие кольцо, соединены только с атомами водорода.
В предельных (насыщенных) углеводородах атомы углерода соединены друг с другом простыми (ординарными) связями С—С. В непредельных (ненасыщенных) углеводородах имеются одна или несколько пар углеродных атомов, соединенных кратными — двойными С = С или тройными С ≡ С связями.
Углеводороды с двойными или тройными связями могут быть образованы путем отнятия 2, 4, 6 и более атомов водорода от пар смежных углеродных атомов в предельных углеводородах; при этом получаются непредельные углеводороды, содержащие соответственно двойную, тройную, две двойные и т. д. связи. При отнятии же двух и более атомов водорода от несмежных углеродных атомов из предельных ациклических углеводородов могут быть получены циклические углеводороды.
Таким образом, все другие углеводороды можно рассматривать как производные предельных ациклических углеводородов.
Несколько кратных связей могут иметь различное взаимное расположение в углеродной цепи. Например, различают кумулированные С = С = С, сопряженные (или конъюгированные) С = С—С = С и изолированные (или уединенные) С = С—(СН2)п—С = С двойные связи.
Углеводороды различных классов образуют так называемые гомологические ряды, в которых каждый последующий углеводород отличается от предыдущего члена ряда на гомологическую разность СН2. Состав любого члена гомологического ряда выражается общей для данного ряда эмпирической формулой. Например, состав ациклических предельных углеводородов может быть представлен формулой СnН2n+2, непредельных — с одной двойной связью CnH2n, — с одной тройной или с двумя двойными связями СnН2n – 2 и т. д. Например:
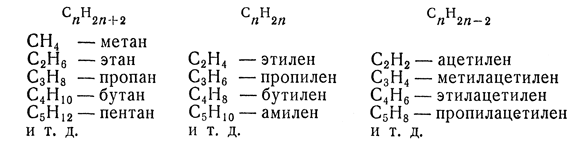
Названия гомологических рядов углеводородов иногда производят от названий их простейших членов, например: углеводороды ряда метана, углеводороды ряда этилена (этиленовые углеводороды), углеводороды ряда ацетилена (ацетиленовые углеводороды).
При замещении в углеводородах того или иного гомологического ряда одного или нескольких атомов водорода отдельными атомами или группами (например, галогенами, группами —NO2, —ОН, —NH2 и т. д.) образуются гомологические ряды, соответственно, галогенпроизводных, нитросоединений, спиртов, аминов и т. д. Таким образом, все другие классы органических соединений того или иного ряда являются производными углеводородов.
Для наименования отдельных органических соединений широкое распространение получили тривиальные названия, рациональная, Женевская (1892 г.) и Льежская (1930 г.) номенклатуры. Среди них наиболее строгой с точки зрения единого принципа наименования органических соединений и однозначности их названий (особенно для ациклических соединений) является Женевская номенклатура. К сожалению, она в свое время не была разработана полностью и не может быть использована как единственная при наименовании очень многих сложных органических соединений.
В 1947 г. на совещании Международного союза чистой и прикладной химии (International Union of Pure and Applied Chemistry — сокращенно IUPAC), состоявшемся в Лондоне, было принято решение о пересмотре существовавших правил номенклатуры органических соединений и о выработке новых международных правил. Созданная комиссия выработала правила, которые в 1957 г. были опубликованы под названием Правила номенклатуры органических соединений IUPAC 1957.
В СССР А. П. Терентьевым с сотрудниками (1951 г.) была предложена систематическая номенклатура, основанная на строгом едином принципе и позволяющая однозначно называть любое органическое соединение. Однако эта номенклатура, вследствие довольно значительного отличия от обычных привычных химикам названий, не является общепринятой.
Ниже дана краткая характеристика различных номенклатурных систем.
Тривиальные названия не вытекают из каких-либо единых систематических принципов номенклатуры; они не выражают строения соединения и обычно отражают историю, происхождение веществ, выделение их из природных продуктов, путь синтеза и т. п. (например, рудничный газ, муравьиная кислота, винный спирт, бензол, ванилин, стрептоцид). Многие соединения названы по имени ученого, открывшего их (кетон Михлера, углеводород Чичибабина и т. п.). Однако и некоторые тривиальные названия приведены в известную систему. Так, в ряду метана все названия углеводородов, начиная от C5, являются систематическими — корни их производятся от греческих числительных, и все они имеют общее окончание -ан (пентан, гексан, гептан) и т. д.; названия же первых четырех представителей этого ряда (метан, этан, пропан, бутан) — тривиальные, так как корни их не образованы по какой-либо системе, однако и эти названия имеют общее для ряда метана окончание -ан. Такие названия по номенклатуре IUPAC обозначаются как полутривиальные или полусистематические (semi-trivial и semi-sistematic).
Рациональная и другие упомянутые номенклатуры построены на принципах научной систематики органических соединений: название соединения должно отражать его химическое строение.
По рациональной номенклатуре за основу наименования органического соединения обычно принимают название наиболее простого (чаще всего первого) члена данного гомологического ряда. Все остальные соединения рассматривают как производные этого простейшего гомолога, образованные замещением в нем атомов водорода углеводородными или иными радикалами, атомами или атомными группами.
По Женевской номенклатуре основой (корнем) названия органического соединения является название нормального углеводорода, содержащего то же число атомов углерода, что и наиболее длинная углеродная цепь в называемом соединении. Приставки (префиксы) и окончания (суффиксы) показывают наличие в этой главной цепи боковых цепей (углеводородных радикалов), функциональных групп, нефункциональных заместителей и кратных связей; при этом цифрами обозначают положение боковых цепей, групп или кратных связей в главной углеродной цепи, а греческими (иногда латинскими) числительными — число одинаковых замещающих групп или кратных связей.
Порядок перечисления в общем женевском названии соединения названий и обозначений всех этих групп и кратных связей определяется их условным старшинством по отношению друг к другу. Названия углеводородных радикалов помещают перед корнем слова (т. е. перед названием главной цепи), а обозначения кратных связей — после корня.
Функциональными группами в производных углеводородов называются группы атомов типа [С]—А—Н, где А — атом или группа атомов кислорода, серы, азота (но не углерода); к функциональным группам относят и карбонильную группу [С] = О. Символ углерода в квадратных скобках указывает, что углерод, несущий функцию, считается частью углеродного скелета. Различают кислород-(или серу-) содержащие и азотсодержащие функциональные группы, В общем названии соединения по Женевской номенклатуре обозначения кислород-(или серу-)содержащих функциональных групп ставятся в конце слова (после корня или обозначения кратной связи), а азотсодержащих — в начале слова (перед корнем или перед названиями радикалов).
К нефункциональным заместителям относят галогены, нитрозо-(—NO), нитро-(—NO2), азидо-(—N3) группы; они не содержат атомов водорода; их обозначения в женевском названии помещают перед названиями азотсодержащих функциональных групп или перед названиями радикалов, а если эти последние отсутствуют — перед корнем слова.
В общем названии соединения вначале указываются младшие, затем старшие группы.
Нумерация углеродных атомов в главной цепи соединения определяется также условным старшинством замещающих групп или кратных связей и их расположением по отношению к одному или другому концу этой цепи. При этом углеводородные радикалы являются старшими по отношению к кратным связям и к другим заместителям (при одинаковом положении двух радикалов по отношению к концам главной цепи старшим является радикал с меньшим числом углеродных атомов). Таким образом, в продуктах замещения углеводородов сохраняется нумерация, принятая для углеводородов.
Ниже приведена схема построения женевского названия сложного органического соединения ациклического ряда, предложенная А. П. Терентьевым (1951 г.).
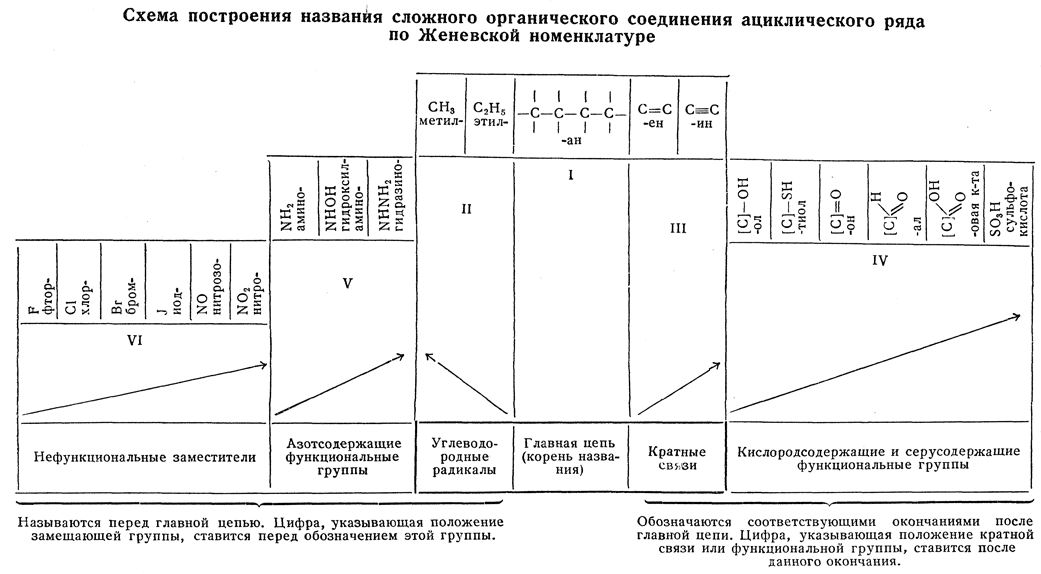
Примечания.
1. Цифры II—VI обозначают уменьшение старшинства групп при определении начала нумерации цепи. Например, если есть углеводородные радикалы (II) и кратные связи (III) — начало нумерации цепи определяется более старшими группами — радикалами; кислородсодержащие группы (IV) старше азотсодержащих групп (V) и т. д.
2. Внутри разделов, обозначенных цифрами II—VI, начало нумерации определяется любой группой данного раздела, стоящей ближе к концу цепи. Если же группы данного раздела расположены симметрично, т. е. на равных расстояниях от концов цепи, начало нумерации определяет старшая группа. Возрастание старшинства в каждом разделе указано стрелками. Например, при симметричном расположении спиртовой и кетонной групп начало нумерации определяет старшая — кетонная группа.
3. В разделе IV каждая серусодержащая группа старше соответствующей кислородсодержащей группы.
По Льежской номенклатуре за основу названия, так же как и по Женевской номенклатуре, принимается самая длинная углеродная цепь, но допускаются и отклонения от этого правила: если боковые радикалы в этой самой длинной цепи оказываются сложными, за основу названия может быть выбрана и более короткая цепь так, чтобы боковые радикалы оказались более простыми.
Главная углеродная цепь, согласно Льежской номенклатуре, должна включать функциональную группу, даже если эта цепь и не является самой длинной; если функциональных групп несколько, главную цепь выбирают так, чтобы в ней оказалось наибольшее число функциональных групп. Аналогично в главную цепь включаются и кратные связи. В то же время карбоксильную группу по Льежской номенклатуре иногда рассматривают как замещающую функциональную группу, тогда как по Женевской номенклатуре углерод карбоксильной группы должен быть включен в счет атомов углерода цепи. Начало нумерации определяет прежде всего функциональная группа, затем двойные и тройные связи и в последнюю очередь атомы и радикалы, обозначаемые приставками (отличие от Женевской номенклатуры). При наличии нескольких функциональных групп начало нумерации определяет главная функция (например, в оксиальдегидах — альдегидная группа; в оксикислотах — карбоксильная группа).
Номенклатура IUPAC 1957. Новые правила, разработанные комиссией IUPAC по номенклатуре органических соединений в период с 1947 по 1957 гг., состоят из разделов: А. Номенклатура углеводородов (ациклических, циклических, терпенов); В. Номенклатура основных гетероциклических систем.
Правила IUPAC 1957 являются развитием и упорядочением в основном Льежской номенклатуры.
За основу ациклических соединений принимается обязательно самая длинная углеродная цепь, но при этом подробно разработана номенклатура боковых цепей — нормальных и разветвленных — и установлено старшинство радикалов при перечислении их в названии и при определении порядка нумерации атомов главной цепи или цикла. Официально введены наиболее употребительные тривиальные и полутривиальные названия многих соединений, принимаемых за основу, а также радикалов.
В 1963 г. опубликован предварительный текст продолжения правил IUPAC, раздел С, в который входит номенклатура соединений, содержащих функциональные группы, и номенклатура функциональных производных. Правила регламентируют выбор главной функции и предлагают ряд способов наименования для каждого типа соединений. См. International Union of Pure and Applied Chemistry. Tentative Rules for Nomenclature of Organic Chemistry, Section C. London Butterworths Scientific Publications, 1963.
Ниже приведены официальные тексты правил Женевской и Льежской номенклатур, а также правил IUPAC 1957.
Предварительно даны используемые в различных номенклатурных системах названия важнейших радикалов и атомных групп, сокращения, приставки и окончания, а также греческие (и некоторые латинские) числительные и буквы греческого алфавита.
Приведены некоторые дополнительные сведения о способах наименования органических соединений различных классов, которые используются в практике наряду с правилами указанных выше номенклатур, а также сведения о названиях по старой рациональной номенклатуре.
Тривиальные и систематические названия некоторых радикалов и атомных групп по различным номенклатурным системам




Содержание
Введение
1. Предельные углеводороды
1.1. Насыщенные неразветвленные соединения
1.1.1. Одновалентные радикалы
1.2. Насыщенные разветвленные соединения с одним заместителем
1.3. Насыщенные разветвленные соединения с несколькими заместителями
2. Непредельные углеводороды
2.1. Ненасыщенные неразветвленные углеводороды с одной двойной связью (алкены)
2.2. Ненасыщенные неразветвленные углеводороды с одной тройной связью (алкины)
2.3. Ненасыщенные разветвленные углеводороды
3. Циклические углеводороды
3.1. Алифатические углеводороды
3.2. Ароматические углеводороды
3.3. Гетероциклические соединения
4. Углеводороды содержащие функциональные группы
4.1. Спирты
4.2. Альдегиды и кетоны 18
4.3. Карбоновые кислоты 20
4.4. Эфиры 22
4.4.1. Простые эфиры 22
4.4.2. Сложные эфиры 23
4.5. Амины 24
5. Органические соединения с несколькими функциональными группами 25
Литература
Введение
В основу научной классификации и номенклатуры органических соединений положены принципы теории химического строения органических соединений А.М. Бутлерова.
Все органические соединения подразделяют на следующие основные ряды:
Ациклические — их называют также алифатическими, или соединениями жирного ряда. Эти соединения имеют открытую цепь углеродных атомов.
К ним относятся:
Предельные (насыщенные)
Непредельные (ненасыщенные)
Циклические — соединения с замкнутой в кольцо цепью атомов. К ним относятся:
1. Карбоциклические (изоциклические) – соединения, в кольцевую систему которых входят только углеродные атомы это: а) алициклические (предельные и непредельные); б) ароматические.
Гетероциклические — соединения, в кольцевую систему которых, кроме атома углерода, входят атомы других элементов — гетероатомы (кислород, азот, сера и др.)
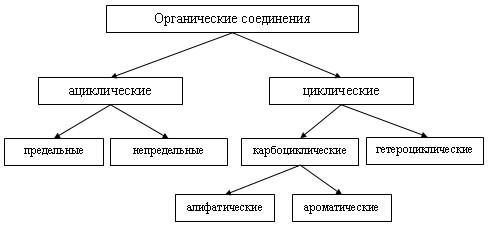
Схема 1
В настоящее время для наименования органических соединений применяются три типа номенклатуры: тривиальная, рациональная и систематическая номенклатура — номенклатура IUPAC (ИЮПАК) — International Union of Pure and Applied Chemistry (Международного союза теоретической и прикладной химии).
Тривиальная (историческая) номенклатура — первая номенклатура, возникшая в начале развития органической химии, когда не существовало классификации и теории строения органических соединений. Органическим соединениям давали случайные названия по источнику получения (щавелевая кислота, яблочная кислота, ванилин), цвету или запаху (ароматические соединения), реже — по химическим свойствам (парафины). Многие такие названия часто применяются до сих пор. Например: мочевина, толуол, ксилол, индиго, уксусная кислота, масляная кислота, валериановая кислота, гликоль, аланин и многие другие.
Рациональная номенклатура — по этой номенклатуре за основу наименования органического соединения обычно принимают название наиболее простого (чаще всего первого) члена данного гомологического ряда. Все остальные соединения рассматриваются как производные этого соединения, образованные замещением в нем атомов водорода углеводородными или иными радикалами (например: триметилуксусный альдегид, метиламин, хлоруксусная кислота, метиловый спирт). В настоящее время такая номенклатура применяется только в тех случаях, когда она дает особенно наглядное представление о соединении.
Систематическая номенклатура — номенклатура IUPAC — международная единая химическая номенклатура. Систематическая номенклатура основывается на современной теории строения и классификации органических соединений и пытается решить главную проблему номенклатуры: название каждого органического соединения должно содержать правильные названия функций (заместителей) и основного скелета углеводорода и должно быть таким, чтобы по названию можно было написать единственно правильную структурную формулу.
Процесс создания международной номенклатуры был начат в 1892 г. (Женевская номенклатура), продолжен в 1930 г. (Льежская номенклатура), с 1947 г. дальнейшее развитие связано с деятельностью комиссии ИЮПАК по номенклатуре органических соединений. Публиковавшиеся в разные годы правила ИЮПАК собраны в 1979 г. в “голубой книге” [Nomenclature of Organic Chemistry, Section A, B, C, D, E, F and H, Oxford Pergamon Press, 1979]. Своей задачей комиссия ИЮПАК считает не создание новой, единой системы номенклатуры, а упорядочение, “кодификацию”, имеющейся практики. Результатом этого является сосуществование в правилах ИЮПАК нескольких номенклатурных систем, а, следовательно, и нескольких допустимых названий для одного и того же вещества. Правила ИЮПАК опираются на следующие системы: заместительную, радикало-функциональную, аддитивную (соединительную), заменительную номенклатуру и т.д.
В заместительной номенклатуре основой названия служит один углеводородный фрагмент, а другие рассматриваются как заместители водорода (например, (C6H5)3CH – трифенилметан).
В радикало-функциональной номенклатуре в основе названия лежит название характеристической функциональной группы, определяющей химический класс соединения, к которому присоединяют наименование органического радикала, например:
C2H5OH — этиловый спирт;
C2H5Cl — этилхлорид;
CH3–O–C2H5 — метилэтиловый эфир;
CH3–CO–CH = CH2 — метилвинилкетон.
В соединительной номенклатуре название составляют из нескольких равноправных частей (например, C6H5–C6H5 бифенил) или добавляя обозначения присоединенных атомов к названию основной структуры (например, 1,2,3,4-тетрагидронафталин, гидрокоричная кислота, этиленоксид, стиролдихлорид).
Заменительную номенклатуру применяют при наличии неуглеродных атомов (гетероатомов) в молекулярной цепи: корни латинских названий этих атомов с окончанием “а” (а-номенклатура) присоединяют к названиям всей структуры, которая получилась бы, если бы вместо гетероатомов был углерод (например, CH3–O–CH2–CH2–NH–CH2–CH2–S–CH3 2-окса-8-тиа-5-азанонан).
Система ИЮПАК является общепризнанной в мире, и лишь адаптируется соответственно грамматике языка страны. Полный набор правил применения системы ИЮПАК ко многим менее обычным типам молекул длинен и сложен. Здесь представлено лишь основное содержание системы, но это позволяет осуществлять наименование соединений, для которых применяется система.
1. Предельные углеводороды
1.1. Насыщнные неразветвленные соединения
Названия первых четырех предельных углеводородов тривиальные (исторические названия) — метан, этан, пропан, бутан. Начиная с пятого, названия образованы греческими числительными, соответствующими количеству атомов углерода в молекуле, с добавлением суффикса "–АН", за исключением числа "девять", когда корнем служит латинское числительное "нона".
Таблица 1. Названия предельных углеводородов
ФОРМУЛА |
НАЗВАНИЕ |
|
ФОРМУЛА |
НАЗВАНИЕ |
СН4 |
метан |
|
С6Н14 |
гексан |
С2Н6 |
этан |
|
С7Н16 |
гептан |
С3Н8 |
пропан |
|
С8Н18 |
октан |
С4Н10 |
бутан |
|
С9Н20 |
нонан |
С5Н12 |
пентан |
|
С10Н22 |
декан |
1.1.1. Одновалентные радикалы
Одновалентные радикалы, образованные из насыщенных неразветвленных предельных углеводородов отнятием водорода от конечного углеродного атома, называют заменяя суффикс"–АН" в названии углеводорода суффиксом "–ИЛ".
Атом углерода со свободной валентностью получает номер ? Эти радикалы называют нормальными или неразветвленными алкилами:
СН3– — метил;
СН3–СН2–СН2–СН2– — бутил;
СН3–СН2–СН2–СН2–СН2–СН2– — гексил.
Таблица 2. Названия углеводородных радикалов
ФОРМУЛА |
НАЗВАНИЕ |
|
ФОРМУЛА |
НАЗВАНИЕ |
СН3– |
метил |
|
С6Н13– |
гексил |
С2Н5– |
этил |
|
С7Н15– |
гептил |
С3Н7– |
пропил |
|
С8Н17– |
октил |
С4Н9– |
бутил |
|
С9Н29– |
нонил |
С5Н11– |
пентил |
|
С10Н21– |
декил |
1.2. Насыщенные разветвленные соединения с одним заместителем
Номенклатура ИЮПАК для алканов в индивидуальных названиях сохраняет принцип Женевской номенклатуры. Называя алкан, исходят из названия углеводорода, отвечающего самой длиной углеродной цепи в данном соединении (главная цепь), а затем указывают радикалы, примыкающие к этой основной цепи.
Главная углеродная цепь, во-первых, должна быть самой длинной, во-вторых, если имеются две или более одинаковые по длине цепи, то из них выбирается наиболее разветвленная.
*Для названия насыщенных разветвленных соединений выбирают самую длинную цепочку из атомов углерода:
*Нумеруют выбранную цепь от одного конца до другого арабскими цифрами, причем, нумерацию начинают с того конца, к которому ближе находится заместитель:
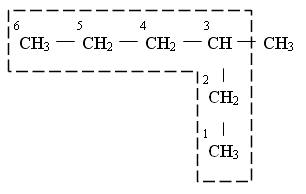
*Указывают положение заместителя (номер атома углерода, у которого находиться алкильный радикал):
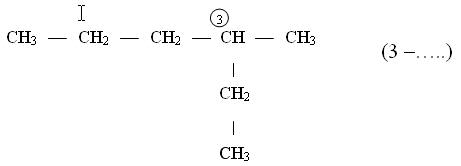
*Называют алкильный радикал в соответствии с его положением в цепи:
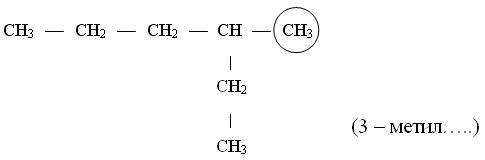
*Называют основную (самую длинную углеродную цепь):
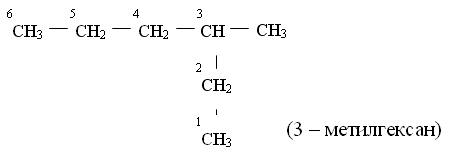
Если заместителем будет являться галоген (фтор, хлор, бром, йод), то все номенклатурные правила сохраняются:
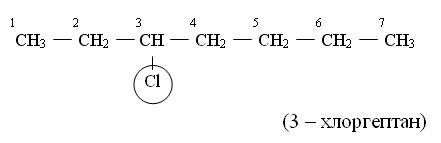
Тривиальные названия сохраняются только для следующих углеводородов:
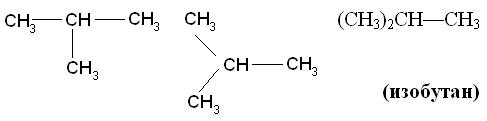
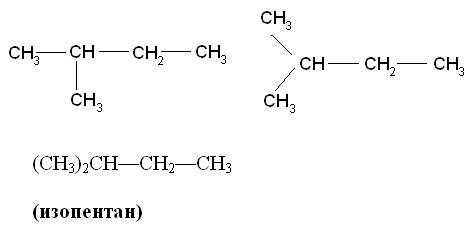
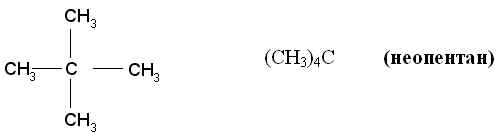
Если в углеводородной цепи находятся, несколько одинаковых заместителей, то перед их названием ставится приставка “ди”, “три”, “тетра”, “пента”, “гекса” и т.д., обозначающая число присутствующих групп: