
Скільки грамів розчиненої речовини міститься в 50 г розчину з масовою часткою = 10 %?
10 г
20 г
*5 г
40 г
25 г
Скільки грамів розчиненої речовини міститься в 80 г розчину з масовою часткою = 20 %?
20 г
*16 г
32 г
8 г
12 г
Скільки грамів розчиненої речовини міститься в 150 г розчину з масовою часткою = 50 % ?
20 г
50 г
100 г
*75 г
25 г
Скільки моль розчиненої речовини міститься в 1 л децимолярного розчину?
0,2 моль
1 моль
*0,1 моль
0,02 моль
0,025 моль
Скільки моль розчиненої речовини міститься в 2 л одномолярного розчину?
0,1 моль
0,2 моль
0,5 моль
*2,0 моль
2,5 моль
Вкажіть концентрацію розчину, якщо для приготування 2 л розчину взяли 3 моль речовини:
3 моль/л
2 моль/л
*1,5 моль/л
0,67 моль/л
0,25 моль/л
Вкажіть концентрацію розчину, якщо для приготування 10 л розчину використали 4 моль розчиненої речовини:
4 моль/л
10 моль/л
2,5 моль/л
*0,4 моль/л
0,45 моль/л
Вкажіть концентрацію розчину, якщо для приготування 5 л розчину використали 10 моль розчиненої речовини:
5 моль/л
*2 моль/л
0,5 моль/л
10 моль/л
15 Моль
Вкажіть концентрацію розчину, якщо для приготування 200 г розчину використали 40 грам розчиненої речовини:
*20 %
40 %
5 %
10 %
15%
Вкажіть концентрацію розчину, якщо для приготування 150 г розчину використали 15 грам розчиненої речовини:
15 %
1,5 %
*10 %
5 %
3%
Що таке двохмолярний розчин? Це розчин, який містить:
2 г розчиненої речовини в 100 г розчину
2 моль розчиненої речовини в 1 л води
2 моль розчиненої речовини в 1 л розчинника
*2 моль розчиненої речовини в 1 л розчину
2 моль розчиненої речовини в 2 л розчину
Скільки розчиненої речовини міститься в 3 літрах розчину з концентрацією 1,5 моль на літр розчину?
1,5 моль
3 г
*4,5 моль
1,5 г
4 г
Скільки розчиненої речовини міститься в 4 літрах розчину з концентрацією 1 моль на 1 л розчину?
2 моль
*4 моль
1 моль
4 г
5 г
Скільки розчиненої речовини міститься в 3 літрах розчину з концентрацією 2 моль на 1 л розчину?
1 моль
2 моль
3 моль
3 г
*6 моль
Скільки розчиненої речовини міститься в 100 г 20 % розчину?
20 моль
40 моль
100 г
25 г
*20 г
Скільки розчиненої речовини міститься в 100 г розчину натрій хлориду з концентрацією 3 %?
30 г
27 г
*3 г
6 г
1,5 г
Для приготування 2 л розчину натрій хлориду взяли 4 моль цієї речовини. Яка молярна концентрація одержаного розчину?
1 моль/л
*2 моль/л
4 моль/л
2 %
6 моль/л
Для приготування 5 л розчину калій сульфату взяли 15 моль цієї речовини. Яка молярна концентрація одержаного розчину?
3 %
*3 моль/л
30 %
15 моль/л
6 моль/л
Для приготування 400 г розчину арґентум нітрату взяли 80 г солі. Яка масова частка солі в розчині?
80 %
40 %
20 моль/л
*20 %
10%
Для приготування 200 г розчину магній нітрату взяли 20 г солі. Яка масова частка солі в розчині?
*10 %
20 %
10 моль/л
20 моль/л
15%
Крива розчинності – це крива залежності розчинності речовини (в грамах на 100 г води) від:
Тиску
*Температури
Кількості розчинника
Кольору
Концентрації
При пониженні температури відбувається виділення розчиненої речовини з розчину. Цей процес називається:
*Кристалізація
Гідратація
Кон′югація
Розчинення
Солюбілізація
Процес розчинення сульфатної кислоти супроводжується:
Зменшенням тиску
Підвищенням тиску
Поглинанням теплоти
*Виділенням теплоти
Зменшенням об’єму
Процес розчинення калій гідроксиду супроводжується:
Пониженням тиску
Поглинанням теплоти
Підвищенням тиску
*Виділенням теплоти
Зменшенням об’єму
Процес розчинення амоній нітрату супроводжується:
Пониженням тиску
*Поглинанням теплоти
Підвищенням тиску
Виділенням теплоти
Зменшенням об’єму
Внаслідок взаємодії розчиненої речовини з будь-яким розчинником утворюються сполуки, які називаються:
Асоціати
Нітрати
Ацетати
*Сольвати
Гідрати
Існують різні теорії процесу розчинення, а хімічну теорію висунув:
Коновалов
Курнаков
*Менделєєв
Ломоносов
Бутлеров
При розчиненні безбарвної безводної солі купрум (II) сульфату у воді, розчин забарвлюється у голубий колір. Чим це зумовлено?
*Утворенням гідратної оболонки йону Cu2+
Утворенням гідратної оболонки йону SO

Розчиненням молекул CuSO4
Дисоціацією молекул CuSO4
Утворенням дисперсної системи
До колігативних властивостей розчинів належать:
Синерезис
Седиментаційна стійкість
Кінетична стійкість
Ефект Тіндаля
* Осмос і осмотичний тиск
З переліку колігативних властивостей розчину виберіть ту, що є зайвою:
Зниження тиску насиченої пари розчинника над розчином
Підвищення температури кипіння розчину порівняно з чистим розчинником
Зниження температури замерзання розчину порівняно з чистим розчинником
Осмотичний тиск
* Синерезис
До колігативних властивостей розчинів належить:
Сидементаціна стійкість
Кінетична стійкість
*Зниження температури замерзання розчину порівняно з розчинником
Синергезис
Ефект Тіндаля
До колігативних властивостей розчинів належить:
* Підвищення температури кипіння розчину порівняно з розчинником
Кінетична стійкість
Сидементаціна стійкість
Синергезис
Ефект Тіндаля
До колігативних властивостей розчинів належить:
Сидементаціна стійкість
*Зниження тиску насиченої пари розчинника над розчином
Кінетична стійкість
Синергезис
Ефект Тіндаля
Тиск насиченої пари це:
Тиск внаслідок броунівського руху
*Тиск пари, яка перебуває у рівновазі з рідиною
Атмосферний тиск
Тиск пари внаслідок водневого зв’язку між молекулами
Осмотичний тиск
Яке твердження правильне:
Тиск насиченої пари над розчином прямо пропорційний атмосферному тиску
Тиск насиченої пари над розчином прямо пропорційний молярній концентрації розчину
Тиск насиченої пари над розчином прямо пропорційний масовій частці розчину
Тиск насиченої пари над розчином прямо пропорційний моляльній концентрації розчину
* Тиск насиченої пари над розчином прямо пропорційний мольній частці розчинника
Виберіть формулу, що характеризує тиск насиченої пари над розчином:
p = C∙R∙T
p = k∙Na∙C
p = k∙Na∙w
*P = k∙Na
p = R∙T
Виберіть правильний вираз закону Рауля:
Δp =νB
*Δp/p0 =νB/(νA + νB)
Δp/p0 = νA + νB
Δp = νB · νA
Δp/p0 = νB · νA
Перший закон Рауля звучить:
відносне зниження тиску насиченої пари розчину нелеткого електроліту дорівнює молярній концентрації розчиненої речовини
відносне зниження тиску насиченої пари розчинника над розчином нелеткого електроліту дорівнює масовій частці розчиненої речовини
відносне зниження тиску насиченої пари розчинника над розчином нелеткого електроліту дорівнює молярній концентрації еквівалентів розчину
*відносне зниження тиску насиченої пари розчинника над розчином нелеткого електроліту дорівнює мольній частці розчиненої речовини
відносне зниження тиску насиченої пари неелектроліту дорівнює титру розчиненої речовини
Другий закон Рауля звучить:
Підвищення температури кипіння, чи зниження температури замерзання розчину прямо пропорційні об'ємній частці розчину
*Підвищення температури кипіння, чи зниження температури замерзання розчину прямо пропорційні моляльній концентрації розчину
Підвищення температури кипіння, чи зниження температури замерзання розчину прямо пропорційні масовій частці розчину
Підвищення температури кипіння, чи зниження температури замерзання розчину прямо пропорційні об’єму розчину
Підвищення температури кипіння, чи зниження температури замерзання розчину прямо пропорційні моляльній концентрації еквівалентів розчину
Знайдіть правильний запис другого закону Рауля:
ΔTкип=K∙Cm
ΔTкип=E∙Cн
ΔTкип=E∙CМ
ΔTкип=E∙Т
* ΔTкип=E∙Cm
Знайдіть правильний запис другого закону Рауля:
*ΔTзам=K∙Cm
ΔTзам=К∙Cн
ΔTзам=К∙CМ
ΔTзам=К∙Т
ΔTзам=E∙Cm
Виберіть правильний запис виразу для визначення молекулярної маси неелектроліту методом кріоскопії:

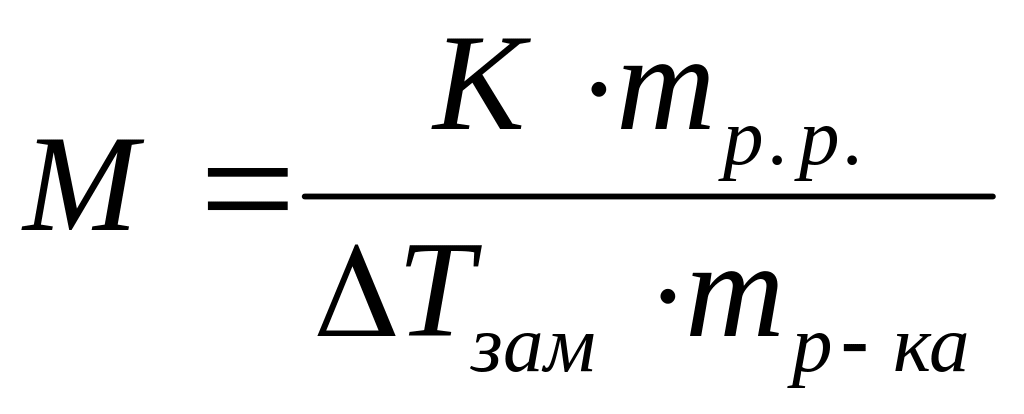
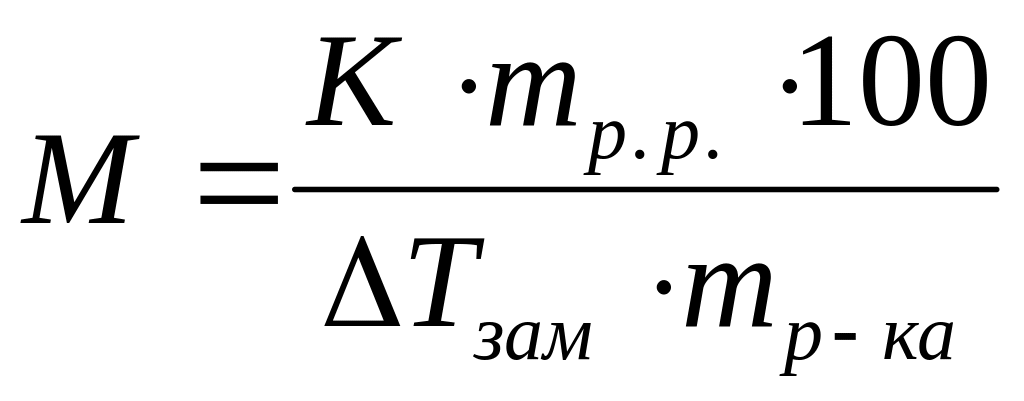
*
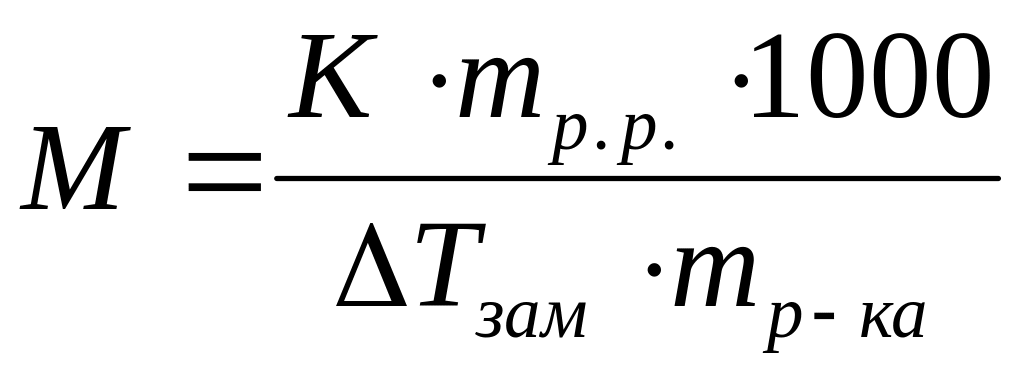
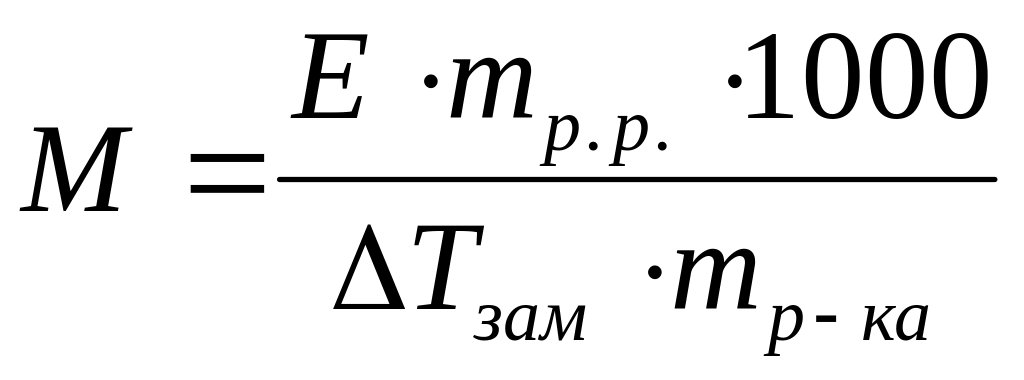
Виберіть правильний запис виразу для визначення молекулярної маси неелектроліту методом ебуліоскопії:
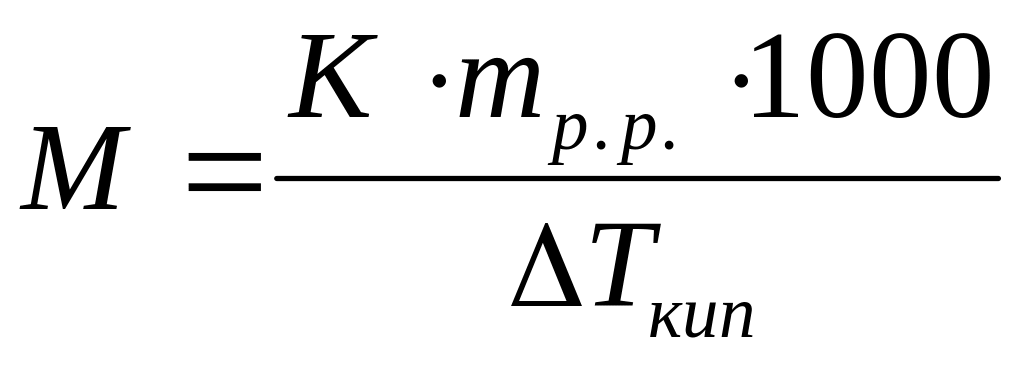

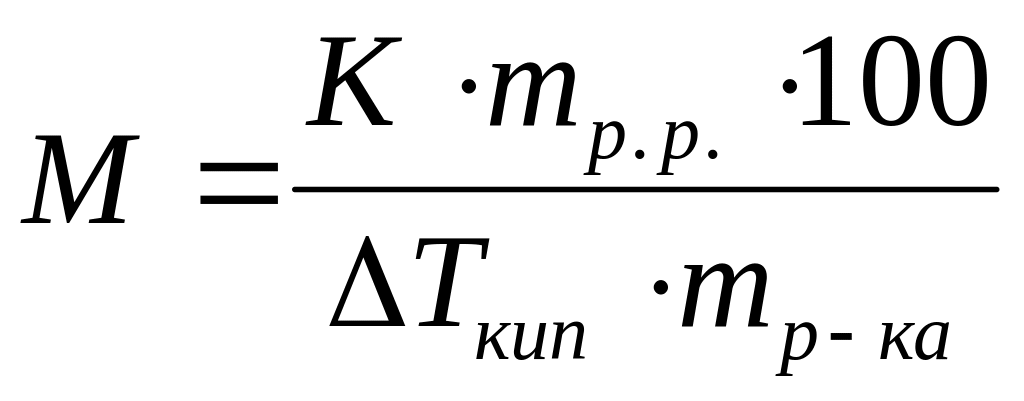

*
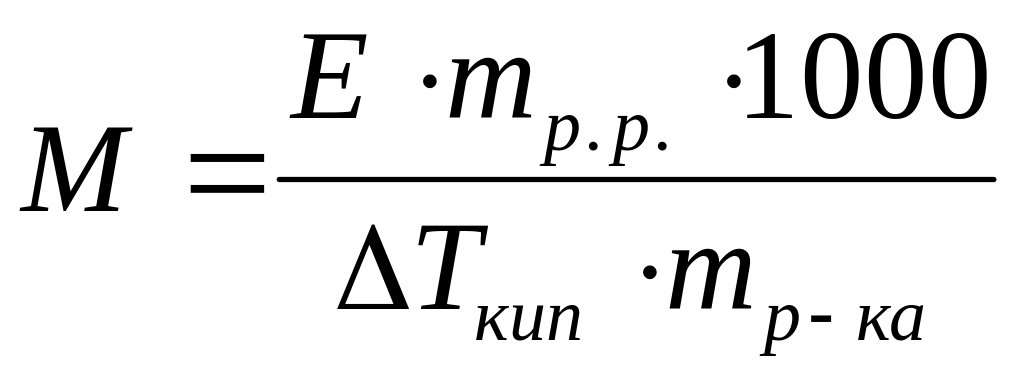
Ізотонічний коефіцієнт це:
Відношення загального числа молекул у розчині до утворених чистинок розчиненого електроліту
*Відношення числа утворених частинок у розчині до загального числа молекул розчиненого електроліту
Добуток числа утворених частинок у розчині і загального числа молекул розчиненого електроліту
Різниця числа утворених частинок у розчині і загального числа молекул розчиненого електроліту
Сума числа утворених частинок у розчині і загального числа молекул розчиненого електроліту
Виберіть правильний вираз для розрахунку ізотонічного коефіцієнта:
i=Ni ·2N0
i=Ni - N0
i=Ni + N0
*i=Ni/N0
i=Ni · N0
Виберіть правильний вираз для визначення молекулярної маси електроліту методом кріоскопії:

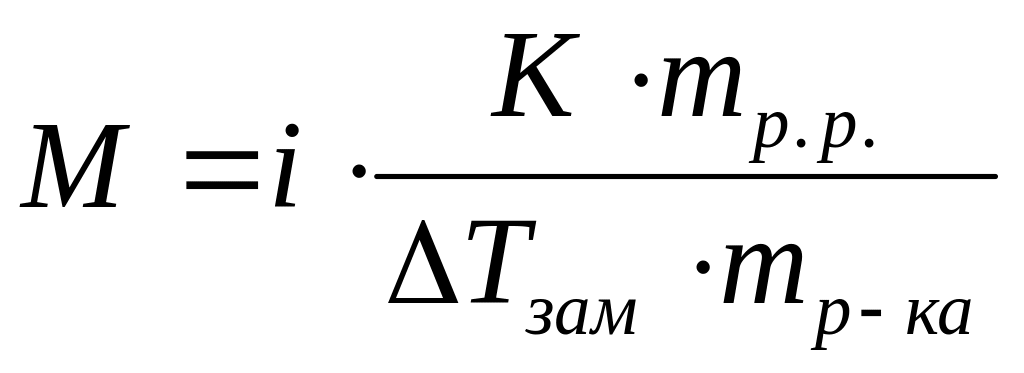

*


Виберіть правильний математичний вираз для визначення молекулярної маси електроліту методом ебуліоскопії:




*

Виберіть вираз, що пов'язує ізотонічний коефіцієнт зі ступенем іонізації:
i=α(n -1)
i=α(n -1)/2
*i=1 + α(n -1)
i=α(n +1)
i=α(n -1) -1
Виберіть правильний запис виразу ступеня іонізації:
*α= i-1/n-1
α= i-1
α= n-1
α= (i-1)n
α= 2n-1
Дифузія це:
Седиментація
Процес руху частинок під дією електричного поля
*Самочинний процес вирівнювання концентрації речовини у всьому об’ємі розчину, зумовлений тепловим рухом частинок
процес міграції частинок
процес руху під дією сили тяжіння
Осмос це:
Седиментація
Процес руху частинок під дією електричного поля
Процес руху під дією сили тяжіння
Самочинний процес вирівнювання концентрації речовини у всьому об’ємі розчину, зумовлений тепловим рухом частинок
* Одностороння дифузія молекул розчинника крізь напівпроникну мембрану з розчину з меншою концентрацією у розчин з більшою концентрацією
Виберіть правильний запис виразу для осмотичного тиску у розчинах неелектролітів:
π = CНRT
π = CMR
π = CMT
*π = CМRT
π = WRT
Виберіть правильний вираз для осмотичного тиску у розчинах розведених електролітів:
π = iCНRT
π = iCMR
π = iCMT
*π =iCMRT
π = iWRT
Величина R, що використовується у рівнянні π = CМRT є:
Сталою Планка
*Універсальною газовою сталою
Сталою Авогадро
Сталою Больцмана
Числом Фарадея
Метод дослідження, що використовують для визначення молярної маси речовини, який ґрунтується на вимірюванні осмотичного тиску називається:
Потенціометрією
Хроматографією
Кріоскопією
Ебуліоскопією
* Осмометрією
Розчини з однаковим осмотичним тиском називаються:
Осмотичними
Тонічними
*Ізотонічними
Гіпертонічними
Гіпотонічними
Якщо осмотичний тиск одного розчину більший ніж другого, то перший відносно другого є:
Осмотичним
Тонічним
Ізотонічним
*Гіпертонічним
Гіпотонічним
Якщо осмотичний тиск одного розчину менший ніж другого, то перший відносно другого є:
Осмотичним
Тонічним
Ізотонічним
Гіпертонічним
* Гіпотонічним
У рівнянні π =i CMRT літерою „і” позначається:
*Ізотонічний коефіцієнт
Стала Больцмана
Кріоскопічна стала
Ебуліоскопічна стала
Коефіцієнт пропорційності
У рівнянні α= i-1/(n-1) літерою „α” позначено:
Коефіцієнт пропорційності
Ебуліоскопічна стала
Кріоскопічна стала
*Ступенінь іонізації
Ізотонічний коефіцієнт
У рівняння π =i CMRT літерою „π” позначено є:
Парціальний тиск
Тиск насиченої пари
*Осмотичний тиск
Атмосферний тиск
Артеріальнимй тиск
Універсальна газова стала R вимірюється в:
Дж ·моль ·К
моль· К
моль
Дж
* Дж/моль ·К
Кріоскопічна стала залежить від:
Концентрації розчину
Природи розчиненої речовини
Часу розчинення
Об’єму розчинника
* Природи розчинника
Ебуліоскопічна стала залежить від:
Концентрації розчину
Природи розчиненої речовини
Часу розчинення
Об’єму розчинника
* Природи розчинника
Явище руйнування еритроцитів при введенні у плазму крові гіпотонічних розчинів, що супроводжується виходом гемоглобіну у плазму називають:
Осмосом
Солюбілізацією
Гомеостазом
Плазмолізом
* Гемолізом
Явище руйнування еритроцитів при введенні у плазму крові гіпертонічних розчинів, що супроводжується втратою води та зморщенням:
Осмосом
Солюбілізацією
Гомеостазом
*Плазмолізом
Гемолізом
Виберіть правильний запис виразу для підвищення температури кипіння:
ΔТкип =Ткип р-ну/Ткип р-ка
ΔТкип =1 - Ткип р-ка
ΔТкип =Ткип р-ну·Ткип р-ка
ΔТкип =Ткип р-ка -Ткип р-ну
* ΔТкип =Ткип р-ну - Ткип р-ка
Виберіть правильний заппс виразу для зниження температури замерзання:
ΔТзам =Тзам р-ну/Тзам р-ка
ΔТзам =1 – Тзам р-ка
ΔТзам =Тзам р-ну·Тзам р-ка
ΔТзам =Тзам р-ка /Тзам р-ну
* ΔТзам =Тзам р-ка – Тзам р-ну
Катіони – це:
*Позитивно заряджені йони
Негативно заряджені йони
Нейтральні частинки
Катод
Анод
Аніони – це:
Позитивно заряджені йони
*Негативно заряджені йони
Нейтральні частинки
Анод
Катод
Виберіть простий йон:
*Сl-
SO42-
NH4+
NO3-
СО32-
Виберіть простий йон:
HPO42-
SiO32-
SO32-
*Na+
NH4+
Виберіть складний йон:
Сl-
S2-
*NH4+
Ca2+
І-
Виберіть складний йон:
Fe3+
*СlO4-
F-
Br-
І-
Виберіть формулу амфоліту:
H2SO4
NaOH
CaSO4
*Zn(OH)2
НІ
Виберіть формулу амфоліту:
*Аl(OH)3
NaCl
К2SO4
НСl
NaOH
Виберіть пару речовин, які дисоціюють ступінчасто:
Купрум (ІІ) гідроксид, купрум (ІІ) хлорид
Алюміній нітрат, нітратна кислота
*Ферум (ІІІ) гідроксид, сульфідна кислота
Ферум (ІІІ) сульфат, натрій гідроксид
Калій гідроксид, алюміній гідроксид
Виберіть пару речовин, які дисоціюють ступінчасто:
*Калій дигідрогенфосфат, фосфатна кислота
Калій гідроксид, натрій фторид
Йодидна кислота, калій хлорид
Ціанідна кислота, калій ціанід
Хлоридна кислота, натрій хлорид
Виберіть пару речовин, які дисоціюють ступінчасто:
Рубідій нітрат, бромідна кислота
Калій сульфат, калій сульфіт
Натрій фосфат, амоній карбонат
Калій гідроксид, натрій фторид
*Карбонатна кислота, купрум (ІІ) гідроксохлорид
Виберіть пару речовин, які дисоціюють ступінчасто:
Калій бромід, натрій карбонат
*Алюміній дигідроксобромід, натрій гідросульфіт
Калій нітрат, цезій хлорид
Натрій оксид, барій нітрат
Калій гідроксид, натрій фторид
Які речовини вступають у реакцію, що її можна записати таким йонно-молекулярним рівнянням: Zn(OH)42- + 4Н+ = Zn2+ + 4Н2О?
Гідроксохлорид цинку та хлоридна кислота
Гідроксид цинку та нітратна кислота
*Тетрагідроксоцинкат натрію та сульфатна кислота
Гідроксоацетат цинку та ацетатна кислота
Гідроксохлорид цинку та бромідна кислота
Ступінь електролітичної дисоціації одноосновної кислоти у розчині становить 0,8. Яке сумарне число йонів припадає на кожні 100 молекул кислоти у розчині?
8
20
*160
80
50
Як дисоціює гідрогенфосфат калію?
В одну стадію, повністю
*У дві стадії: за першою - повністю, за другою – частково
У дві стадії: за першою - частково, за другою – повністю
У дві стадії, за кожною – частково
У три стадії
Який йон називається йоном гідроксонію?
*Н3О+
ОН-
Н2О
Н+
О2-
Визначте реакцію середовища у водних розчинах сульфіту та сульфату натрію.
Розчини нейтральні
Розчини лужні, лужність розчину сульфіту більша
*Розчин сульфіту лужний, а сульфату нейтральний
Розчин сульфіту нейтральний, а сульфату лужний
Розчини кислі
Яка схема відповідає дисоціації хром (ІІІ) гідроксонітрату як сильного електроліту?
*CrOH(NО3)2 = Сr3+ + ОН- + 2NО3-
CrOH(NО3)2 = CrO+ + HNО3 + NO3-
CrOH(NО3)2 + 2H2О = Cr(OH)3 + 2HNО3
CrOH(NО3)2 = CrOH3+ + 2NО3-
CrOH(NО3)2 = CrOH2+ + 2NО3-
Нейтралізація між якими кислотою і основою виражається йонно-молекулярним рівнянням НА + ОН- = А- + Н2О?
Сильної кислоти слабкою основою
*Слабкої кислоти сильною основою
Слабкої кислоти слабкою основою
Сильної кислоти сильною основою
Слабкою основою середньої сили кислоти
Яке твердження є неправильним?
Електроліти - провідники електрики другого роду
У розчині йони безладно рухаються
Процес дисоціації оборотний
*Неелектроліти при розчиненні у воді розпадаються (дисоціюють) на Йони
Слабкі електроліти дисоціюють частково
Електролітами є:
Сполуки з неполярним зв’язком
Провідники першого роду
*Сполуки з йонним або ковалентним дуже полярним зв’язком
Сполуки з металічним зв’язком
Сполуки, що мають водневий зв’язок
Теорію електролітичної дисоціації запропонував:
М. Ломоносов
*Арреніус
Вернер
Освальд
Д. Менделєєв
Амфоліти (амфотерні речовини) у водному розчині:
Дисоціюють тільки при великих концентраціях
Дисоціюють тільки в присутності кислот
Не дисоціюють на йони, а розпадаються без утворення йонів
*Дисоціюють як основи і як кислоти
Дисоціюють тільки у присутності основ
Основа Zn(OH)2 належить до:
Неелектролітів
*Амфотерних основ
Лугів
Однокислотних основ
Трикислотних основ
Ступінчасто дисоціюють:
*Кислі солі слабких кислот
Середні солі
Прості речовини
Оксиди
Однокислотні солі
Яке твердження є неправильним? „Ступінь дисоціації ... ”
Залежить від природи розчинника
Залежить від температури
Залежить від природи розчиненої речовини
*Не залежить від концентрації розчину
Залежить від о’бєму розчинника
Йонним добутком води називають:
Добуток ступеня дисоціації води і рівноважної концентрації води
*Добуток рівноважних концентрацій йонів Гідрогену і гідроксид-йонів
Добуток [Н2О] і [Н+]
Добуток [Н2О] і [ОН-]
Сума ступеня дисоціації води і рівноважної концентрації води
Водневий показник вказує на
*Концентрацію йонів Гідрогену
Добуток [Н2О] і [Н+]
Концентрацію недисоційованих молекул води
Добуток [Н2О] і [ОН-]
Добуток [Н2О]
У кислому середовищі
Концентрація [Н+] менше, ніж [ОН-]
Концентрація [Н+] більша, ніж [Н2О]
*Концентрація [Н+] більше, ніж [ОН-]
Концентрація [Н+] дорівнює [Н2О]
Концентрація [Н+] дорівнює [ОН-]
Які йони не можуть одночасно перебувати у помітних кількостях у водному розчині?
Na+ та SО42-
К+ та ОН-
*Н+ та СО32-
Ag+ та NО3-
К+ та І-
Виберіть ряд речовин, де всі речовини сильні електроліти:
*Натрій хлорид, перманганатна кислота, барій гідроксид
Йодидна кислота, фторидна кислота, купрум (ІІ) гідроксид
Карбонатна кислота, ферум (ІІІ) гідроксид, амоній гідроксид
Фторидна кислота, нітритна кислота, ферум (ІІ) гідроксид
Карбонатна кислота, нітритна кислота, ферум (ІІ) гідроксид
Речовини, що змінюють свій колір у залежності від концентрації йонів Гідрогену, називаються
*Індикаторами
Каталізаторами
Інгібіторами
Промоторами
Барвниками
З яким типом зв’язку в молекулі, її дисоціація на йони відбувається найлегше?
Ковалентним полярним
Водневим
*Йонним
Металічним
Ковалентним неполярним
Який з електролітів слід віднести до сильних за ступенем дисоціації?
= 10 %
= 7 %
= 15 %
* = 80 %
= 5 %
Який з наведених нижче електролітів належить до слабких?
HCl
*H2S
HNO3
H2SO4
HBr
Який з наведених електролітів належить до сильних?
*HNO3
H2SiO3
HClO
HNO2
H2S
Яка з наведених нижче речовин дисоціює на йони ступінчасто ?
HCl
HNO3
*H2CO3
HClO4
HClO
Яка з наведених нижче речовин не дисоціює на йони у водному розчині?
CaCl2
NaNO3
K2CO3
*C6H12O6
KCl
Яка з наведених нижче сполук дисоціює на йони у водному розчині?
C12H22O11
C3H5(OН)3
*KCl
CH3OH
C6H12O6
Який з йонів називають дигідрофосфат-йоном?
PO43
HPO42
PO3
*H2PO4
P2O72
Який з йонів називають карбонат-йоном?
*СО32
С2О42
НСО3
СН3СОО
НС2О4 -
Катіони – це:
Негативно заряджені йони
*Позитивно заряджені йони
Атоми з частковим негативним зарядом
Атоми з частковим позитивним зарядом
Нейтральні частинки
Аніони – це:
*Негативно заряджені йони
Позитивно заряджені йони
Атоми з частковим негативним зарядом
Атоми з частковим позитивним зарядом
Нейтральні частинки
Який з перелічених розчинів не проводить електричного струму?
Водний розчин нітратної кислоти
*Розчин азоту у воді
Розчин хлороводню у воді
Розчин кухонної солі у воді
Водний розчин сульфатної кислоти
Який з йонів є забарвленим?
H+
Ca2+
*MnO4–
Cl–
К+
Чому дорівнює ступінь дисоціації електроліту, якщо з кожних 100 йогомолекул 68 розпалися на йони?
*68 %
32 %
100 %
86 %
30 %
Який з перелічених розчинів проводить електричний струм?
Розчин спирту
Водний розчин цукру
*Водний розчин лугу
Дистильована вода
Розчин метанолу
Які з йонів надає забарвлення водним розчинам?
*Cu2+
OH–
K+
SO42–
Na+
Чому дорівнює ступінь дисоціації електроліту, якщо з кожних 50 його молекул 25 розпалися на йони?
*50 %
25 %
100 %
75 %
80 %
Яка з вказаних речовин дисоціює у водному розчині?
СuО
С12Н22О11
SiO2
*K2SO4
CО2
Яка з частинок є аніоном?
Fe3+
Mn2+
*SO42–.
K+
Аl3+
Який електролітів є сильним?
Н2S
NH4OH
C Cu(OН)2
*K2SO4
HNO2
Який з хімічних елементів може існувати, як двозарядний аніон?
*S
Cl
Fe
F
Ca
Скільки йонів утворюється при дисоціації (NH4)2SO4?
2
9
5
4
*3
Виберіть формули сильних електролітів в рівнянні реакції CaCO3 + 2HІ = CaІ2 + CO2 + H2O.
CaCO3 i HІ
*HІ i CaІ2
CO2 i HІ
CaІ2 i CaCO3
CaCO3 і CO2
Яка речовина утворює при дисоціації йони Mn2+?
KMnO4
Na2MnO4
*MnCl2
MnO2
К2MnO4
Який електроліт утворює при дисоціації хлорид–йони?
KClO3
Ca(ClO)2
*FeCl3
NaClO
NaClO4
Який з хімічних елементів може існувати, як однозарядний катіон?
Sr
*Rb
Fe
F
Br
Яка частинка є катіоном ?
Cr2O72–
H2PO4–
*Pb2+
NO3–
Xe
Скільки йонів утворюється при дисоціації FeCl3 ?
*4
10
8
5
2
Який з вказаних електролітів є слабким ?
H2SO4
Al(NO3)3
*HCN
NaOH
HNO3
Яка з реакцій належить до реакцій йонного обміну?
H2O + Cl2 = HCl + HClO
CaO + H2O = Ca(OH)2
*Ba(NO3)2 + Na2SO4 = BaSO4 + 2NaNO3
2H2 + O2 = 2H2O
Cl2 + H2 = 2HCl
Які речовини у рівнянні реакції H2S + Pb(NO3)2 = PbS + 2HNO3 записуватимуться в скороченому йонно-молекулярному рівнянні у вигляді молекул?
H2S i Pb(NO3)2
*H2S i PbS
PbS i HNO3
Pb(NO3)2 i HNO3
HNO3 і PbS
Який з електролітів при дисоціації утворює гідроксид-йони ?
КHSO4
Ca(HCO3)2
*Al(OH)2Cl
NaCl
Na2SO4
Внаслідок дисоціації число іонів зростає в рядку наступних солей:
Fe(NO3)3; FeCl2; Fe2(SO4)3
Fe(NO3)3; Fe2(SO4)3; FeCl2
Fe2(SO4)3; Fe(NO3)3; FeCl2
*FeCl2; Fe(NO3)3; Fe2(SO4)3
Fe(NO3)3; FeІ2; Fe2(SO4)3
Яка пара йонів реагує при зливанні розчинів AgNO3 i KCl?
K+ i Ag+
K+ i Cl–
Сl- i NO3–
*Ag+ i Cl–
Ag+ i NO3–
Скільки молів йонів натрію утвориться при повній дисоціації 1 моля натрій фосфату?
1
2
*3
4
5
В розчині, що містить 0,1 моль FeCl3, сумарне число молів йонів Fe3+ і Cl– дорівнює:
0,1
0,2
0,3
*0,4
0,05
Коли до розчину лугу доливають надлишок кислоти, рН середовища може змінюватися наступним чином.
Зростати від 7 до 8
Зростати з 3 до 8
*Зменшуватися з 10 до 4
Зменшуватися з 7 до 4
Зростати з 5 до 8
Розчин, який практично не змінює значення рН при додаванні до нього невеликих кількостей кислоти або лугу чи невеликому розбавленні, називається:
Кислотним
Лужним
*Буферним
Нейтральним
Насиченим
Найсильнішою кислотою з наведених є:
H2CO3
H3PO4
*H2SO4
H2SO3
HNO2
Найсильнішою із хлорвмісних кислот є:
*HСlO4
HСlO3
HСlO2
HСlO
Гіпохлоритна
Найкращими буферними властивостями володіє система, що складається з:
HCl і NaCl
*H2CO3 і NaHCO3
NaOH і Na2SO4
H2SO4 і K2SO4
H2SO4 і Na2SO4
Якщо в розчині зростає концентрація йонів Н+, то:
Чисельне значення рН розчину зростає
Концентрація йонів ОН– зростає
*Чисельне значення рН розчину зменшується
Розчин стає менш кислим
Чисельне значення рН розчину не змінюється
Розчин має рН = 5,0. Молярна концентрація йонів Н+ в ньому рівна:
1,0 10–14
*1,0 10–5
5,0
9,0
4,0
Які речовини повинні прореагувати, щоб пройшла реакція, яка описується таким скороченим йонно-молекулярним рівнянням Cr3+ + 3OH– Cr(OH)3 ?
Cr2(SO4)3 і H2O
Cr2O3 і HCl
*CrCl3 і NaOH
Cr2O3 і NaOH
Cr2O3 і HNO3
Яка з вказаних речовин при розчиненні у воді створює лужне середовище?
*NH3
CO2
SO2
H2S
HCl
Ліва частина рівняння реакції, що закінчується схемою: ...2Al(OH)3 + 3CO2 + 3Na2SO4 матиме вигляд:
Al2(SO4)3 + NaOH
*Al2(SO4)3 + Na2CO3+HOH
Al2(SO4)3 + H2O + CO2
NaAlO2 + H2SO4
Al2(SO4)3 + H2CO3
Кількість ступенів дисоціації ортофосфатної кислоти:
1
2
5
4
*3
Кількість ступенів дисоціації алюміній гідроксиду:
4
*3
2
1
5
Ліва частина рівняння .. Zn(OH)2 + K2SO4 має вигляд:
ZnO + KHSO4
*ZnSO4 + 2KOH
ZnCl2 + 2KOH
K2SO4 + ZnO
K2SO4 + Zn
Ступінь дисоціації одноосновної кислоти у розчині становить 70%. Вкажіть сумарне число йонів (HAn H++An–) у розчині, в який поміщено 100 молекул кислоти.
70
*140
100
170
90
Вкажіть число молів йонів, які утворяться при повній дисоціації алюміній сульфату Al2(SO4)3 2Al3+ + 3SO42- в розчині, який містить 1 моль солі.
2
3
*5
7
4
Щоб отримати осад аргентум хлориду на розчин аргентум нітрату потрібно подіяти розчином:
KClO4
KClO3
*CaCl2
Cl2O7
NaClO
Даному скороченому йонно-молекулярному рівнянню Zn2+ + S2- = ZnS відповідає взаємодія речовин:
Zn + H2S
ZnO + H2S
ZnCl2 + H2S
*ZnCl2 + Na2S
Zn(OH)2 + H2S
Даному скороченому йонно-молекулярному рівнянню CH3COO- + H+ = CH3COOH відповідає взаємодія речовин:
*CH3COONa + HCl
CH3COONa + H2S
CH3COONa + H2
HNO2 + (CH3COO)2Zn
CH3COOK + Na2S
Даному скороченому йонно-молекулярному рівнянню Zn2+ + 2OH- = Zn(OH)2 відповідає взаємодія речовин:
ZnO + NaOH
ZnCl2 + Al(OH)3
ZnSO4 + Na2O
*ZnCl2 + NaOH
ZnO + Na
Даному скороченому йонно-молекулярному рівнянню H+ + OH– = H2O відповідає взаємодія речовин:
H2S + NaOH
Al(OH)3 + HCl
*HNO3 + NaOH
NaNO3 + NaOH
H2S + Na
Даному скороченому йонно-молекулярному рівнянню Fe3+ + 3OH– = Fe(OH)3 відповідає взаємодія речовин:
FeCl2 + 2NaOH
Fe(OH)2 + 2HCl
*FeCl3 + 3NaOH
Fe(OH)2 + O2 + H2O
Fe(OH)2 + 2HNO2
Даному скороченому йонно-молекулярному рівнянню PbS + 2H+ = H2S + Pb2+ відповідає взаємодія речовин:
PbS + H2O
*PbS + 2HCl
PbS + 2HNO2
PbS + H3PO4
PbS + H2CO3
Даному скороченому йонно-молекулярному рівнянню H+ + CN- = HCN відповідає взаємодія речовин:
HCl + HSCN
*HCl + KCN
Ca(HCO3)2 + KCN
HNO2 + KCN
H2SO3 + KCN
Даному скороченому йонно-молекулярному рівнянню Mg(OH)2 + H+ = MgOH+ + H2O відповідає наступне молекулярне рівняння:
Mg(OH)2 + 1H2SO4
*Mg(OH)2 + 1HCl
Mg(OH)2 + 1H2S
Mg(OH)2 + 1H3PO4
Mg(OH)2 + 3HCl
Взаємодії між ацетатною кислотою і барій гідроксидом відповідає наступне скорочене йонно-молекулярне рівняння:
CH3COO- + Ba2+ (CH3COО)2Ba
CH3COO– + OH– CH3COOH + O2-
*CH3COOH + OH– CH3COO– + H2O
2CH3COOH + Ba2+ (CH3COО)2Ba + 2H+
3CH3COOH + 2Ba2+ (CH3COО)2Ba + 2H+
Взаємодія між CH3COONa і H2SO4 описується наступним скороченим йонно-молекулярним рівнянням:
*CH3COO- + H+ CH3COOH
2Na+ + SO42- 2Na+
CH3COONa + H+ CH3COOH + Na+
H2SO4 + 2Na+ Na2SO4 + H2
2Na+ + 2H+ 2NaH
Ступінь дисоціації слабких електролітів:
*
 <
3%
<
3%>10%
>70%
< 70%
>15%
Взаємодія між натрій карбонатом і нітратною кислотою – це реакція між речовинами:
Na2C + HNO3
Na2CO3 + HNO2
*Na2CO3 + HNO3
Na2C + HNO2
Na2C + HNO2 + CO2
Взаємодія між Na2CO3 і HCl описується наступним скороченим йонно-молекулярним рівнянням:
Na+ + Cl- NaCl
*CO32- + 2H+ CO2 + H2O
CO2-3 + 2Na+ Na2CO3
CO2-3 + 2HCl 2Cl- +H2O + CO2
Na+ + CO2-3 + 2HCl Na2CO3 + CO2 + 2Cl-
Взаємодія між калій сульфідом і хлоридною кислотою – це реакція між речовинами:
K2S + HClO
*K2S + HCl
K2SO3 + HCl
K2SO4+ HCl
K2S + HclO4
Взаємодія між NaOH і H2SO3 описується наступним скороченим йонно-молекулярним рівнянням:
H+ + OH- H2O
*H2SO3 + 2OH– SO32- + 2H2O
2Na+ + SO32- Na2SO3
2NaOH + 2H+ 2Na+ + H2O
2NaOH + H2O 2Na+ + 2H+
Рівняння FeCl3 + 3CsOH Fe(OH)3 + 3CsCl відповідає наступне скорочене йонно-молекулярне рівняння:
*Fe3+ + 2OH– + Cl- Fe(OH)2Cl
Fe3+ + CsOH = Fe(OH)3 + Cs+
Cs+ + Cl- CsCl
CsOH + Cl- CsCl + OH-
Fe3+ + 3OH– = Fe(OH)3
Ступінь електролітичної дисоціації визначається за формулою:


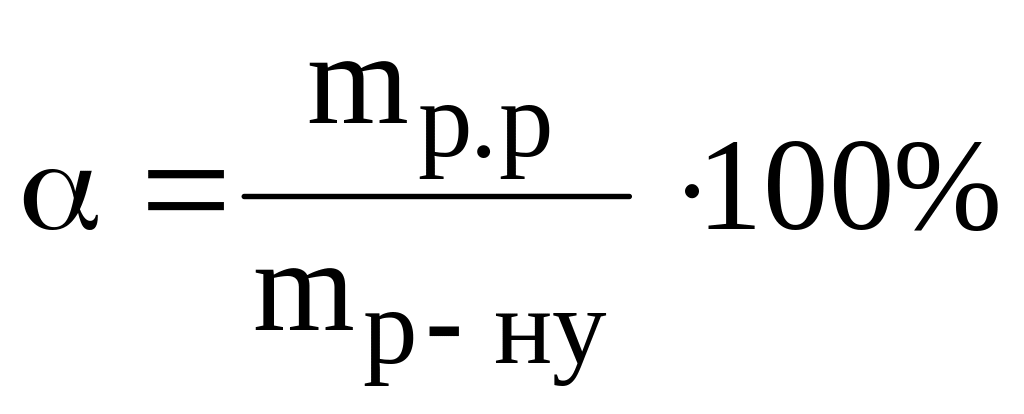
*

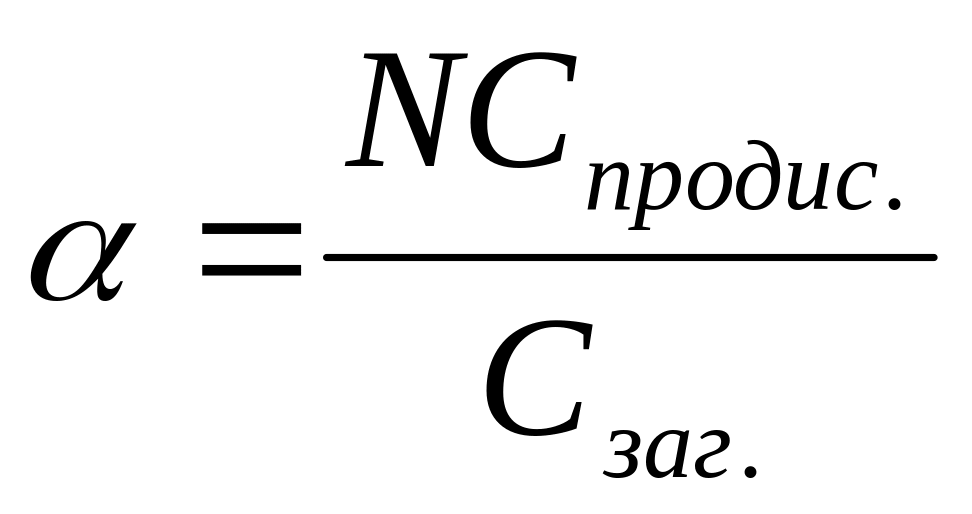
Який з розчинів проводить електричний струм?
Водний розчин глюкози
Водний розчин пропанолу
Розчин кисню у воді
*Розчин калій гідроксиду
Розчин йоду
Розчин хлоридної кислоти, до якого додали деілька крапель спиртового розчину фенолфталеїну, буде мати забарвлення:
Червоне
*Не матиме забарвлення
Жовте
Синє
Коричневе
Ступінь електролітичної дисоціації електролітів середньої сили:
< 3%
= 100%
> 30%
*3% < < 30%
> 50%
Реакції, які відбуваються між йонами, називаються:
Каталітичними
*Йонними
Термохімічними
Окисно-відновними
Полімеризації
При якому значенні рН розчину фенолфталеїн забарвлюється в малиновий колір?
6
3
0
*14
2
Якого кольору набуває лакмус в розчинах з нейтральною реакцією середовища?
Малинового
Синього
Червоного
*Фіолетового
Жовтого
Яке забарвлення буде мати розчин хлоридної кислоти при додаванні лакмусу?
*Червоне
Фіолетове
Синє
Зелене
Жовте
Яке забарвлення буде мати розчин хлоридної кислоти при додаванні фенолфталеїну?
Червоне
*Не матиме забарвлення
Жовте
Синє
Зелене
Реакція середовища гідролізу ферум (ІІ) хлориду:
Нейтральна
Лужна
*Кисла
Не гідролізує
Слабо гідролізує
Реакція середовища гідролізу ферум (ІІ) сульфату:
Лужна
Нейтральна
Не гідролізує
*Кисла
Слабо лужна
Реакція середовища гідролізу ферум (ІІІ) хлориду:
*Кисла
Лужна
Нейтральна
Не гідролізує
Слабо лужна
Реакція середовища гідролізу ферум (ІІІ) нітрату:
*Кисла
Лужна
Не гідролізує
Нейтральна
Слабо лужна
Реакція середовища гідролізу ферум (ІІІ) сульфату:
Нейтральна
*Кисла
Не гідролізує
Лужна
Слабо лужна
Реакція гідролізу калій карбонату буде:
Кисла
*Лужна
Нейтральна
Не гідролізує
Сабо кисла
Яким буде рН реакції гідролізу кальцію карбіду?
*рН>7;
рН>7;
рН<7;
pН=7;
рН>7;
При гідролізі Na2CO3 реакція середовища:
Кисла
Нейтральна
Слабкокисла
*Лужна
Інертна
Розчин якої речовини має лужну реакцію середовища(рН>7)
AlCl3
Al(NO3)3
*NaAlO2
Al2(SO4)3
AlBr3
Розчин якої солі має кислу реакцію середовища?
KAlO2
*Al(NO3)3
K3AlO3
NаAlO2
LiAlO2
Реакція середовища в розчині сульфату алюмінію
*Кисла
Нейтральна
Слабко лужна
Сильно лужна
Не гідролізує
В присутності якої солі розчин фенолфталеїну забарвиться в рожевий колір:
*Na2CO3
CaCl2
Ba(NO3)2
NaCl
KCl
Внаслідок гідролізу кислу реакцію має розчин солі:
Натрій нітрит
Кальцій нітрат
*Амоній нітрат
Натрій хлорид
Калій бромід
Обмінна реакція солей з водою, внаслідок якої утворюється слабкий електроліт і змінюється реакція середовища називається:
Електролізом
*Гідролізом
Дисоціацію
Сольватацією
Електрофорезом
Вкажіть сполуку, що здатна гідролізувати у воді:
NaCl
CaCl2
*K2SO3
NaBr
K2SO4
Виберіть сіль, яка гідролізує:
BaCl2
*AlCl3
NaCl
KCl
K2SO4
Виберіть сіль, яка гідролізує:
*ZnCl2
CaCl2
LiCl
KCl
K2SO4
Виберіть сіль, яка не гідролізує:
FeCl3
*SrCl2
CuCl2
NiCl2
ZnCl2
Виберіть сіль, яка не гідролізує:
FeCl2
NiCl2
MgCl2
*NaCl
ZnCl2
Виберіть сіль, яка не гідролізує:
*BaCl2
ZnCl2
CdCl2
MgCl2
FeCl3
Виберіть сіль, яка не гідролізує:
*CaCl2
FeCl3
FeCl2
AlCl3
ZnCl2
Виберіть сіль, яка не гідролізує:
MnCl2
CrCl3
*KCl
ZnCl2
NiCl2
Виберіть сіль, яка не гідролізує:
NiCl2
CoCl2
FeCl3
*KCl
ZnCl2
