
υ = k[A]2[B]
υ = k[A][B]
υ = k[2A]2[B]
υ = k[A][B]½
*υ = k[A][B]2
Для якої з наведених реакцій, зміна тиску приведе до зміщення рівноваги?
H2 + Cl2 2HCl
*2SO2 + O2 2SO3
N2 + O2 2NO
2HI H2 + I2
2HCl H2 + Cl2
Який з вказаних каталізаторів використовується при окисненні аміаку до Нітроген (II) оксиду:
Оксид ванадію (V)
*Платина металічна
Нікель
Залізо з домішками оксидів металів
Оксид мангану
Гомогенними каталітичними реакціями є:
Розклад H2O2 в присутності MnO2
Окиснення SO2 в присутності V2O5
Синтез аміаку з азоту і водню в присутності фосфору, заліза
Гідрування ацетилену у присутності платини
*Розклад H2O2 в присутності йонів MnO42- в розчині
Гетерогенним є каталізатор:
Mn2+
Cr2O72-
*Ni
H2SO4
MnO42-
З наведених тверджень правильними є:
Каталізатори не беруть участі в реакції
*Каталізатори беруть участь в реакції, але не витрачаються на утворення продуктів реакції
Каталізатор входить до складу продуктів реакції
Каталізатор сприяє зміщенню хімічної рівноваги
Каталізатори сповільнюють хід реакції
З наведених тверджень правильними є:
Каталізатори зміщують стан рівноваги
*Каталізатори не впливають на константу швидкості
Каталізатори впливають на константу швидкості
Каталізатори входять до складу продуктів реакції
Каталізатори входять до складу вихідних речовин
Природними каталізаторами є:
Інгібітори
*Ферменти
Вітаміни
Вуглеводи
Жири
Ферменти проявляють високу активність і діють в організмі за:
Низьких температур
Високих температур
*Температури тіла
Високого атмосферного тиску
Низького атмосферного тиску
За якої умови рівновага оборотної реакції N2(г) + O2(г)= 2NO(г) і ∆H >O зміщується вправо:
*Підвищення температури
Пониження температури
Збільшення тиску
Зменшення концентрації кисню
Зменшення концентрації азоту
За якої умови рівновага оборотної реакції N2(г) + O2(г)= 2NO(г) і ∆H >O зміщується вліво?
Збільшення тиску
Збільшення концентрації азоту
Зменшення концентрації NO
*Пониження температури
Збільшеня концентрації кисню
За якої умови рівновага оборотної реакції CO2(г) + C(т) = 2CO(г) і ∆H < O зміщується вліво?
Пониження температури
Збільшення концентрації С
Збільшення концентрації СО2
Зменшення концентрації СО
*Підвищення температури
За якої умови рівновага оборотної реакції CO2(г) + C(тС.) = 2CO(г); ∆H < O зміщується вправо?
Підвищення температури
*Пониження температури
Збільшення тиску
Зменшення концентрації СО2
Зменшення концентрації С
Рівновага реакції Fe3O4(т) + 4CO = 3Fe(т) + 4CO2 – 43,7 кДж зміщується вліво при :
*Пониженні температури
Підвищенні температури
Зменшенні тиску
Збільшенні тиску
Введенні каталізатора
Взаємодія водню з йодом описується рівнянням H2 + I2 = 2HI. Константа рівноваги цієї реакції. K=
 Яка з вказаних нижче умов не викличе
порушення рівноваги:
Яка з вказаних нижче умов не викличе
порушення рівноваги:*Додавання каталізатора в систему
Збільшення концентрації йодоводню
Збільшення концентрації водню
Зміна концентрації йоду
збільшення тиску
При підвищенні температури рівновага зміститься праворуч для реакції:
2SO2 + O2 = 2SO3 ; ∆Н0
СO2 + C = 2СO(г); ∆Н0
H2 + O2 = 2Н2О ; ∆Н0
*2HgO = 2Hg + O2 ; ∆Н = 180кДж
H2(г) + Br2(г) = 2HBr; ∆Н0
Рівновагу в системі H2(г) + Br2(г) = 2HBr + 68,2 кДж можна змістити в бік утворення гідроген броміду при
А.Збільшенні тиску
Зменшенні тиску
Підвищенні температури
*Пониженні температури
Додаванні інгібітора
Зміщенню рівноваги в системі 2H2S(г) + 3O2(г) = 2SO2(г) + 2H2O(г); ∆Н0 в бік утворення продуктів реакції сприяє все, окрім :
Підвищення концентрації H2S
Пониження концентрації SO2
Підвищення тиску
*Підвищення температури
Зниження температури
Хімічна рівновага порушується при всіх зазначених діях, окрім :
Зміна концентрації реагентів
Підвищення температури
Зміна тиску для газоподібних речовин
*Додавання каталізатора
Зниження температури
Напрямок зміщення рівноваги хімічної реакції визначається принципом
Паулі
*Ле–Шательє
Бертло
Клечковського
Фарадея
Підвищення температури і тиску сприяє зміщенню рівноваги праворуч для реакції :
N2 + O2 = 2NO ; ∆Н >O
H2 + Br2 = 2HBr ; ∆Н <O
*2NO2 = N2O4 ; ∆Н >O
CO2 + C(т) = 2CO ; ∆Н <O
H2 + Сl2 = 2HCl ; ∆Н <O
При яких умовах рівновага оборотної реакції 2SO2 + O2 2SO3 + 193 кДж зміститься праворуч:
Підвищення температури
*Підвищення тиску
Підвищення концентрації сульфур (VI) оксиду
Зниження концентрації сульфур (IV) оксиду
Додаванні інгібітора
На зміщення рівноваги в системі СО(г) + Н2О(г) СО2(г) + Н2(г); ∆Н = – 42,6 кДж не вплине:
Підвищення температури
Зміна концентрації вихідних речовин
Зміна концентрації продуктів реакції
*Зміна тиску в системі
Зниження температури
Хімічна рівновага системи 3Н2 + N2 = 2NH3 + Q при збільшенні концентрації водню зміститься в сторону отримання аміаку, оскільки:
Пряма реакція йде із зменшенням об’єму
*Зросте швидкість прямої реакції
Пряма реакція екзотермічна
Відбувається зміна ступеня окиснення Гідрогену
Відбувається зміна ступеня окиснення Нітрогену
Хімічна рівновага в системі 2Н2 + О2 = 2Н2О + Q при підвищенні температури зміститься в сторону утворення вихідних речовин, оскільки:
*Пряма реакція – екзотермічна
Це окисно-відновна реакція
Пряма реакція йде зі зменшенням об’єму
Відбувається зміна ступеня окиснення Гідрогену
Пряма реакція ендотермічна
Хімічна рівновага системи 2SO2 + O2 = 2SO3 + Q при збільшенні тиску зміститься в сторону утворення сульфур (VI) оксиду, оскільки:
Це окисно-відновна реакція
*Пряма реакція відбувається зі зменшенням об’єму
Пряма реакція є екзотермічною
Відбувається зміна ступеня окиснення Сульфуру
Пряма реакція є ендотермічною
Хімічна рівновага системи N2 + O2 = 2NO – Q при збільшенні тиску не буде зміщуватись, оскільки:
Кисень – сильний окисник
Це окисно- відновна реакція
Пряма реакція ендотермічна
*В процесі реакції не змінюється об’єм газоподібних речовин
Азот – газоподібна речовина
Хімічна рівновага системи NH4Cl ( ТВ) NH3 + HCl – Q при підвищенні температури зміститься в сторону утворення хлороводню, оскільки:
Не відбувається зміни ступеня окиснення водню
Це реакція розкладу
Реакція проводиться зі зміною об’єму
*Пряма реакція ендотермічна
Пряма реакція екзотермічна
Хімічна рівновага в системі СО2 +СаО СаСО3 + Q при збільшенні тиску зміститься в сторону утворення кальцію карбонату, оскільки:
Пряма реакція екзотермічна
Ця реакція не є окисно-відновною
*Пряма реакція проходить зі зменшенням об’єму
Не відбувається зміна ступеня окиснення Карбону
Пряма реакція проходить зі збільшенням об’єму
Хімічна рівновага в системі H2+Br2 2HBr + Q при підвищенні температури зміститься ліворуч, тому що:
*Зворотня реакція ендотермічна
Це окисно – відновна реакція
Реакція проходить без зміни ступеня окиснення
Водень здатен реагувати з бромом
Водень – сильний відновник
Хімічну рівновагу в системі C4H10(г) C4H8(г) + Н2 – Q можна змістити в бік продуктів реакції:
Підвищенням температури і підвищенням тиску
*Підвищенням температури і пониженням тиску
Пониженням температури і підвищенням тиску
Пониженням температури і пониженням тиску
лише пониженням температури
При якій умові рівновага в системі CO(г) + Cl2(г) COCl2(г) + Q зміститься в бік утворення вихідних речовин:
Підвищення тиску
Підвищення концентрації CO
*Підвищення температури
Пониження температури
Підвищення концентрації Cl2
Рівновага гомогенної реакції 2H2O(г) 2H2 + O2 – Q зміститься ліворуч при підвищенні:
Вмісту інгібітора
Вмісту H2O
*Температури
Вмісту каталізатора
Тиску
Рівновага гомогенної реакції PCl3 + Cl2 PCl5(т) + Q зміститься ліворуч при:
Стискуванні
Додаванні PCl3
Додаванні Cl2
*Нагріванні
Зниженні температури
Рівновага в гомогенній системі CO2 + 2SO3 CS2 + 4O2 – Q зміниться ліворуч при:
Нагріванні
Пониженні тиску
Підвищенні вмісту SO3
*Стисканні
Підвищенні вмісту CO2
Рівновага в системі CO + H2O(г) CO2 + H2 + Q зміститься праворуч при:
Підвищенні тиску
Пониженні тиску
Підвищенні температури
*Пониженні вмісту CO2
Підвищенні вмісту CO2
Для реакції N2 + 3H2 2NH3 + Q не можна змістити рівновагу праворуч чи ліворуч:
*Введенням каталізатора
Зміною тиску
Нагріванням
Додаванням H2
Додаванням N2
Гомогенна реакція, для якої підвищення тиску зміщує рівновагу праворуч, - це:
PCl5 PCl3 + Cl2
*2H2 + O2 2H2O(г)
N2 + O2 2NO
H2 + I2 2HI
H2 + Cl2 2HCl
Гетерогенна реакція, для якої підвищення тиску змістить рівновагу праворуч, - це:
*SO2 + KOH(т) KHSO3(т)
CaCO3(т) CaO(т) + CO2
2NH3 N2 + 3H2
Fe(т) + CO2 FeO(т) + CO
BaCO3(т) BaO(т) + CO2
Гетерогенна реакція, для якої підвищення тиску змістить рівновагу праворуч, - це:
C(т) + O2 CO2
CO2 + C(т) 2CO
*C(т) + 2S(г) CS2(г)
MgCO3 CO2 + MgO(т)
H2 + Br2 2HBr
Гомогенна реакція, для якої зміна тиску не викличе зміщення рівноваги, - це:
4NH3 + 5O2 4NO + 6H2O(г)
2H2O(г) 2H2 + O2
N2 + 3H2 2NH3
*SO2 + CO2 SO3 + CO
C(т) + O2 CO2
Реакція, для якої підвищення тиску зміщує рівновагу ліворуч, - це:
C(т) + O2 CO2
*CO2 + C(т) 2CO
C(т) + 2S(г) CS2(г)
H2 + I2 2HI
2H2 + O2 2H2O
Реакція, для якої підвищення тиску зміщує рівновагу в тому ж напрямку, що і підвищення температури, - це:
2CO + O2 2CO2 + Q
2SO2 + O2 2SO3 + Q
2HI H2 + I2(г) – Q
*2O3 3O2 + Q
2HCl H2 + Cl2(г) – Q
Можна збільшити вихід продукту реакції CaS + 2O2 CaSO4 + Q
Введенням кальцій сульфату
Нагріванням
*Підвищенням тиску
Пониженням тиску
Зменшенням тиску кисню
Для збільшення продуктів реакції C(т) + 2N2O CO2 + 2N2 + Q можна подіяти на зміщення рівноваги:
Підвищенням температури
Підвищенням тиску
Додаванням інгібітора
Підвищенням вмісту СО2
*Пониженням температури
Збільшенню виходу продуктів реакції I2(г) + 5CO2 I2O5(т) + 5CO – Q не буде сприяти:
Підвищення температури
*Пониження температури
Підвищення тиску
Додавання каталізатора
Додавання інгібітора
Для збільшення виходу продуктів реакції N2 + 2C(т) + H2 2HCN(г) - Q можна подіяти:
Підвищенням тиску
Пониженням тиску
Підвищенням концентрації HCN
Пониженням температури
*Підвищенням температури
При якій умові рівновага оборотної реакції CO2 + C(т) 2CO;
 H<O
зміщується вліво:
H<O
зміщується вліво:Підвищенні кількості СO2
*Підвищенні тиску
Пониженні тиску
Пониженні температури
Підвищенні кількості Карбону
При якій умові рівновага оборотної реакції N2 + O2 2NO; H>O не зміщується:
Підвищенні температури
Пониженні температури
*Підвищенні тиску
Підвищенні концентрації N2
Підвищенні концентрації NO
При збільшенні концентрації азоту у реакції 3H2 + N2 = 2NH3 рівновага реакції зміститься:
*В бік утворення аміаку
В бік утворення водню
Не зміститься
Зменшиться швидкість прямої реакції
У бік утворення азоту
Підвищення температури впливає на стан рівноваги реакції N2 + 3H2 = 2NH3 + Q:
Рівновага зміщується праворуч
Рівновага не зміщується
*Рівновага зміщується ліворуч
Температура не впливає на стан рівноваги
Концентрація не впиває на стан рівноваги
Реакції, що проходять з виділенням теплоти називають:
Електрохімічними
Кінетичними
Гомогенними
Ендотермічними
*Екзотермічними
Реакції, що проходять з поглинанням теплоти називають:
Електрохімічними
Кінетичними
Гомогенними
*Ендотермічними
Екзотермічними
Тепловим ефектом хімічної реакції називають:
Кінцеву температуру реакції
*Кількість тепла, що поглинається або виділяється системою внаслідок реакції
Температура при якій проходить реакція
Початкову температуру реакції
Середню температуру реакції
З переліку термодинамічних функцій виберіть зайву:
Внутрішня енергія
Ентальпія
Ентропія
*Тиск
Енергія Гібса
Процеси, що проходять при постійному об’ємі називаються:
Окисно-відновними
*Ізохорними
Ізобарними
Ізотермічними
Електрохімічними
Процеси, що проходять при постійному тиску називаються:
Окисно-відновними
Ізохорними
*Ізобарними
Ізотермічними
Електрохімічними
Яке твердження правильне:
Теплота згоряння сполуки у два рази більша за теплоту утворення
Теплота згоряння сполуки завжди менша за теплоту утвореня
*Теплота згоряння сполуки чисельно дорівнює теплоті утворення, але має протилежний знак
Те ж саме що і теплота утворення
Теплота згоряння сполуки прямопропорційна теплоті утворення
Хімічні процеси супроводжуються тепловими ефектами, що підпорядковуються такому закону „ Теповий ефект реакції залежить від природи вихідних речовин та продуктів реакції і не залежить від шляху по якому відбувається процес”. Це закон:
Нернста
Генрі
Авогадро
*Гесса
Закон діючих мас
Чи залежить значення ∆Н0298 реакції від наявності в системі каталізатора:
Залежить в гомогенних і гетерогенних системах
Залежить в гомогенних системах
*Не залежить
Залежить
Залежить в гетерогенних системах
Для якої з речовин стандартна теплота утворення рівна 0?
*O2
CO2
H2O
O3
C6H12O6
Вкажіть речовину для якої теплота утворення за стандартних умов рівна 0:
HF
NO
H2O
HCl
* N2
Cеред запропонованих позначень виберіть правильне для ентальпії:
∆G
∆U
∆T
∆S
* ∆H
Ентропія є мірою невпорядкованості системи. Під час хімічних і біохімічних реакцій та внаслідок зміни агрегатного стану речовин значення ентропії може змінюватися. Вкажіть, не проводячи розрахунків, у якому з наведених нижче процесів ентропія зростає:
4HCl(г) + O2(г) = 2Cl2 + 2H2O((г)
4Al(т) + 3C(т) = Al4C3
CH4(г) + Cl2(г) = CH3Cl(г) + HCl(г)
*C(графіт) + CO2(г) = 2CO(г)
N2(г) + 3H2(г) = 2NH3(г)
Виберіть правильний запис зміни ентальпії для реакції горіння aA + bB = cC + dD:
∆Н = (а∆Н0утА + b∆H0утB) – (c∆H0утC + d∆H0утD)
∆Н = (а∆Н0утА + b∆H0утB) / (c∆H0утC + d∆H0утD)
*∆Н = (c∆H0утC + d∆H0утD)–(а∆Н0утА + b∆H0утB)
∆Н = (а∆Н0утА + b∆H0утB) + (c∆H0утC + d∆H0утD)
∆Н = (а∆Н0утА + b∆H0утB) ∙ (c∆H0утC + d∆H0утD)
Виберіть правильний запис зміни ентальпії для реакції aA + bB = cC + dD:
*∆Н = (а∆Н0згА + b∆H0згB) – (c∆H0згC + d∆H0згD)
∆Н = (а∆Н0згА + b∆H0згB) / (c∆H0згC + d∆H0згD)
∆Н = (c∆H0згC + d∆H0згD)–(а∆Н0згА + b∆H0згB)
∆Н = (а∆Н0згА + b∆H0згB) + (c∆H0згC + d∆H0згD)
∆Н = (а∆Н0згА + b∆H0згB) ∙ (c∆H0згC + d∆H0згD)
Виберіть правильний запис зміни ентропії для реакції aA + bB = cC + dD:
∆S = (а∆S0утА + b∆S0утB) – (c∆S0утC + d∆S0утD)
∆S = (а∆S0утА + b∆S0утB) / (c∆S0утC + d∆S0утD)
*∆S = (c∆S0утC + d∆S0утD)–(а∆S0утА + b∆S0утB)
∆S = (а∆S0утА + b∆S0утB) + (c∆S0утC + d∆S0утD)
∆S = (а∆S0утА + b∆S0утB) ∙ (c∆S0утC + d∆S0утD)
Виберіть правильний запис енергії Гібса для реакції aA + bB = cC + dD:
∆G = (а∆G0утА + b∆G0утB) – (c∆G0утC + d∆G0утD)
∆G = (а∆G0утА + b∆G0утB) / (c∆G0утC + d∆G0утD)
*∆G = (c∆G0утC + d∆G0утD)–(а∆G0утА + b∆G0утB)
∆G = (а∆G0утА + b∆G0утB) + (c∆G0утC + d∆G0утD)
∆G = (а∆G0утА + b∆G0утB) ∙ (c∆G0утC + d∆G0утD)
На збільшення невпорядкованості в системі вказує:
∆H = ∆S
∆H ≥ 0
*∆S › 0
∆S ≤ 0
∆H ≤ 0
Виберіть рівняння у якому ентропія зростає:
Br2(г) + H2(г) = 2HBr(г)
H2O(г) = H2O(р)
*(NH4)2CO3(т) = 2NH3(г) + CO2(г) + H2O(г)
N2(г) + 3H2(г) = 2NH3(г)
Cl2(г) + H2(г) = 2HCl(г)
Для реакції (NH4)2CO3(т) = 2NH3(г) + CO2(г) + H2O(г) :
∆S = ∆G
∆S = ∆H
∆S ‹ 0
∆S = 0
*∆S › 0
Для реакції N2(г) + 3H2(г) = 2NH3(г):
∆S = ∆G
∆S = ∆H
*∆S ‹ 0
∆S = 0
∆S › 0
Енергія Гібса описується рівнянням:
∆G = ∆H + T∆S
∆G =∆H ∙ T∆S
∆G = ∆H / T∆S
*∆G = ∆H - T∆S
∆G = T∆S
Процес проходить самочинно якщо:
∆G = ∆S
∆G =∆H
*∆G ‹ 0
∆G › 0
∆G = 0
Процес неможливо провести за даних умов якщо:
∆G = ∆S
∆G =∆H
∆G ‹ 0
*∆G › 0
∆G = 0
Система перебуває у стані хімічної рівноваги якщо:
∆G = ∆S
∆G =∆H
∆G ‹ 0
∆G › 0
*∆G = 0
Для якої з речовин стандартна енергія Гібса рівна 0:
*O2
CO2
H2O
HBr
C6H12O6
Вкажіть речовину для якої стандартна енергія Гібса за стандартних умов рівна 0:
HF
NO
H2O
HCl
*N2
Для кількісного визначення лікарських засобів з кислотними властивостями використовують 0,1 М розчин натрій гідроксиду. Яку масу NaOH необхідно взяти для приготування 5 л такого розчину?
50 г
40 г
10 г
30 г
*20 г
Для приготування 500г 10% (гіпертонічного) розчину натрій хлориду необхідно:
75 г NaCl
0,5 г NaCl
*50 г NaCl
150 г NaCl
25 г NaCl
У фармацевтичному аналізі як титрант використовують 0,1 моль/л розчин хлоридної кислоти. Який об’єм цієї кислоти можна приготувати, виходячи з 100 мл 0,5 М розчину НСl?
1000мл
200мл
*500мл
5000мл
50мл
Коефіцієнт розчинності солі виражає:
Масу солі, яка розчиняється при даній температурі у 100 г розчину
*Масу солі, яка розчиняється при даній температурі у 100 г розчинника
Масу солі, яка розчиняється у 100 г насиченого розчину
Масу солі, яка викрастилізується при охолодженні із насиченого розчину
Масу солі, яка розчиняється у 1 мл розчину
Через декілька днів у склянці з розчином солі на дні утворилися кристали. Яким буде розчин над кристалами?
Розбавленим
*Насиченим
Ненасиченим
Перенасиченим
Концентрованим
Яка масова частка натрій хлориду в розчині, отриманому розчиненям 10 г солі в 70 г води?
15,3%
*12,5%
28,6%
25%
50%
Випаровуванням 200 г розчину добули 35 г солі. Яка була масова частка солі в розчині?
*17,5%
14,9%
15,1%
16,8%
20%
Скільки грамів натрій гідроксиду потрібно для приготування розчину об’ємом 250 мл, молярна концентрація якого 0,2моль/л?
2,8 г
4,0 г
3,0 г
1,0 г
*2,0 г
Молярна концентрація еквівалентів у 1000 мл розчину якої розчинено 4,9 г сульфатної кислоти рівна:
1 моль/л
*0,1 моль/л
2 моль/л
0,2 моль/л
0,3 моль/л
Як антисептичний засіб у медицині застосовують водний розчин калій перманганату з масовою часткою KMnO4 0.2%. Яка маса солі потрібна для виготовлення такого розчину масою 100 г?
2 г
0,02 г
*0,2 г
0,1 г
20 г
До концентрованої сульфатної кислоти не можна доливати воду, тому що:
Вода має велику теплоємність
Концентрована сульфатна кислота – сильний окисник
*Вода закипає на поверхні і розбризкує кислоту
Вода менш в’язка, ніж кислота, і її можна швидко перелити через край
Вода більш в’язка ніж кислота
Процес розчинення супроводжується:
Виділенням тепла
Поглинанням тепла
*Виділенням або поглинанням тепла
Збереженням вихідної теплової енергії
Зміною температури
Розчин – це:
Гетерогенна система, яка складається з двох компонентів
*Гомогенна система, яка складається з двох або більше компонентів та продуктів їх взаємодії
Гомогенна система, яка складається з двох компонентів
Гетерогенна система, яка складається з двох або більше компонентів та продуктів їх взаємодії
Система, що складається з одного компонента
Виберіть ряд речовин, які утворюють рідкий розчин:
*Сульфатна кислота і вода
Мідь і азот
Водень і гелій
Пісок і вода
Кисень та чадний газ
Рідким розчином за кімнатної температури може бути:
Повітря
Суміш CO і CO2
Сплав золота і міді
*Суміш калій хлориду і води
Сплав нікелю та міді
Прикладом твердого розчину може бути:
Суміш N2 і O2
Глина і вода
Розчин купрум сульфату
*Сплав нікелю і міді
Суміш чадного та вуглекислого газу
Поєднання яких речовин не може бути розчином?
Аргентум нітрат і вода
Натрій фосфат і вода
*Арґентум хлорид і вода
Калій бромід і вода
Калій хлорид та вода
Поєднання яких речовин не може бути розчином?
*Барій сульфат і вода
Барій хлорид і вода
Барій нітрат і вода
Калій гідроксид і вода
Калій хлорид та вода
Пересичений розчин – це розчин, який містить розчиненої речовини:
Менше, ніж може розчинитися при даній температурі
*Більше, ніж може розчинитися при даній температурі
Менше, ніж розчинність цієї речовини
Відповідно до її розчинності
На половину менше, ніж може розчинитись
Що таке двохмолярний розчин? Це розчин, який містить:
2 г розчиненої речовини в 100 г розчину
2 моль розчиненої речовини в 1 л води
2 моль розчиненої речовини в 1 л розчинника
*2 моль розчиненої речовини в 1 л розчину
2 моль розчиненої речовини у 2-х літрах розчину
Скільки розчиненої речовини міститься в 3 літрах розчину з концентрацією 1,5 моль/л?
1,5 моль
3 г
*4,5 моль
1,5 г
10 моль
Скільки розчиненої речовини міститься в 4 літрах розчину з концентрацією 1 моль/л?
2 моль
*4 моль
1 моль
4 г
5 моль
Скільки розчиненої речовини міститься в 3 літрах розчину з концентрацією 2 моль/л?
*6 моль
2 моль
3 моль
3 г
5 моль
Скільки розчиненої речовини міститься в 100 г 20 % розчину?
20 моль
40 моль
100 г
*20 г
40 г
Скільки розчиненої речовини міститься в 100 г розчину натрій хлориду з концентрацією 3 %?
30 г
27 г
*3 г
6 г
9 г
Для приготування 2 л розчину натрій хлориду взяли 4 моль цієї речовини. Яка молярна концентрація одержаного розчину?
1 моль/л
*2 моль/л
4 моль/л
2 %
8 моль/л
Для приготування 5 л розчину калій сульфату взяли 15 моль цієї речовини. Яка молярна концентрація одержаного розчину?
3 %
*3 моль/л
30 %
15 моль/л
20 моль/л
Для приготування 400 г розчину аргентум нітрату взяли 80 г солі. Яка масова частка солі в розчині?
80 %
40 %
20 моль/л
*20 %
10%
Для приготування 200 г розчину магній нітрату взяли 20 г солі. Яка масова частка солі в розчині?
*10 %
20 %
10 моль/л
20 моль/л
25 моль/л
Виберіть формулу кристалогідрату:
H2O
HCl + H2O
NaOH + H2O
*CuSO4 · 5H2O
KCl + H2O
Виберіть формулу кристалогідрату:
*FeSO4 · 7H2O
NaCl + H2O
CaO + H2O
SO2 + H2O
KCl + H2O
Виберіть формулу кристалогідрату:
SO3 + H2O
K2CO3 + H2O
*Na2SO4 · 10H2O
Na2O + H2O
KCl + H2O
Виберіть формулу кристалогідрату:
Li2O + H2O
*MgSO4 · 7H2O
H2O
KOH
KCl + H2O
Виберіть формулу кристалогідрату:
*H2C2O4 · 2H2O
H2C2O4
H2SO4
HCl
KCl + H2O
Виберіть формулу речовини, яка не розчиняється у воді:
Ba(OH)2
Ba(CH3COO)2
Ba(NO3)2
*BaSO4
KNO3
Виберіть формулу речовини, яка не розчиняється у воді:
NaCl
*Fe(OH)3
NaOH
NaNO3
KNO3
Серед наведених нижче речовин виберіть формулу речовини, яка розчиняється у воді:
*NaOH
Cu(OH)2
BaSO4
AgCl
AgBr
Серед наведених нижче речовин виберіть формулу речовини, яка розчиняється у воді:
BaSO4
*Na2SO4
CaCO3
H2SiO3
AgCl
Серед наведених нижче речовин виберіть розчинну у воді:
Ni(OH)2
AgCl
*KCl
H2SiO3
BaSO4
Насичений розчин – це:
*Розчин, що перебуває в рівновазі з твердою речовиною, яку розчиняли
Розчин, що містить розчиненої речовини менше, ніж може розчинитися при даній температурі
Розчин, що містить розчиненої речовини більше, ніж може розчинитися при даній температурі
Розбавлений розчин
Концентрований розчин
Скільки розчиненої речовини містить в 100 г 15 % розчину глюкози?
25 г
*15 г
100 г
85 г
30 г
Яка масова частка цукру у розчині, що містить 10 г цукру в 20 г розчину?
20 %
30 %
10 %
*50 %
40%
У воді не розчиняється:
KCl
Цукор
NaOH
*C6H6
КОН
Молярна концентрація виражає:
*Число моль розчиненої речовини в 1л розчину
Число моль-екрозчиненої речовини в 1л розчину
Масу розчиненої речовини в 100 г розчину
Число моль розчиненої речовини в 1кг розчинника
Масу розчиненої речовини в 1 мл розчину
Молярна концентрація еквівалентів виражає:
Число моль розчиненої речовини в 1л розчину
*Число моль-екрозчиненої речовини в 1л розчину
Масу розчиненої речовини в 100 г розчину
Число моль розчиненої речовини в 1кг розчинника
Масу розчиненої речовини в 1 мл розчину
Моляльна концентрація виражає:
Число моль розчиненої речовини в 1л розчину
Число моль-екрозчиненої речовини в 1л розчину
Масу розчиненої речовини в 100 г розчину
*Число моль розчиненої речовини в 1кг розчинника
Масу розчиненої речовини в 1 мл розчину
Титр розчину показує:
Число моль розчиненої речовини в 1л розчину
Число моль-екрозчиненої речовини в 1л розчину
Масу розчиненої речовини в 100 г розчину
Число моль розчиненої речовини в 1кг розчинника
*Масу розчиненої речовини в 1 мл розчину
Масова частка розчиненої речовини у розчині це:
Число моль розчиненої речовини в 1л розчину
Число моль-екрозчиненої речовини в 1л розчину
*Масу розчиненої речовини в 100 г розчину
Число моль розчиненої речовини в 1кг розчинника
Маса розчиненої речовини в 1 мл розчину
Виберіть правильний запис виразу для молярної концентрації:
*



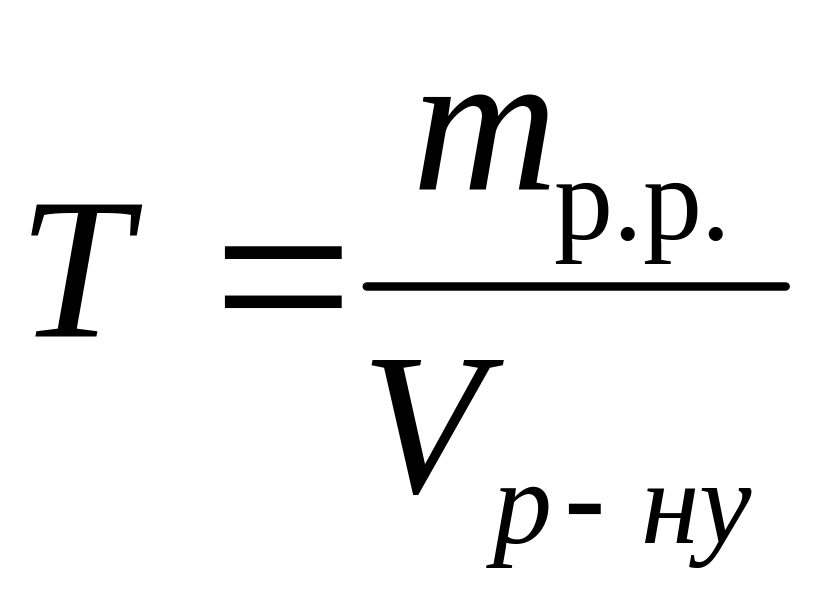

Виберіть правильний запис виразу для молярної концентрації еквівалентів:
*
Виберіть правильний запис виразу для моляльної концентрації:
*
Виберіть правильний запис виразу для титру:
*
Виберіть правильний запис виразу для масової частки:
*
Виберіть правильний запис одиниці вимірювання молярної концентрації:
*моль/л
моль-екв/л
моль/кг
г/мл
% або частка від 1
Виберіть правильний запис одиниці вимірювання молярної концентрації еквівалентів:
*моль/л
кг/моль
моль/кг
г/мл
% або частка від 1
Виберіть правильний запис одиниці вимірювання моляльної концентрації:
моль/л
моль-екв/л
*моль/кг
г/мл
% або частка від 1
Виберіть правильний запис одиниці вимірювання титру:
моль/л
моль-екв/л
моль/кг
*г/мл
% або частка від1
Виберіть правильний запис одиниці вимірювання масової частки:
моль/л
моль-екв/л
моль/кг
г/мл
*% або частка від1
