
Електронегативністю елемента називають:
Властивість атома віддавати електрон
Властивість атома не взаємодіяти з іншими елементами
Здатність атома набувати негативного заряду
*Властивість атома притягувати до себе спільні електронні пари порівняно з іншими елементами сполуки
Здатність атома набувати позитивного заряду
Чим вища електронегативність елемента, тим яскравіше виражені:
Металічні властивості
*Неметалічні властивості
Основні властивості
Кислотні властивості
Амфотерні властивості
Який елемент найбільш електронегативний?
*Флуор
Цезій
Астат
Кобальт
Берилій
Який елемент найменш електронегативний?
Флуор
*Цезій
Астат
Кобальт
Берилій
Як змінюється електронегативність елементів із збільшенням заряду ядра атомів у періоді?
*Зростає
Спадає
Не змінюється
Спочатку зростає потім спадає
Змінюється періодично
Вкажіть елемент, який має найменшу електронегативність.
O
S
F
*C
Cl
У якій парі елементів металічні властивості зменшуються:
Li — Na
*Na — Mg
Mg — Ca
K — Rb
Ве — Ca
Серед наведених формул вкажіть сполуку з ковалентним неполярним зв’язком:
PCl5
NaCl
*O2
CO
СО2
Серед наведених формул вкажіть сполуку з ковалентним полярним зв’язком:
Cl2
NaCl
*HCl
Mg
O2
Серед зазначених формул вкажіть сполуку з йонним типом зв’язку:
*K F
H2S
PH3
N2
O2
Який тип зв’язку в молекулі води?
Водневий
Йонний
Ковалентний неполярний
Металічний
*Ковалентний полярний
Який тип зв’язку в молекулі N2?
Ковалентний полярний
Йонний
*Ковалентний неполярний
Металічний
Водневий
В якій з перелічених сполук полярність зв’язку найбільша.
*HF
HCl
HI
HBr
H2S
В якій з перелічених сполук полярність зв’язку найбільша?
*HF
H2S
H2O
NH3
HCl
У сполуці СsCl зв’язок:
Металічний
Водневий
Ковалентний полярний
*Йонний
Ковалентний неполярний
Як змінюється електронегативність елементів із збільшенням заряду ядра атомів у головних підгрупах:
Зростає
*Спадає
Не змінюється
Спочатку спадає, потім зростає
Змінюється періодично
У парах яких елементів металічні властивості збільшуються:
*Ca — K
Ca — Mg
Li — Be
Na — Li
Cs — Li
Вкажіть елемент, який має найбільшу електронегативність:
Si
P
Br
*Cl
Li
Як змінюється полярність зв’язку в ряді молекул H2O → H2S → H2Se → H2Te?
Не змінюється
Зростає
*Зменшується
Спочатку зростає, потім зменшується
Спочатку зменшується, потім зростає
В яких молекулах існує ковалентний полярний зв’язок?
KBr
Br2
*PBr3
CsBr
І2
Як змінюється полярність зв’язку в ряді молекул: PH3 → H2S → HCl?
*Зростає
Зменшується
Не змінюється
Спочатку зростає, потім спадає
Спочатку зменшується, потім зростає
Виберіть сполуку до складу якої входить Оксиген, що з’єднаний ковалентним неполярним зв’язком з іншим елементом:
*O2
CO2
K2O
CaO
СО
Ковалентний полярний зв’язок характерний для сполуки:
O2
NаF
*H2S
Ca
O3
Вкажіть формулу речовини, в якій Гідроген з’єднаний йонним зв’язком?
H2
HCl
*CsH
CH4
O2
Прості речовини, що утворені елементами I групи головної підгрупи
Мають молекулярну будову
*Мають металічну кристалічну гратку
Утворюють кристали з йонною кристалічною граткою
Мають атомну кристалічну гратку
Мають іонну будову
Хімічний зв’язок в молекулі Гідроген хлориду:
*Ковалентний полярний
Донорно-акцепторний
Ковалентний неполярний
Металічний
Водневий
Для якої пари речовин структурною одиницею є йон?
CH4 і I2
SO2 і H2O
Cl2 і NH3
*LiF і KCl
C2H4 і Cl2
Вкажіть, які атоми II періоду входять до складу молекул, між якими можуть утворюватися водневі зв’язки:
*O, N, F
C, Li, Na
Li, Be, P
C, B, Be
K, Be, Cl
Вода має аномально високу температуру кипіння за рахунок:
Металічного зв’язку
*Водневих зв’язків
Йонного зв’язку
Ковалентного полярного зв’язку
Ковалентного неполярного зв’язку
В молекулах вуглеводнів зв’язок між атомами Карбону і Гідрогену:
*Ковалентний
Йонний
Металічний
Водневий
Дисперсійний
Серед перерахованих речовин найвищу температуру плавлення має:
CO2
SO2
*SiO2
NO2
СО
В Калій хлориді хімічний зв’язок
Ковалентний полярний
Ковалентний неполярний
Металічний
*Йонний
Водневий
Наявність водневого зв’язку між молекулами H2O зумовлює:
Високу електропровідність
Низьку температуру кипіння
*Високу температуру кипіння
Газоподібний стан за нормальних умов
Високу температуру замерзання
Наявність металічного зв’язку в металах зумовлює їх:
Крихкість
Розчинність у воді
*Пластичність
Рідкий агрегатний стан
Газоподібний агрегатний стан
Наявність йонного зв’язку в NaCl зумовлює:
Пластичність
Теплопровідність
*Здатність його розчинів проводити електричний струм
Непрозорість
Високу розчинність
Ковалентний полярний зв’язок характерний для речовини:
CaCl2
Na
Вr2
*PBr3
І2
Ковалентний неполярний зв’язок має речовина, формула якої:
NH3
KCl
К
Ca
*Cl2
Ковалентний полярний зв’язок має речовина:
Md
KCl
*H2S
C
І2
Йонний зв’язок характерний для речовини, формула якої:
*LiF
Cl2
H2O
Na
І2
Ковалентний неполярний зв’язок характерний для сполуки, формула якої:
*С(алмаз)
КОН
CCl4
MgO
КІ
Алмаз має високу твердість, не розчиняється у воді, не проводить електричний струм, оскільки він має кристалічну гратку:
*Атомну
Йонну
Молекулярну
Металічну
Кристалічну
Тільки одинарні (-зв’язки) є в молекулі речовини, формула якої:
N2
*C2H6
CO2
C2H4
C2H2
Бром має низьку температуру плавлення (-7,250С), не проводить електричного струму, оскільки у нього кристалічна гратка:
Йонна
Атомна
*Молекулярна
Металічна
Кристалічна
В молекулі аміаку хімічний зв’язок:
*Ковалентний полярний
Ковалентний неполярний
Йонний
Донорно-акцепторний
Водневий
Зв’язок у сполуці, що утворена атомом Гідрогену і елементом з електронною формулою (1s22s22p4) є:
Йонний
*Ковалентний полярний
Ковалентний неполярний
Металічний
Водневий
Найбільшою електронегативністю серед елементів V групи головної підгрупи володіє:
Фосфор
*Нітроген
Арсен
Стибій
Калій
В ковалентних водневих сполуках складу HR число спільних електронних пар дорівнює:
4
3
2
5
*1
Ступінь окислення Фосфору в ортофосфатній кислоті становить:
-3
+3
*+5
0
+1
Як правило, речовинам з металічним типом хімічного зв’язку не характерним є:
Електропровідність
Теплопровідність
*Крихкість
Пластичність
Ковкість
Йонний зв’язок має:
*Кальцію хлорид
Вода
Озон
Аміак
Йод
Найбільшу електронегативність має атом, електронна формула якого:
*1s22s22p1
1s22s22p6
1s22s22p4
1s22s22p2
1s22s22p5
Ряду речовин: кухонна сіль - алмаз - вуглекислий газ, - відповідає наступна послідовність типів кристалічних граток:
Йонна, металічна, молекулярна
*Йонна, атомна, молекулярна
Молекулярна, атомна, йонна
Йонна, молекулярна, атомна
Йонна, металічна, атомна
Електрони, які знаходяться в металічній кристалічній гратці:
*Вільно переміщуються між всіма йонами і атомами
Жорстко закріплені між всіма йонами і атомами
Попарно закріплені між йонами і атомами
Зв’язують сильно електронегативний елемент та активний атом Гідрогену
Закріплені лише між атомами
Речовина, у вузлах кристалічної гратки якої знаходяться частинки Mg2+ і Cl-, утворена таким типом зв’язку:
Ковалентним полярним
*Йонним
Металічним
Водневим
Ковалентним неполярним
Між атомами елементів з порядковими номерами 11 і 17 виникає зв’язок:
Металічний
*Йонний
Ковалентний неполярний
Донорно-акцепторний
Ковалентний полярний
Яка з наведених речовин має атомну кристалічну гратку?
Магній
Озон
Нафталін
*Алмаз
Кисень
Вкажіть сполуку, в якій є зв’язок, що утворюється за донорно-акцепторним механізмом:
NaCl
*NH4Cl
HCl
H2O
КІ
Вкажіть сполуку, для якої не характерне утворення водневого зв’язку:
*C2H2
NH3
H2O
HF
С6Н4(ОН)NO2
Серед наведених елементів виберіть той, з яким атом Флуору утворить найбільш полярний зв’язок:
O
Na
C
*Сs
К
Найбільш полярні зв’язки у молекулі:
*NH3
PH3
AsH3
BiH3
SbH3
В ковалентних водневих сполуках складу RH3 число спільних електронних пар дорівнює:
4
5
2
1
*3
В молекулі амоніаку NH3 число спільних електронних пар дорівнює:
4
*3
2
1
0
Константа швидкості реакції не залежить від:
Зовнішніх умов проведення реакції
Температури
Природи реагуючих речовин
*Концентрації речовин
Природи розчинника (середовища)
Залежність швидкості реакції від температури визначається
Рівнянням Арреніуса
*Правилом Вант-Гоффа
Законом діючих мас
Рівнянням Менделєєва-Клапейрона
Рівнянням Фарадея
Температурний коефіцієнт показує у скільки разів збільшується
Швидкість даної реакції при підвищенні температури на три градуси
Швидкість даної реакції при підвищенні температури на один градус
*Константа швидкості даної реакції при підвищенні температури на десять градусів
Константа швидкості даної реакції при підвищенні температури на один градус
Швидкість даної реакції при підвищенні температури на десять градусів
Каталізатор
Входить до складу продуктів реакції
Не змінює швидкості реакції, але збільшує енергію активації
Входить до складу вихідних речовин
Не вступає в реакцію, але виконує роль середовища протікання реакції
*Змінює швидкість реакції
Інгібітор – це речовина, що
Прискорює хімічну реакцію
*Сповільнює хімічну реакцію
Не змінює швидкості реакції, але зменшує теплоту утворення продуктів реакції
Не вступає в хімічну реакцію, але служить середовищем протікання реакції
Вступає в хімічну реакцію
При гетерогенному каталізі
Каталізатор переходить з одного агрегатного стану в інший
Реагуючі речовини і продукти реакції перебувають у різних агрегатних станах
Каталізатор і продукти реакції перебувають у різних агрегатних станах
Каталізатор і продукти реакції перебувають у однакових агрегатних станах
*Каталізатор і реагуючі речовини перебувають у різних агрегатних станах
Температурний коефіцієнт реакції становить 3. У скільки разів зміниться швидкість реакції при зниженні температури на 30 С?
Збільшиться в 3 рази
Зменшиться в 9 разів
*Зменшиться в 27 разів
Збільшиться в 9 разів
Зменшиться у 12 разів
Як зміниться швидкість реакції H2 + Cl2 = 2HCl при збільшенні концентрації хлору в 3,5 рази?
Зменшиться в 3,5 рази
Збільшиться в 7 разів
Зменшиться в 7 разів
*Збільшиться в 3,5 рази
Зменшиться у 12 разів
Як зміниться швидкість реакції H2 + Cl2 = 2HCl при збільшенні концентрації хлору в 3,5 рази і водню в 2 рази?
Зменшиться в 3,5 рази
*Збільшиться в 7 разів
Зменшиться в 7 разів
Збільшиться в 3,5 рази
Зменшиться у 12 разів
У скільки разів зміниться швидкість реакції 3H2 + N2 = 2NH3 при зменшенні концентрації водню в 4 рази?
Зменшиться у 4 рази
Зменшиться у 8 разів
Зменшиться у 12 разів
*Зменшиться у 64 рази
Зменшиться у 10 разів
Швидкість хімічної реакції не залежить від:
Енергії активації
*Константи хімічної рівноваги
Температури
Наявності каталізатора
Тиску
У законі діючих мас = k ·СА· СВ константа швидкості реакції k має фізичний зміст:
*Дорівнює швидкості реакції, коли концентрації реагуючих речовин рівні 1 моль/л
Дорівнює швидкості реакції, коли концентрації реагуючих речовин рівні 1 %
Дорівнює швидкості реакції, коли концентрації реагуючих речовин рівні 0,1 %
Не має фізичного змісту, оскільки є сталою величиною
Дорівнює швидкості реакції, коли концентрації реагуючих речовин рівні 0,2 %
При підвищенні температури зростає швидкість реакції тому що:
Зростає загальне число зіткнень молекул в реакційній суміші
Зростає число атомів, які утворюються з молекул продуктів
Зростає число атомів, які утворились з молекул реагуючих речовин
*Зростає концентрація активних молекул, які мають, в порівнянні з іншими молекулами, деяку надлишкову енергію
Молекули з рідкого стану переходять у газоподібний
Початкова концентрація речовини А – 0,3 моль/л, а через 5 с концентрація речовини А стала 0,27 моль/л. Чому дорівнює середня швидкість реакції:
0,06 моль/л·с
*0,006 моль/л·с
0,054 моль/л·с
0,0054 моль/л·с
0,05 моль/л·с
Початкова концентрація речовини А – 0,6 моль/л у реакції А + 2В = Через деякий час концентрація речовини А стала 0,4 моль/л. Як змінилася концентрація речовини В?
Зросла в 0,5 рази
Зросла на 0,4 моль/л
Зросла в 0,4 рази
Зменшилась в 0,4 рази
*Зменшилась на 0,4 моль/л
Початкова концентрація речовини А – 1 моль/л у реакції 2А + С = Д. Через деякий час концентрація речовини А стала 0,5 моль/л. Як змінилась концентрація речовини С?
Зменшилась в 2 рази
Зросла в 2 рази
*Зменшилась на 0,25 моль/л
Зросла на 0,25 моль/л
Зросла на 5 моль/л
Константа швидкості k для хімічної реакції залежить від:
Природи реагуючих речовин
*Природи реагуючих речовин і температури
Температури
Температури і концентрації реагуючих речовин
Концентрації реагуючих речовин
У скільки разів зросте швидкість реакції А + 2В = С, якщо концентрацію речовини В збільшили в 3 рази?
У 8 разів
*У 9 разів
В 27 разів
В 6 разів
В 30 разів
Початкова концентрація речовини А – 0,35 моль/л у реакції 2А + 2В = Д. Через деякий час концентрація речовини А стала 0,15 моль/л. Як змінилась концентрація речовини В?
Зросла в 0,2 рази
Зменшилась на 2 моль/л
Зросла на 0,2 моль/л
Зменшилась в 0,2 рази
*Зменшилась на 0,2 моль/л
Початкові концентрації речовини А – 2 моль/л, В – 1 моль/л у реакції А + 2В = Константа швидкості реакції (k) дорівнює 0,2. Яка початкова швидкість реакції?
2
1
0,2
*0,4
0,12
Початкові концентрації речовини N2 – 3 моль/л, Н2 – 2 моль/л у реакції N2 + 3Н2 = 2NН3. Константа швидкості реакції (k) дорівнює 0,5. Яка початкова швидкість реакції?
0,2
*12,0
1,5
4,0
0,02
Початкові концентрації речовини СО – 0,5 моль/л, Сl2 – 0,4 моль/л у реакції СО + Сl2 = СОСl2 . Константа швидкості реакції (k) дорівнює 0,6. Яка початкова швидкість реакції?
2,4
0,4
0,3
0,02
*0,12
Всі життєво важливі біохімічні процеси в живих організмах проходять за участю біохімічних каталізаторів, які називаються:
*Ферменти
Елементи
Рудименти
Альбумінати
Вуглеводи
Яке з тверджень про енергію активації реакції (
 )
є неправильне?
)
є неправильне?залежить від природи речовин
* залежить від концентрації речовин
залежить від агрегатного стану речовин
є характеристикою кожної реакції
залежить від природи розчинника
Для якої з реакцій кінетичне рівняння записане неправильно?
*N2 + 3Н2 = 2NН3;

СО + Сl2 = СОСl2;
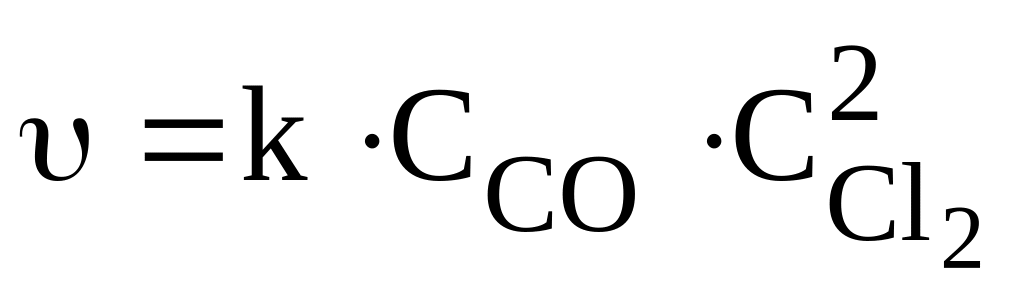
2Fe(т) + 3Cl2 = 2FeCl3;

S(т) + O2 = SO2;
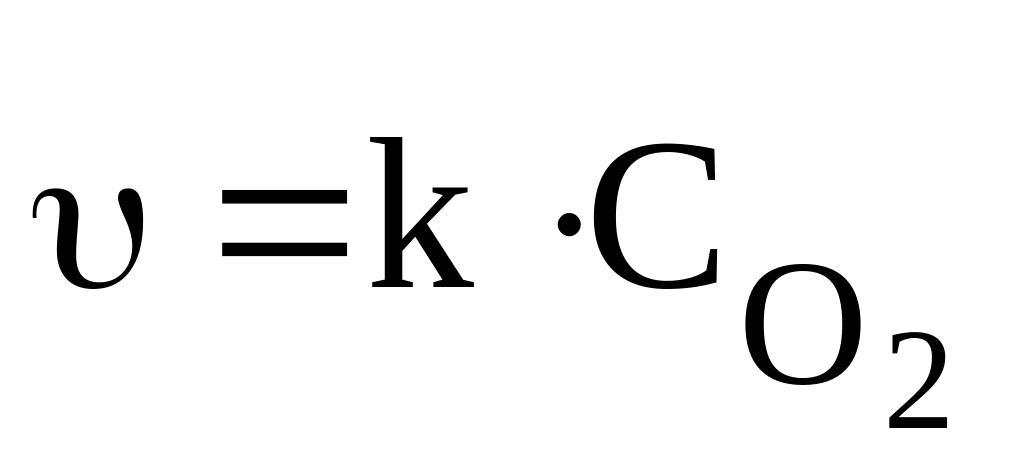
2Fe(т) + 3Cl2 = 2FeCl3; 2
Як зміниться швидкість реакції при збільшенні концентрації чадного газу в реакції СО + Сl2 = СОСl2 у 16 раз:
Зросте в 16 разів
*Зменшиться в 16 разів
Зросте у 8 разів
Зросте у 4 рази
Зросте у 3 рази
Як змінилася концентрація хлору в реакції СО + Сl2 = СОСl2, якщо за той самий час концентрація чадного газу зменшилась на 0,8 моль/л?
Зменшилася у 0,8 рази
Збільшилася у 0,8 рази
*Зменшилася на 0,8 моль/л
Зросла на 0,8 моль/л
Зменшилася у 0,08 рази
Швидкість хімічної реакції – це зміна:
*Молярної концентрації однієї з реагуючих речовин за одиницю часу
Пройденого шляху за одиницю часу
Концентрації реагуючих речовин
Це час за який закінчиться реакція
Зміна об’єму реагуючих речовин
Вплив концентрації реагуючих речовин на швидкість реакції визначається законом :
Авогадро
Об’ємних відношень
*Діючих мас
Сталості складу
Фарадея
Для реакції N2 + 3Н2 2 NH3 вираз швидкості прямої реакції матиме вигляд:
*υ = k[N2][H2]3
υ = k[N2] + [H2]3
υ = k[N2][3H2]3
υ = k[N2] +3[H2]3
υ = k[N2] -3[H2]3
Для реакції Fe2O3(т) + 3H2 = 2Fe + 3H2O(г) вираз швидкості прямої реакції матиме вигляд:
= k[Fe2O3][H2]3
= k[Fe2O3] + [H2]3
= k[Fe2O3] - [H2]3
= k[3H2]3
* = k[H2]3
У виразі υ = k [CO]3 символом k позначають:
Температурний коефіцієнт реакції
*Константу швидкості хімічної реакції
Мольну частку
Енергію активації
Коефіцієнт пропорційності
Згідно закону діючих мас швидкість хімічної реакції 2NO + Cl2(г) = 2NOCl(г) виражається виразом:
υ= k[NO] +[Cl2]
*υ= k[NO]2[Cl2]
υ= k[2NO] +[Cl2]
υ= k[2NO] [Cl2]
. υ= k[2NO] [2Cl2]
При підвищенні температури від 400 С до 700 С ( = 3) швидкість хімічної реакції зросте у:
3 рази
9 разів
*27 разів
51 раз
31 раз
При підвищенні температури від 300 С до 600 С ( = 2) швидкість реакції зросте у:
2 рази
4 рази
9 разів
16 разів
*8 разів
У скільки разів збільшиться швидкість реакції при підвищенні температури від 100 С до 400 С ( = 3) :
51 раз
*27 разів
9 разів
3 рази
4 рази
Як зміниться швидкість реакції H2(г) + I2(г) = 2HI при збільшенні тиску в 2 рази ( = k[H2][I2]) :
Збільшиться в 2 рази
Зменшиться в 2 рази
Збільшиться в 3 рази
Зменшиться в 4 рази
*Збільшиться в 4 рази
Для реакції 2SO2 + O2 2SO3 вираз для швидкості прямої реакції має вигляд:
υ = k [SO2]2 + [O2]
*υ = k[SO2]2[O2]
υ = k[2SO2][O2]
υ = k[SO3]2
υ = k[2SO2][2O2]
Для реакції Fe2O3(т) + 3CO(г) = 2Fe(т) + 3CO2(г) вираз швидкості реакції має вигляд:
υ = k[Fe2O3][CO]3
υ = k[Fe2O3]
*υ = k[CO]3
υ = k[Fe2O3] + [CO]3
υ = k[Fe2O3] - [CO]3
Як записується вираз для швидкості реакції 2А+В
 С, якщо всі речовини газоподібні?
С, якщо всі речовини газоподібні?= k [B]
= k [A]2
= k [A] [B]
= k [2A]2 [B]
* = k [A]2 [B]
Каталізатор пришвидшує хімічну реакцію завдяки:
*Пониженню енергії активації
Підвищенню енергії активації
Зростанню теплоти реакції
Зменшення теплоти реакції
Підвищенню тиску реакції
Для збільшення швидкості деякої реакції в 64 рази (γ = 4) необхідно підвищити температуру на (
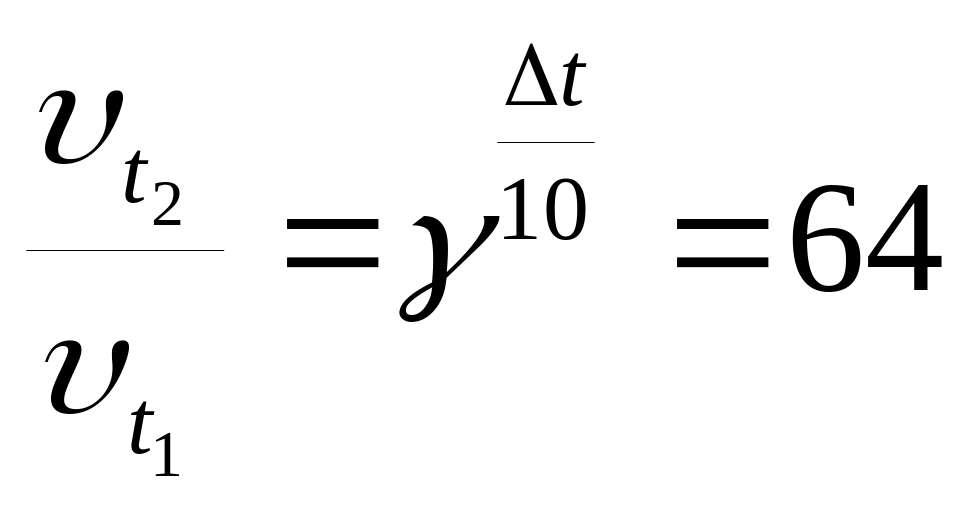 ):
):10˚С
20˚С
50˚С
40˚С
*30˚С
Швидкість реакції Fe2O3(т) + 3H2 → 2Fe + H2O при V=const і збільшенні кількості H2 в 2 рази зросте у:
2 рази
4 рази
*8 разів
16 разів
3 рази
Швидкість реакції C(т) + 2Cl2 → CCl4 при V=const і збільшенні кількості Cl2 в 2 рази зросте у:
2 рази
*4 рази
8 разів
16 разів
3 рази
Швидкість реакції 2CuO(т) + CO → Cu2O(т) + CO2 при V=const і збільшенні кількості CO в 2 рази зросте у:
*2 рази
4 рази
8 разів
16 разів
3 рази
Швидкість реакцій 2S(т) + 2NO2 → 2SO2 + N2 при V=const і збільшенні кількості NO2 в 2 рази зросте у:
2 рази
3 рази
8 разів
16 разів
*4 рази
Швидкість реакції 2Cu + O2 → 2CuO при V=const і збільшенні кількості O2 в 3 рази зросте у:
*3 рази
9 разів
6 разів
12 разів
10 разів
Для реакції, що відбувається за схемою
A + 2B AB2 швидкість прямої реакції виражається:
