
- •Iші дәріс тақырыбы
- •1.1 Сапалық анализдің әдістері
- •IIші дәріс тақырыбы
- •IiIші дәріс тақырыбы
- •IVші дәріс тақырыбы
- •Күшті қышқылдан және күшті негізден түзілген тұз -
- •4. Әлсіз қышқылдан және әлсіз негізден түзілген тұз.
- •Vші дәріс тақырыбы
- •VI ші дәріс тақырыбы
- •6.1 Тотығу-тотықсыздандыру (редокс) потенциал
- •6.2 Тотығу-тотықсыздандыру реакцияның тепе-теңдік константасы
- •ViIші дәріс тақырыбы
- •Комплексті қосылыстардағы химиялық байланыстың табиғатың түсіндіретін теориялар
- •Комплексті қосылыстар ерітіндісіндегі тепе-теңдік
- •ViiIші дәріс тақырыбы
- •8.1 Титриметриялық анализдің есептеуі
- •8.2 Қышқылды-негіздік әдісінің титрлеу қисықтары
- •IXші дәріс тақырыбы
- •Хромофорлық теория
- •Xші дәріс тақырыбы
- •Индикаторлар
- •Редокс-индикаторлар
- •XIші дәріс тақырыбы
- •XiIші Дәріс тақырыбы
- •Индикатормен титрлеу әдістері
- •XiiIші Дәріс тақырыбы
- •1. Комплексометрия
- •Цианидометрия
- •Хелатометрия
- •XivДәріс тақырыбы
- •1. Гравиметрия әдіс
- •XV ші дәріс тақырыбы
- •Молекулалы – абсорбциялық анализ
XiiIші Дәріс тақырыбы
1. Комплексометрия
Комплексометрия деп еритін комплекстер түзуіне негізделген титриметриялық әдістерді айтады. Комплексометриялық әдістермен орталық атомдарды және лигандтарды анықтауға болады. Комплексометрия келесі түрлерге бөлінеді:
1. меркуриметрия
2. фторидометрия
3. цианидометрия
4. хелатометрия.
Меркуриметрияда (II) сынаптың галогенидтермен еритін комплексті қосылыстар түзетіні қолданылады:
Hg2+ + 4Г - ↔ HgГ42-
Фторидометрия
Фторидометрияда кейбір иондар фтор-ионымен тұрақты комплексті тұздар түзетіні қолданылады. Көбінесе бұл әдіспен Al3+, Zr4+, Th4+, Ca2+ иондарын анықтайды. Натрий фторидінің ерітіндісімен титрлегенде бірінші үш ион мынадай реакциялар түзеді:
Al3+ + 6F - ↔ AlF63-
Zr4+ + 6F - ↔ ZrF62-
Th4+ + 6F - ↔ ThF62-
Индикатор ретінде метилоранж қолданылады. Фторидометрия нақты титрлеу әдістеріне жатпайды, бұл әдісті концентрациялары жоғары ерітінділерге ғана қолдануға болады (0,2 - 0,5 моль/л).
Цианидометрия
Цианидометрияда титрант ретінде калий цианидінің ерітіндісі алынады. Бұл әдіспен Ni2+, Co3+, Zn2+ иондарын анықтауға болады. Көбінесе аммиакты ерітінділерді титрлейді:
[Ni(NH3)4]2+ + 4CN- ↔ [Ni(CN)4]2- + 4NH3↑
Эквиваленттік нұктені анықтау үшін титрленетін ерітіндіге аз мөлшерінде күміс иодидінің суспензиясы қосылады.
AgI + 2CN- ↔ [Ag(CN)2]- + I-
Калий цианиды өте күшті уларға жатады, сол себептен бұл әдіс сирек қолданылады.
Хелатометрия
Хелатометриялық әдістердің ішінде өте кең тараған – комплексонометриялық әдіс. Комплексонометриялық әдісте титрант ретінде комплексондардың ерітінділері қолданылады. Комплексондар – органикалық қосылыстарға жатады, олар аминополикарбонды қышқылдардың туындылары болып келеді.
Комплексон III, этилендиаминтөртсірке қышқылының екі натрийлы тұзы Na2H2Y (ЭДТА). ЭДТА-ң құрамына алты функционалды топ кіреді: екі аминотобы және төрт карбоксил тобы, солар арқылы иондармен ішкікомплексті (хелатты) қосылыстар түзеді. ЭДТА-ң ерекше қасиеті: ол катиондармен 1:1 қатынаста реакцияға түседі n(ЭДТА) = n(Mn+).
Комплексонометриялық титрлеу әдісінде металлохромды индикаторлар қолданылады. Олар органикалық бойяғыштарға жатады, металдар иондарымен тұрақты бойялған комплекстер түзеді. Кең тараған индикаторлар: мурексид, эриохром қара Т, ксиленолді қою-сары, пирокатехинді күлгін.
Негізгі әдебиет: 2[179-1185], 3[102-105], 6[111-115].
XivДәріс тақырыбы
1. Гравиметрия әдіс
Гравиметрлік әдіс массаның сақталу заңына негізделген. Химиялық әдістердің ішінде бұл ең дәл әдістердің біріне жатады. Оның негізгі сипаттамалары: анықтайтын шегі – 0,10%, дұрыстығы - 0,2%.
Гравиметрияда – алмасу, ыдырату, комплекстүзу және электрохимиялық процестері қолданылады.
Гравиметрлік анықтамаларды үш үлкен топқа бөлуге болады: бос түрде бөліп алу, тұндырып алу, айдап алу.
Бос түрде бөліп алу – анықталатын компонентті бос күйінде зерттелетін заттан бөліп алады.
Мысалы: алтын мен мысты бөлгенде, сынаманы патша арағында ерітеді. Алтын мен мыс катион түрінде ерітіндіге ауысады. Алынған ерітіндіге Н2О2 қосады, сонда алтын бос түрінде тұнбаға түседі. Бөлінген алтынды сүзіп алады, HCl-мен жуады, кептіреді, қыздырады, өлшейді. Ал мысты ерітіндіге электр тоғын жіберу арқылы бос түрде бөліп алады.
Айдап алу әдісі – анықталатын компонент зерттелетін заттан газ күйінде бөлініп шығады.
Тұндыру әдісі – анықталатын компонентті химиялық әдіспен нашар еритің қосылысқа айналдырады. Тұнбалау әдісі кең тараған әдіс. Анықталатын затқа 1,5 есе артық мөлшерінде тұнбалаушы реагент көлемі қосылады. Алынған тұнба – тұндыру формасы деп аталады. Ерітіндіден тұнбаны бөліп алып, жуады, кептіреді, қыздырады, гравиметриялық формаға айналдырады да өлшейді. Гравиметриялық форма тұнбалау формамен дәл болуы мүмкін.
Мысалы: Сульфат иондарын анықтаған кезде, түсетін BaSO4-ң тұнбалану формасы гравиметриялық формасымен дәл келеді.
Гравиметриялық әдісте алынған заттың мөлшерін төмендегі теңдеумен есептейді:
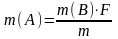
m(B) – гравиметрлік форманың массасы
F – гравиметрлік фактор
m – зерттелетін заттың массасы
m(A) – анықталатын компоненттің массасы.
Гравиметрлік фактор (басқаша аналитикалық көбейткіш) анықталатын компоненттің молекулярлық массасы мен гравиметрлік форманың молекулярлық массасының қатынасына тең. Гравиметрлік факторлардың мәні анықтамаларда берілген.
Мысалы: анықталатын компонент Al, гравиметрлік формасы Al2O3.
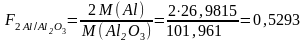
Тұнбалаушы-ион, тұнбалау және гравиметрлік формалар келесі қағидаларды қанағаттыру керек:
а) анықталатын компонент толық тұнбаға түсу керек, ерігіштігі 10-4 – 10-5 моль/л-н аспау керек;
б) тұну формасы оңай және толық гравиметрлік формасына ауысуы қажет;
в) гравиметрлік форманың химиялық құрамы тұрақты және ауада өзгермейтін болуы қажет;
г) гравиметрлік форманың молярлық массасының үлкен, ал анықталатын компоненттің мөлшері аз болуы қажет.
Негізгі әдебиет: 1[184- 200], 2[145-1148], 3[56-59], 6 [120-130].
