
- •Iші дәріс тақырыбы
- •1.1 Сапалық анализдің әдістері
- •IIші дәріс тақырыбы
- •IiIші дәріс тақырыбы
- •IVші дәріс тақырыбы
- •Күшті қышқылдан және күшті негізден түзілген тұз -
- •4. Әлсіз қышқылдан және әлсіз негізден түзілген тұз.
- •Vші дәріс тақырыбы
- •VI ші дәріс тақырыбы
- •6.1 Тотығу-тотықсыздандыру (редокс) потенциал
- •6.2 Тотығу-тотықсыздандыру реакцияның тепе-теңдік константасы
- •ViIші дәріс тақырыбы
- •Комплексті қосылыстардағы химиялық байланыстың табиғатың түсіндіретін теориялар
- •Комплексті қосылыстар ерітіндісіндегі тепе-теңдік
- •ViiIші дәріс тақырыбы
- •8.1 Титриметриялық анализдің есептеуі
- •8.2 Қышқылды-негіздік әдісінің титрлеу қисықтары
- •IXші дәріс тақырыбы
- •Хромофорлық теория
- •Xші дәріс тақырыбы
- •Индикаторлар
- •Редокс-индикаторлар
- •XIші дәріс тақырыбы
- •XiIші Дәріс тақырыбы
- •Индикатормен титрлеу әдістері
- •XiiIші Дәріс тақырыбы
- •1. Комплексометрия
- •Цианидометрия
- •Хелатометрия
- •XivДәріс тақырыбы
- •1. Гравиметрия әдіс
- •XV ші дәріс тақырыбы
- •Молекулалы – абсорбциялық анализ
IXші дәріс тақырыбы
Қышқылды- негіздік индикаторлар
Қышқылды- негіздік индикаторларға әлсіз органикалық қышқылдар мен негіздерге жатады. Протон беретін индикаторларды қышқылдық индикаторлар дейді, HIn деп белгілейді.
HIn + H2O ↔ H3O+ + In- (9.1)
Протонды қосып алатын индикаторларды - негіздік индикаторлар дейді, In деп белгілейді.
In + H2O ↔ InH+ +OH- (9.2)
Оствальдтың иондық теориясы бойынша индикатордың түсінің өзгеруі диссоциациялану процесінің тепе-теңдігінің ығысуына тәуелді. Индикатордың қышқылдық және негіздік формаларының түсі әртүрлі.
HIn + H2O ↔ H3O+ + In-
Егер реакцияның тепе-теңдігі оң жаққа қарай ығысқан болса, онда ертіндінің түсі индикатордың негіздік формасының түсіне сәйкес келеді.
Егер реакцияның тепе-теңдігі оңнан солға қарай ығысқан болса, онда ертіндінің түсі индикатордың қышқылдық формасының түсіне сәйкес келеді.
Адам
көзі үшін
HIn концентрациясы
In-
концентрациясынан
10 есе артық болған жағдайда, индикатордың
түсі қышқылды формасының түсі болып
көрінеді, ал керісінше жағдайда, негіздік
формасының түсі болып көрінеді.
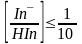 (9.6)
(9.6)
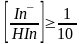 (9.7)
(9.7)
(9.6) және (9.7) теңдеулерді (9.5)-ге қоямыз:
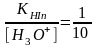


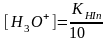
pT индикатордың титрлеу көрсеткіші, ол индикаторды колданғанда ең тиімді рН-ң мәнін көрсетеді. Сонымен индикатордың түсінің өзгеруі ерітіндінің рН-ң мәніне байланысты.
Мысалы: фенолфталеин – қышқылдық индикатор
КHin = 10-9
pH = 9 -- 1 = 8 қышқылдық формасы
pH = 9 + 1 = 10 негіздік формасы
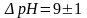
Хромофорлық теория
Бұл теория бойынша ерітіндінің рН өзгерген кезде қышқылды-негіздік индикатордың молекуласында ішкімолекулалық топтасу орын алады, оның нәтижесінде индикатордың түсі өзгереді. Бұл құбылыс қайтымды таутомерлы изомерия деп аталады. Демек, индикатордың екі таутомерлы формалары да болуы мүмкін және бір форма екінші формаға ауыса алады. Бұл процесс тепе-теңдік орнаққанша жүреді. Индикаторлардың түсі оның молекуласына кіретін “ түс тасмалдаушы” хромофорлық топтардың таутомерлы ауысуыларына тәуелді:
нитротоптың
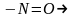
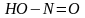 нитрозотопқа,
нитрозотопқа,
азотоптың
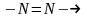
 гидразотопқа,
гидразотопқа,

бензой тобының хиноидты топқа.
“ Түс тасмалдаушы” хромофорлық топтармен қатар индикатордың құрамына заттың түсін күшейтетін ауксохромды топтар қіреді:
1)
аминотобы
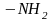 ;
;
2)
эфир тобы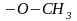 ;
;
3)
этилды радикал тобы ;
;
4)
гидроксил тобы .
.
Негізгі әдебиет: 1[245-255]; 2[202-209], 4[280-283].
Xші дәріс тақырыбы
Тотығу-тотықсыздандыру титрлеу әдісі
Тотығу-тотықсыздандыру титрлеу әдістері келесі түрлерге бөлінеді:
1) перманганатометриялық
2) иодометриялық
3) хроматометриялық
4) броматометриялық
5) иодатометриялық
6) ванадатометриялық және т.б. Кез-келген тотығу-тотықсыздандыру реакция жүру үшін жүйеде екі тотықтырғыш және екі тотықсыздандырғыш болу қажет:
OX1 + Red2 ↔ Red1 + OX2
Редоксиметриялық процесінің титрлеу қисығын салған кезде потенциалды есептеу үшін Нернст теңдеуі қолданылады:
 (10.1)
(10.1)
