
- •Iші дәріс тақырыбы
- •1.1 Сапалық анализдің әдістері
- •IIші дәріс тақырыбы
- •IiIші дәріс тақырыбы
- •IVші дәріс тақырыбы
- •Күшті қышқылдан және күшті негізден түзілген тұз -
- •4. Әлсіз қышқылдан және әлсіз негізден түзілген тұз.
- •Vші дәріс тақырыбы
- •VI ші дәріс тақырыбы
- •6.1 Тотығу-тотықсыздандыру (редокс) потенциал
- •6.2 Тотығу-тотықсыздандыру реакцияның тепе-теңдік константасы
- •ViIші дәріс тақырыбы
- •Комплексті қосылыстардағы химиялық байланыстың табиғатың түсіндіретін теориялар
- •Комплексті қосылыстар ерітіндісіндегі тепе-теңдік
- •ViiIші дәріс тақырыбы
- •8.1 Титриметриялық анализдің есептеуі
- •8.2 Қышқылды-негіздік әдісінің титрлеу қисықтары
- •IXші дәріс тақырыбы
- •Хромофорлық теория
- •Xші дәріс тақырыбы
- •Индикаторлар
- •Редокс-индикаторлар
- •XIші дәріс тақырыбы
- •XiIші Дәріс тақырыбы
- •Индикатормен титрлеу әдістері
- •XiiIші Дәріс тақырыбы
- •1. Комплексометрия
- •Цианидометрия
- •Хелатометрия
- •XivДәріс тақырыбы
- •1. Гравиметрия әдіс
- •XV ші дәріс тақырыбы
- •Молекулалы – абсорбциялық анализ
ViiIші дәріс тақырыбы
Сандық анализ. Титриметрия.
Сандық анализге заттың құрамын сандық жағынан анықтайтын химиялық және физика-химиялық әдістер жатады. Химиялық әдістерге гравиметриялық, титриметриялық және газоволюметриялық әдістер жатады. Көлемді дәл өлшеуге негізделген әдісті титриметриялық әдіс деп айтады.
Титрлеу процесінің негізгі мақсаты – зерттеліп отырған затқа эквивалентті мөлшерінде титрант қосу.
Титрлеу процесі деп зерттелетін заттың ерітіндісіне қосылған титранттың көлемін дәл өлшеу процесін айтады.
Титрант деп концентрациясы белгілі ерітіндіні айтады. Қосылған титранттың көлемі зерттеліп отырған зат мөлшеріне эквивалентті болған кезді теориялық эквиваленттік нүкте дейді. Мысалы: натрий хлоридінің ерітіндісін күміс нитратымен титрлегенде эквиваленттік нүктеге жеткен кезде әрбір хлорид- ионы бір күміс-ионымен қосылған болып саналады:
NaCl+AgNO3=AgCl↓+NaNO3
Ag+ + Cl- = AgCl↓
Тәжірибе жүзінде эквиваленттік нүктеге жүық реакцияның соңғы нүктесін анықтайды. Химиялық әдістерде реакцияның соңғы нүктесін қосылған индикатордың түсінің өзгеруінен байқайды. Электрохимиялық, оптикалық, термохимиялық әдістерде реакцияның соңғы нүктесін физикалық параметрлердің: ерітіндінің рН-ң, потенциалының, электрөткізгіштігінің ерекше өзгеруінен анықтайды. Титриметриялық әдістерді реакция түріне байланысты 4 топқа бөледі:
1) қышқылды-негіздік
2) тұнбалау
3) тотығу-тотықсыздандыру
4) комплексометриялық.
8.1 Титриметриялық анализдің есептеуі
Эквиваленттер заңы бойынша заттар химиялық эквиваленттеріне пропорционал мөлшерінде бір-бірімен реакцияға түседі. Эквиваленттің өлшем бірлігі – моль.
n(1/z A) = n(1/z B) (8.1)
мұнда: 1/z A; 1/z B – эквиваленттік фактор;
z – эквиваленттік сан.
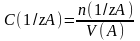 (8.2)
(8.2)
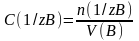 (8.3)
(8.3)
(8.2) және (8.3) теңдеулерді (8.1) теңдеуге қойып, негізгі титриметриялық әдістің теңдеуін аламыз:
С(1/z A)∙V(A) = C(1/z B)∙V(B) (8.4)
8.2 Қышқылды-негіздік әдісінің титрлеу қисықтары
Қышқылды-негіздік титрлеу әдісінің 4 түрлі титрлеу қисықтары бар:
1) күшті қышқылды күшті негізбен титрлеу
2) әлсіз қышқылды күшті негізбен титрлеу
3) әлсіз негізді күшті қышқылмен титрлеу
4) күшті негізді күшті қышқылмен титрлеу.
Күшті қышқылды суда еріткенде келесі тепе-теңдік орын алады:
НА + Н2О ↔ Н3О+ + А-
Сондықтан күшті қышқылдың ерітіндісінде гидросоний-ионының концентрациясы келесі теңдеумен анықталады:
[H3O+] = C(HA) (8.5)
Эквиваленттік нүктеге дейінгі бөлімде:
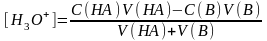 (8.6)
(8.6)
Эквиваленттік нүктеде жүйеде тұздың сулы ерітіндісі тұрады, сондықтан ерітіндідегі гидроксоний-иондарының концентрациясы болады тең: [H3O+] = [OH-] = 10-7 моль/л.
Эквиваленттік нүктеден кейін ерітіндінің рН-ы артық қосылған күшті негіздің концентрациясымен анықталады:
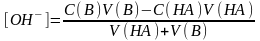 (8.7)
(8.7)
Титрлеу қисығы келесі түрде болады:

Негізгі әдебиет: 1[70-90], 3[28-51], 4[74-87].
