
- •Iші дәріс тақырыбы
- •1.1 Сапалық анализдің әдістері
- •IIші дәріс тақырыбы
- •IiIші дәріс тақырыбы
- •IVші дәріс тақырыбы
- •Күшті қышқылдан және күшті негізден түзілген тұз -
- •4. Әлсіз қышқылдан және әлсіз негізден түзілген тұз.
- •Vші дәріс тақырыбы
- •VI ші дәріс тақырыбы
- •6.1 Тотығу-тотықсыздандыру (редокс) потенциал
- •6.2 Тотығу-тотықсыздандыру реакцияның тепе-теңдік константасы
- •ViIші дәріс тақырыбы
- •Комплексті қосылыстардағы химиялық байланыстың табиғатың түсіндіретін теориялар
- •Комплексті қосылыстар ерітіндісіндегі тепе-теңдік
- •ViiIші дәріс тақырыбы
- •8.1 Титриметриялық анализдің есептеуі
- •8.2 Қышқылды-негіздік әдісінің титрлеу қисықтары
- •IXші дәріс тақырыбы
- •Хромофорлық теория
- •Xші дәріс тақырыбы
- •Индикаторлар
- •Редокс-индикаторлар
- •XIші дәріс тақырыбы
- •XiIші Дәріс тақырыбы
- •Индикатормен титрлеу әдістері
- •XiiIші Дәріс тақырыбы
- •1. Комплексометрия
- •Цианидометрия
- •Хелатометрия
- •XivДәріс тақырыбы
- •1. Гравиметрия әдіс
- •XV ші дәріс тақырыбы
- •Молекулалы – абсорбциялық анализ
VI ші дәріс тақырыбы
Тотығу-тотықсыздандыру реакциялардың
ерітінділеріндегі тепе-теңдік
Тотығу-тотықсыздандыру реакцияның негізіне реакцияға қатысатын заттар арасындағы электрондар ауысуы жатады:
ОХ + nē ↔ Red
Тотығу – электрон беру процесі, тотықсыздандыру – электрон қосып алу процесі. Электрондарды ауыстырудың екі әдісі бар: химиялық және электрохимиялық. Химиялық әдісте заттың сапалық өзгерістерін көруге болады: ерітінді түсінің өзгеруі, газ бөлініп шыгуы, тұнбаның түзілуі.Электрохимиялық әдісте электрондардың ауысуы гальваникалық элементтің жұмысымен жүзеге асады.
6.1 Тотығу-тотықсыздандыру (редокс) потенциал
Кез-келген тотығу-тотықсыздандыру жартылай реакция
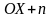 ē
↔ Red
ē
↔ Red
редокс потенциалдың мәнімен сипатталады.
Бөлек
алынған бір электродтың абсолюттік
потенциалын өлшейтін мүмкіншілік жоқ,
сондықтан жартылай реакциялардың
потенциалдарын салыстыру үшін стандарт
қажет. Сондай стандарт ретінде стандартты
сутегі электроды алынған (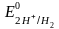 ),
оның потенциалы Р = 1 атм, Т = 298К, ерітіндінің
концентрациясы 1М ерітіндіде 0
тең деп алынған.
),
оның потенциалы Р = 1 атм, Т = 298К, ерітіндінің
концентрациясы 1М ерітіндіде 0
тең деп алынған.
Стандартты потенциал дегеніміз барлық реагенттер мен заттардың активтілігі бірге тең уақыттағы стандартты сутегі электроды арқылы салыстырмалы өлшенген жартылай реакцияның электродтық потенциалы.
Электродтық потенциалдың мәні температураға, концентрацияға, заттың табиғатына, ортаның рН-а және т.б. факторларға тәуелді. Бұл тәуелділікті Нернст теңдеуі көрсетеді:
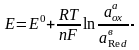 (6.1)
(6.1)
мұнда: Е – реалды электродты потенциал
Е0 – стандартты электродты потенциал
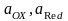 -
тотыққан және тотықсызданған формалардың
активтіліктері
-
тотыққан және тотықсызданған формалардың
активтіліктері
Т – Кельвин температурасы
R – газдық константа
F – Фарадей саны;
n - электрон саны
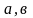 -
стехиометрлік коэффициенттер.
-
стехиометрлік коэффициенттер.
6.2 Тотығу-тотықсыздандыру реакцияның тепе-теңдік константасы
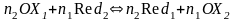
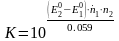 (6.2)
(6.2)
Тепе-теңдік константа арқылы тотығу-тотықсыздандыру реакция компоненттерінің тепе-теңдік концентрацияларын есептеуге болады.
Негізгі әдебиет: 1[70-101], 2[66-97], 3[145-199].
ViIші дәріс тақырыбы
Комплексті қосылыстардың ерітінділердегі тепе-теңдік
Комплексті қосылыстар түзу өтпелі металдарға тән қасиет. Орталық атомның айналасына геометриялық дұрыс орналасқан екі-, төрт-, бес-, алты- кейде оданда көп химиялық топтар (лигандар) комплексті қосылыстардың ерекше белгісі. Лиганд ретінде бейтарап молекулалар, катиондар немесе аниондар болуы мүмкін. Лигандалар комплекстүзуші атомның химиялық қасиеттерін өзгертеді.
Комплексті қосылыстардағы химиялық байланыстың табиғатың түсіндіретін теориялар
Өтпелі металдардың комплексті қосылыстарындағы химиялық байланыстың дамуын келесі төрт теория көрсетеді:
1.электростатикалық теория
2.валентті байланыстар теориясы
3.кристалл өрісінің теориясы
4. лигандалар өрісінің теориясы
Комплексті қосылыстар ерітіндісіндегі тепе-теңдік
Сулы ерітіндіде катиондар гидратталған түрінде болады, яғни судың молекулаларымен аквакомплекстер түзеді М(ОН2)n, мұнда: n – орталық атомның координациялық саны.
Ерітіндіге комплекстүзуші қосылыстарды енгізгенде, олар біртіндеп аквакомплекстердің құрамынан, яғни ішкі сферадан, судың молекулаларын ығыстырады және өздері олардың орнына орнығады:
М(ОН2)n + L ↔ М(ОН2)N-1 L + H2O
М(ОН2)N-1 L + L ↔ М(ОН2)N-2 L2 + H2O
… …
М(ОН2)N-n Ln-1 + L → МLN + H2O
Жазылған реакциялар үшін массалар әрекеттесуші заңын қолданып, тұрақтылық константаның теңдеуін жазуға болады.
Элементарлы бөлшектердің зарядтарын белгілемейміз. Комплекстүзуші процесс сатылап жүреді, әр сатының өзінің сатылы тұрақтылық константасы бар.
К1; К2; Кn-1 – сатылы константалар.
M + nL = MLn
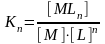
Негізгі әдебиет: 1[70-101], 2[66-97], 3[145-199].
