
- •21. Методы получения алкинов. Получение ацетилена.
- •24. Одноатомные первичные, вторичные и третичные спирты. Химические свойства одноатомных спиртов – взаимодействие с металлами, реакция этерификации.
- •25. Галогенирование, дегидратация и окисление одноатомных спиртов. Понятие о нуклеофильном замещении и элиминировании.
- •26. Многоатомные спирты (этиленгликоль и глицерин). Окисление двухатомных спиртов.
- •27. Методы получения спиртов
- •28. Фенолы. Кислотность фенола. Sе-реакции фенола (галогенирование, нитрование, сульфирование). Ориентирующее влияние гидроксигруппы.
- •Фенолформальдегидные смолы. Их синтез, структура и свойства.
- •30. Оксосоединения: альдегиды и кетоны. Электронное строение оксогруппы. Механизм реакции нуклеофильного присоединения (аn). Присоединение аминов, спиртов, синильной кислоты, бильсуфита натрия.
21. Методы получения алкинов. Получение ацетилена.
Общий способ получения алкинов — отщепление двух молекул галогеноводорода от дигалогеналканов, которые содержат два атома галогена либо у соседних, либо у одного атома углерода, под действием спиртового раствора щелочи.
|
С2Н5ОН |
|
СН2Вr - СН2Вr + 2КОН |
→ |
НС ≡ СН + 2КВr + 2Н2О, |
|
С2Н5ОН |
|
|
СН3 - СВr2 - СН3 + 2КОН |
→ |
СН3-С ≡ СН + 2КВr + 2Н2О, |
|
В лабораторных условиях ацетилен получают гидролизом карбида кальция:
СаС2 + 2Н2О = Са(ОН)2 + С2Н2 ↑
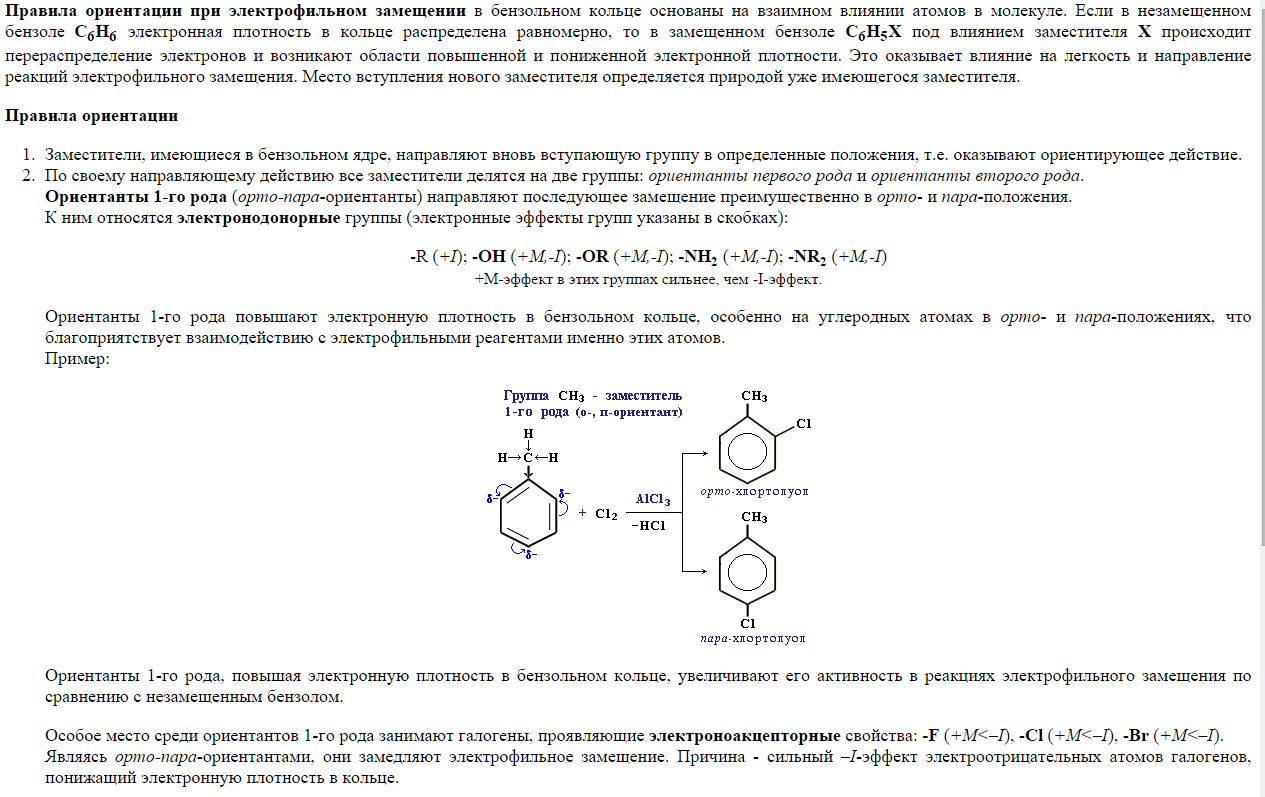
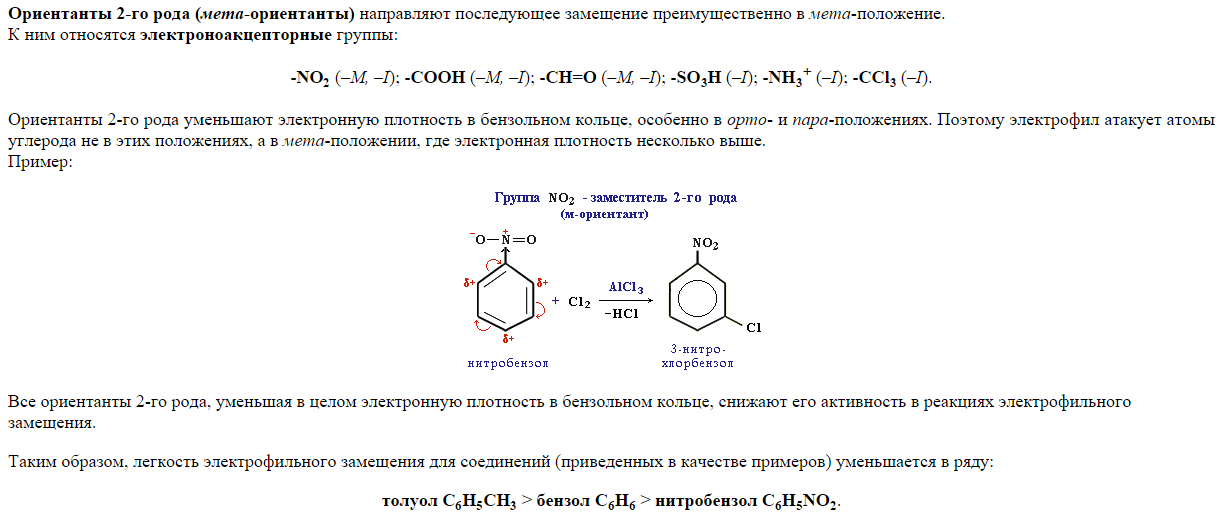
22. Реакции электрофильного замещения (SЕ) у аренов. Галогенирование, нитрование, сульфирование, алкилирование, ацилирование ароматических соединений (бензола, толуола, анилина, фенола, нитробензола). Правила ориентации в бензольном кольце.
Механизм реакции SEAr или реакции ароматического электрофильного замещения
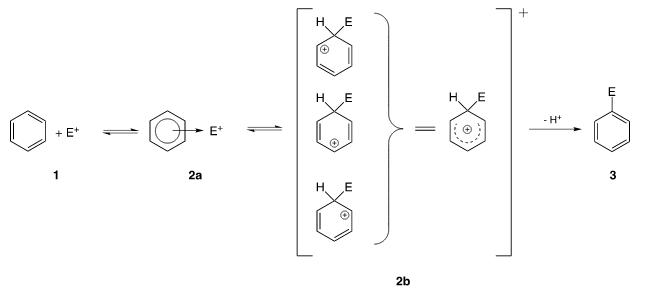
В ходе реакции образуется промежуточный положительно заряженный интермедиат (на рисунке — 2b). Он носит название интермедиат Уэланда,арониевый ион или σ-комплекс. Этот комплекс, как правило, очень реакционноспособен и легко стабилизируется, быстро отщепляя катион.
Лимитирующей стадией в подавляющем большинстве реакций SEAr является первый этап.
Галогенирование бензола бромом, хлором или йодом приводит к образованию арилгалогенидов. Катализатором реакции выступает галогенид железа (III):
![]()
Образование активной частицы[2]:
![]()
Нитрование ароматических систем азотной кислотой в присутствии серной кислоты с получением нитросоединений:
![]()
Образование активной частицы[2]:
![]()
Сульфирование бензола с получением сульфокислоты:
![]()
Активной частицей в реакции является SO3.
Реакция Фриделя-Крафтса — ацилирование или алкилирование с использованием ацил- или алкилгалогенидов. Типичным катализатором реакции служит хлорид алюминия, но может использоваться любая другая сильная кислота Льюиса.
![]()
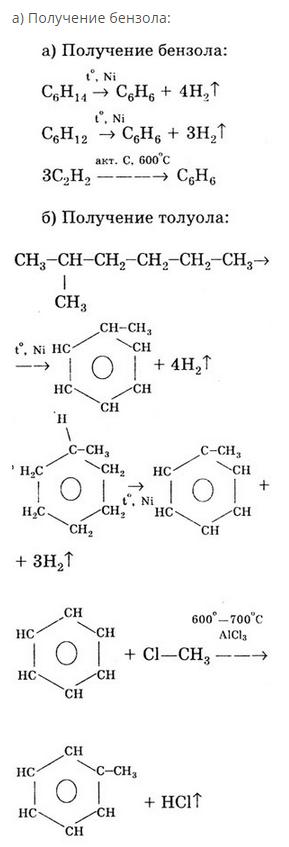
24. Способы получения аренов: получение бензола и толуола.
24. Одноатомные первичные, вторичные и третичные спирты. Химические свойства одноатомных спиртов – взаимодействие с металлами, реакция этерификации.
По типу атома углерода, с которым связана гидроксильная группа, различают первичные (R—CH2—OH), вторичные (R—CHOH—R') и третичные (RR'R''C—OH) спирты.
Первичный спирт: |
Вторичный спирт: |
Третичный спирт: |
CH3CH2CH2CH2—OH бутанол-1 (бутиловый сприт) |
|
|
CnN2n+2O - общая формула и предельных одноатомных спиртов, и простых эфиров.

Реакции этерификации
Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).
![]()
![]()

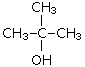 2-метилпропанол-2
(трет-бутиловый
спирт)
2-метилпропанол-2
(трет-бутиловый
спирт)