
- •Работа № 1 (термодинамика) Определение теплоты растворения хорошо растворимых солей
- •Интегральные теплоты растворения солей в воде при 25 с
- •Интегральные теплоты растворения солей, образующих кристаллогидраты, при 25 с
- •Работа № 7 (термодинамика) Изучение химического равновесия в гетерогенной системе
- •Работа № 1 (кинетика) Определение порядка реакции по времени полупревращения
- •Работа № 2 (кинетика) Определению порядка реакции графическим методом
- •Работа № 2 (фазовые равновесия) Изучение зависимости давления насыщенного пара индивидуальных жидкостей от температуры
Интегральные теплоты растворения солей, образующих кристаллогидраты, при 25 с
Вещество |
Число молей H2O на 1 моль соли |
–Hm, кДж/моль |
BaCl2 |
400 |
11,18 |
BaCl2 H2O |
400 |
–7,74 |
BaCl2 2H2O |
400 |
–18,74 |
CuSO4 |
500 |
68,37 |
CuSO4 H2O |
500 |
40,42 |
CuSO4 3H2O |
500 |
12,68 |
CuSO4 5H2O |
500 |
–10,50 |
LiCl |
800 |
36,53 |
LiCl H2O |
800 |
18,58 |
LiCl 2H2O |
800 |
4,06 |
LiCl 3H2O |
800 |
–8,83 |
MgSO4 |
400 |
87,61 |
MgSO4 2H2O |
400 |
46,36 |
MgSO4 4H2O |
400 |
17,66 |
MgSO4 6H2O |
400 |
1,00 |
MgSO4 7H2O |
400 |
–15,86 |
Na2CO3 |
400 |
23,43 |
Na2CO3 7H2O |
400 |
–45,86 |
Na2CO3 10H2O |
400 |
–69,04 |
Na2HPO4 |
500 |
25,94 |
Na2HPO4 2H2O |
500 |
0,17 |
Na2HPO4 7H2O |
500 |
–47,95 |
Na2HPO4 12H2O |
500 |
–96,06 |
ZnSO4 |
500 |
77,28 |
ZnSO4 H2O |
500 |
42,13 |
ZnSO4 6H2O |
500 |
–4,31 |
ZnSO4 7H2O |
500 |
–18,87 |
Работа № 7 (термодинамика) Изучение химического равновесия в гетерогенной системе
Цель работы
Освоить статический метод исследования химического равновесия; изучить зависимость химического равновесия от температуры; по экспериментальным данным рассчитать тепловой эффект и другие термодинамические характеристики реакции.
Вопросы коллоквиума
Химическое равновесие. Условие химического равновесия. Константа равновесия.
Закон действующих масс. Термодинамический вывод константы равновесия.
Подвижность химического равновесия. Принцип Ле-Шателье. Влияние изменения внешних условий на равновесие.
Уравнение изобары химической реакции как количественное выражение смещения равновесия при изменении температуры. Анализ и интегрирование уравнения изобары.
Определение теплового эффекта реакции по константам равновесия при различных температурах.
Экспериментальные методы определения упругости диссоциации.
Приборы и реактивы
Печь трубчатая.
Манометр.
Милливольтметр.
Карбонат кальция.
Методика выполнения работы и ее обоснование
Химическое равновесие в гетерогенных системах рассмотрим на примере реакции диссоциации карбоната кальция.
Процессы диссоциации карбонатов широко распространены в металлургии и химической промышленности (обжиг известняка, разложение известняка в доменной печи, где он используется в качестве флюса, известковое кипение в мартеновской печи и т. д.).
Карбонат кальция, являющийся составной частью мела, известняка, мрамора, диссоциирует по реакции:
CaCO3(т) = CaO(т) + CO2(г).
Эта реакции обратима. Константа равновесия имеет вид:
 ,
(7.1)
,
(7.1)
где
![]() –
активности оксида и карбоната кальция;
–
активности оксида и карбоната кальция;
![]() –
фугитивность
двуокиси углерода.
–
фугитивность
двуокиси углерода.
Считаем,
что активности чистых фаз CaCO3(т)
и CaO(т)
при данной температуре постоянны:
![]() =
1 и
=
1 и
![]() =
1, и при небольших давлениях
=
1, и при небольших давлениях
![]() .
Константа равновесия реакции принимает
вид:
.
Константа равновесия реакции принимает
вид:
![]() ,
(7.2)
,
(7.2)
где
![]() –
равновесное давление или упругость
диссоциации карбоната кальция.
–
равновесное давление или упругость
диссоциации карбоната кальция.
Изменение упругости диссоциации с ростом температуры можно показать на основании уравнения изобары реакции:
![]() .
(7.3)
.
(7.3)
С учетом (7.2) уравнение изобары для данной реакции можно записать:
![]() .
(7.4)
.
(7.4)
Для процесса диссоциации ∆H > 0, поэтому упругость диссоциации растет с увеличением температуры.
Изменение упругости диссоциации с ростом температуры показано на рис.2. Кривая делит плоскость диаграммы на две области. В области, лежащей выше равновесной кривой, устойчив карбонат кальция, ниже – оксид кальция. Для области I характерны давления CO2, большие, чем равновесные.
Используя уравнение изотермы:
![]() ,
(7.5)
,
(7.5)
можно
определить знак ∆G
для процесса в условиях I.
Так как фактическое давление CO2
для всех точек этой области выше
равновесного, т.е.
![]() ,
то ∆G
> 0. Следовательно, в условиях повышенного
по сравнению с равновесным, давления
CO2,
возможна обратная реакция – процесс
карбонизации: CaO(т)
+ CO2(г)
= CaCO3(т).
,
то ∆G
> 0. Следовательно, в условиях повышенного
по сравнению с равновесным, давления
CO2,
возможна обратная реакция – процесс
карбонизации: CaO(т)
+ CO2(г)
= CaCO3(т).
Аналогично
рассуждая для области II,
где
![]() ,
можно заключить, что при давлениях ниже
равновесного возможно развитие процесса
диссоциации, т.к. ∆G
< 0.
,
можно заключить, что при давлениях ниже
равновесного возможно развитие процесса
диссоциации, т.к. ∆G
< 0.
Численные значения равновесных , атм при различных температурах могут быть получены из уравнения:
![]() ,
(7.6)
,
(7.6)
где
![]() –
тепловой эффект реакции при данной
температуре, Дж/моль;
–
тепловой эффект реакции при данной
температуре, Дж/моль;
![]() – изменение
энтропии реакции для этой же температуры,
– изменение
энтропии реакции для этой же температуры,
Дж/(моль∙К).
Теоретические значения и можно рассчитать, используя справочные величины (табл. 7.2).
П роинтегрировав
уравнение (7.4) в пределах
роинтегрировав
уравнение (7.4) в пределах
![]() и
и
![]() и соответственно T1
и T2
(предполагая постоянство ∆H
в данном интервале температур), получим
соотношение:
и соответственно T1
и T2
(предполагая постоянство ∆H
в данном интервале температур), получим
соотношение:
![]() ,
(7.7)
,
(7.7)
из которого можно найти величину теплового эффекта реакции в данном температурном интервале:
 .
(7.8)
.
(7.8)
Рис.2 Зависимость упругости
диссоциации от температуры
Для измерения упругости диссоциации карбонатов часто используют статический метод. Суть его заключается в непосредственном измерении давления в установке, предварительно откачанной до предельного разряжения. При этом в печи при заданной температуре помещена навеска карбоната кальция. При малых равновесных давлениях измеряют с помощью манометра Мак-Леода, принцип действия которого основан на законе PV = const. При больших упругостях диссоциации иногда ограничиваются масляным U – образным манометром (рис.3).

Рис.3. Схема установки: 1 – образец; 2 – термопара; 3 – милливольтметр; 4 – печь; 5 – кварцевая трубка; 6 – вакуумметр; 7 – двухходовой кран.
Порядок выполнения работы
Через открытый конец кварцевой трубки (рис. 3) в печь помещают навеску карбоната кальция, вес которой строго не контролируется, однако должен быть избыток карбоната по сравнению с количеством, необходимым для установления равновесия. Иногда навеска бывает заранее внесена в трубку печи. Конец трубки закрывается шлифом или пробкой и включается масляный ротационный насос. Вакуумный кран при этом открыт, а кран для впуска воздуха закрыт. Если опыт производится с навеской повторно (перед началом опыта в установке разряжение), то вакуумный кран открывают на 2 – 3 минуты после включения насоса, когда в части системы создается разряжение. Открывать вакуумный кран следует очень осторожно, поддерживая его левой рукой, а правой плавно поворачивая пробку крана. Система откачивается до предельного разряжения. Закрывают вакуумный кран, включают насос и открывают кран для впуска воздуха. При использовании только трехходового крана впуск воздуха и подсоединение вакуума производятся с его помощью. Выполняется в присутствии преподавателя.
Систему выдерживают под вакуумом, проверяя ее надежность в течение 5 – 10 минут. Затем включают печь и доводят температуру до первой заданной. Поддерживая температуру постоянной в течение 10 – 15 минут, достигают установления постоянного давления, определяемого манометром. Показание манометра при данной температуре позволяет рассчитать упругостью диссоциации известняка. При высоких температурах выдержку можно делать меньше, чем при низких, так как скорость реакции с ростом температуры возрастает. При достижении постоянного давления записывают его величину и повышают температуру печи до следующей заданной. Таким образом, производят измерения разновесных давлений CO2 при нескольких температурах в диапазоне 500 – 800°С с шагом в 25 – 50°С (по заданию преподавателя).
По опытным данным строят график в координатах ln –
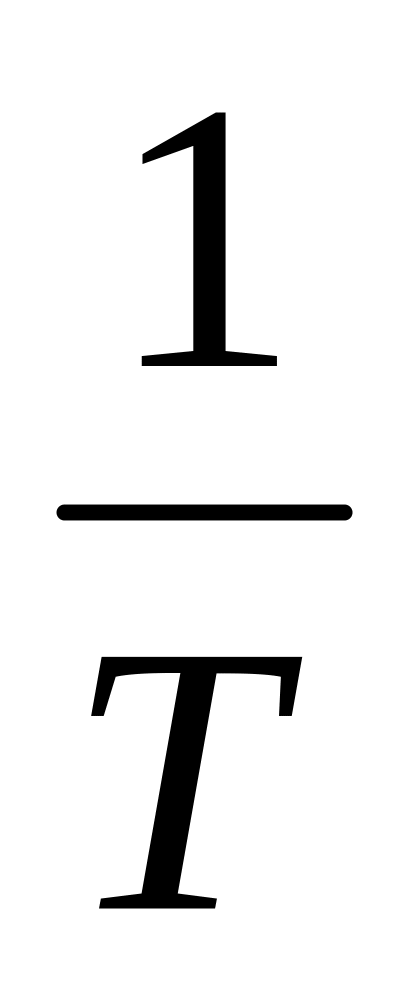 ,
из которого определяют тепловой эффект
реакции по уравнению 7.8.
,
из которого определяют тепловой эффект
реакции по уравнению 7.8.Теоретические значения рассчитывают по уравнению 7.6. Величины и находят с помощью справочных данных (табл. 7.2).
Сопоставляют теоретические и опытные значения и и делают вывод о влиянии температуры на химическое равновесие.
Таблица 7.1
Опытные и теоретические данные
Опытные данные |
Теоретические данные |
|||||||||
температура, T |
показания вакууметра |
ln |
, K–1 |
,
|
,
|
ln |
|
|||
°С |
K |
n |
, Па |
атм |
Па |
|||||
|
|
|
|
|
|
|
|
|
|
|
Таблица 7.2
Справочные термодинамические данные
Вещество |
Н0f,298,
|
S0298,
|
Коэффициенты уравнения С0P = f (T) |
||
а |
b103 |
с110–5 |
|||
СаСО3 (т) |
–1206,83 |
91,71 |
104,52 |
21,92 |
–25,94 |
СаО (т) |
–635,10 |
38,07 |
49,63 |
4,52 |
–6,95 |
СО2 (г) |
–393,51 |
213,66 |
44,14 |
9,04 |
–8,53 |
