
- •Работа № 1 (термодинамика) Определение теплоты растворения хорошо растворимых солей
- •Интегральные теплоты растворения солей в воде при 25 с
- •Интегральные теплоты растворения солей, образующих кристаллогидраты, при 25 с
- •Работа № 7 (термодинамика) Изучение химического равновесия в гетерогенной системе
- •Работа № 1 (кинетика) Определение порядка реакции по времени полупревращения
- •Работа № 2 (кинетика) Определению порядка реакции графическим методом
- •Работа № 2 (фазовые равновесия) Изучение зависимости давления насыщенного пара индивидуальных жидкостей от температуры
Работа № 1 (термодинамика) Определение теплоты растворения хорошо растворимых солей
Цель работы
Определить изменение температуры при растворении соли, рассчитать интегральную теплоту растворения.
Вопросы коллоквиума
Первый закон термодинамики. Теплота и работа.
Закон Гесса. Следствия из закона Гесса.
Тепловые эффекты химических реакций при постоянном давлении и постоянном объеме.
Методы расчета тепловых эффектов химических реакций.
Теплоемкость веществ. Связь между сP и сV.
Зависимость тепловых эффектов от температуры. Закон Кирхгофа.
Тепловые эффекты растворения и разведения.
Приборы и реактивы
Учебно – лабораторный комплекс «Химия» в комплектации:
– центральный контроллер;
– модуль «Термостат» в комплекте со стаканчиком (на 150 см3), мешалкой и датчиком температуры.
Навеска соли с известной теплотой растворения (KCl или NH4Cl).
Навеска исследуемой соли.
Графический метод определения действительного изменения
температуры в калориметрических опытах
Для определения тепловых эффектов различных физико-химических процессов, а также для определения теплоемкостей используется калориметр. Важнейшими частями калориметра являются: калориметрический сосуд, емкость с калориметрической жидкостью (часто используется вода), в которой растворяется исследуемое вещество и защитная оболочка, уменьшающая тепловое взаимодействие калориметра с окружающей средой. В крышке калориметра имеются отверстия, куда вставляются пробирка с исследуемым веществом и датчик температуры. Совокупность частей калориметра, между которыми распределяется тепло процесса, называется калориметрической системой.
Общим и обязательным для всех работ по термохимии является определение действительного изменения температуры в ходе калориметрического опыта. Наиболее простым и надежным методом определения ∆Т является графический метод.
Графический метод предполагает фиксирование температуры калориметрической жидкости в стакане, помещенном в калориметр, до тех пор, пока изменение температуры не станет одинаковым и незначительным или изменение температуры не будет наблюдаться (не более 5 минут). Затем начинают термохимический опыт (например, растворение соли), не прерывая записи температуры. Это так называемый главный период. По окончании главного периода, когда изменение температуры снова станет равномерным, продолжают записывать температуру еще 5 минут, после чего завершают опыт. Перемешивание жидкости мешалкой способствует быстрому достижению теплового равновесия в калориметре.
По экспериментальным данным строится график в координатах температура – время (рис.1). Время, относящееся к участку АВ, называется «предварительным периодом», ВС – «главным периодом», СD – «конечным». Чтобы определить действительное изменение температуры ∆Т, проводят линии через точки, фиксирующие равномерное изменение температуры начального и конечного периодов АВ и СD. За начало главного периода принимают момент начала растворения соли, после которого начинается резкое изменение температуры, а за конец главного периода – точку, которая первой ложится на прямую СD. Точки В и С проектируют на ось ординат, находят середину отрезка nm и проводят линию kp. Через точку g проводят вертикаль. Экстраполируют линейные участки АВ и СD до пересечения с вертикалью в точках E и F. Отрезок EF соответствует изменению температуры ∆Т в калориметрическом опыте с учетом поправки на теплообмен.
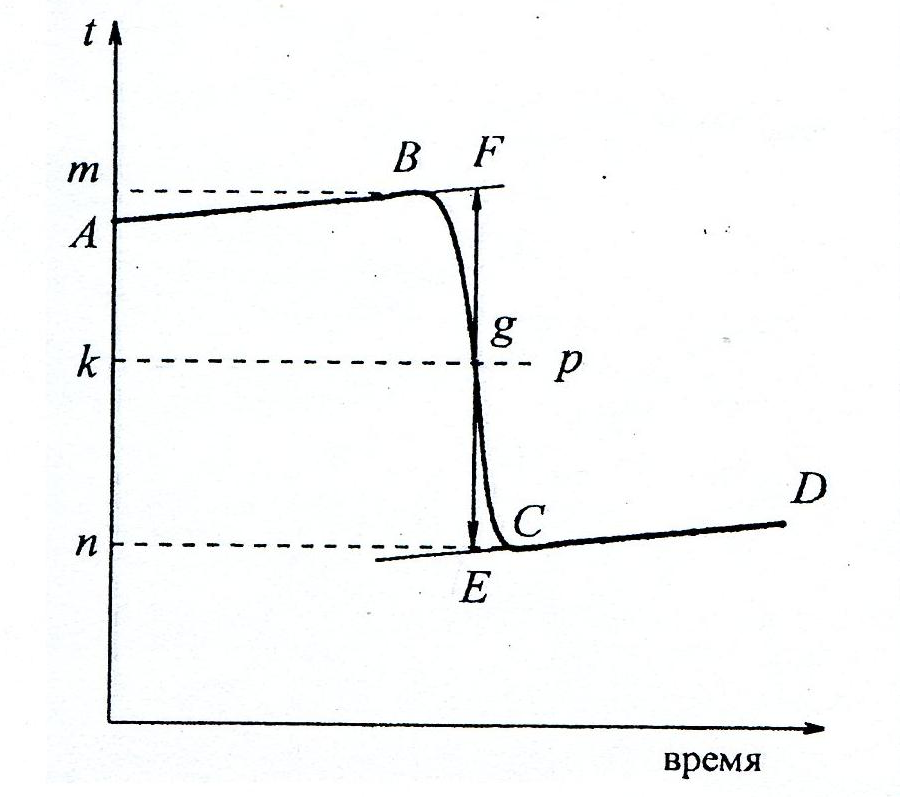
Рис. 1. График для определения действительного
изменения температуры
Методика выполнения работы и ее обоснование
Взаимодействие растворителя с растворяемым веществом при P = const сопровождается изменением энтальпии:
![]() ,
(1.1)
,
(1.1)
где
![]() и
и
![]() –
энтальпии одного моля растворителя и
растворяемого
–
энтальпии одного моля растворителя и
растворяемого
вещества в чистом состоянии;
Н – полная энтальпия образовавшегося раствора;
n1 и n2 – количества молей растворителя и растворенного вещества в
растворе.
Полное изменение энтальпии при растворении n2 молей вещества в n1 молях растворителя, отнесенное к одному молю растворенного вещества, называется интегральной теплотой растворения ∆Hm.
![]() .
(1.2)
.
(1.2)
Индекс m – это численное значение моляльной концентрации раствора.
Для твердых тел интегральная теплота растворения складывается из тепловых эффектов разрушения кристаллической решетки, сольватации и смешения.
В связи с тем, что на разрушение кристаллической решетки теплота затрачивается, а процесс сольватации сопровождается выделением теплоты, знак теплоты растворения может оказаться как положительным, так и отрицательным, в зависимости от того, какое из двух слагаемых больше по абсолютной величине. Величина теплоты смешения значительно меньше теплоты разрушения решетки и теплоты сольватации.
Большой интерес представляет теплота, выделяющаяся или поглощающаяся при растворении одного моля вещества в бесконечно большом количестве растворителя. Она определяется расчетным путем. Интегральные теплоты растворения находятся экспериментально.
При проведении опыта в калориметрической установке расчет теплоты растворения проводят с помощью уравнения теплового баланса:
![]() ,
(1.3)
,
(1.3)
где mi и ci – масса и теплоемкость составных частей калориметра,
или
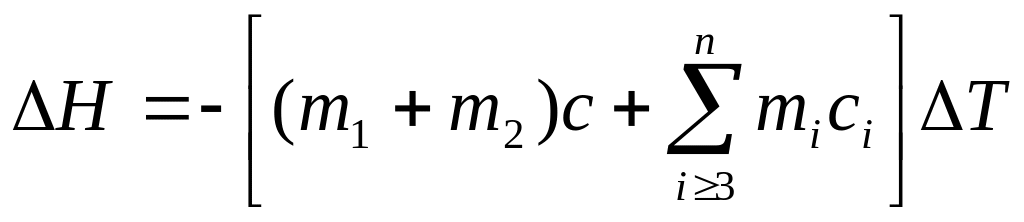 ,
(1.4)
,
(1.4)
где m1 и m2 – масса соли и воды соответственно, г;
с – теплоемкость образующегося раствора, Дж∙г–1∙К–1.
Теплоемкости разбавленных растворов неорганических солей в воде практически одинаковы и незначительно отличаются от теплоемкости воды cP = 4,18 Дж∙г–1∙К–1. Поэтому теплоемкость раствора с достаточной точностью можно принять равной теплоемкости воды.
Точно
определить теплоемкость составных
частей калориметра не представляется
возможным. Поэтому
![]() обозначают
символом K,
называемым постоянной калориметра
и определяют его значение по изменению
температуры при растворении определенного
количества соли с известной теплотой
растворения. Постоянная калориметра
K
– количество тепла, которое необходимо
подвести к калориметрической системе,
за исключением раствора, чтобы поднять
его температуру на 1 °С.
обозначают
символом K,
называемым постоянной калориметра
и определяют его значение по изменению
температуры при растворении определенного
количества соли с известной теплотой
растворения. Постоянная калориметра
K
– количество тепла, которое необходимо
подвести к калориметрической системе,
за исключением раствора, чтобы поднять
его температуру на 1 °С.
Уравнение теплового баланса запишется тогда:
![]() .
(1.5)
.
(1.5)
Отсюда
![]() ,
(1.6)
,
(1.6)
где ∆H = ∆Hm ∙ n2 –теплота растворения соли, Дж.
В качестве соли с известной интегральной теплотой растворения можно использовать KCl или NH4Cl. Интегральные теплоты растворения солей даны в приложении 1.
Так как при растворении неорганических солей, в случае образования разбавленного раствора, теплоемкость практически не изменяется, то теплота растворения будет мало зависеть от температуры.
Теплота растворения соли зависит от концентрации образующегося раствора. Поэтому необходимо рассчитать концентрацию раствора, образующегося при растворении соли с известной теплотой растворения и, в соответствии с этим, интерполяцией определить теплоту растворения этой соли для данной концентрации, а затем рассчитать постоянную калориметра.
Зная постоянную калориметра легко рассчитать теплоту растворения неизвестной соли. Для этого определяют изменение температуры при растворении неизвестной соли и рассчитывают ∆H по формуле 1.5, а также рассчитывают удельную теплоту растворения неизвестной соли q по формуле:
q = ∆H / m2.
Значение удельной теплоты растворения соли можно использовать (наряду с другими данными) для определения соли. Для этого сравнивают, полученное значение, со справочными значениями удельных теплот растворения различных солей.
Порядок выполнения работы
Подключают термостат к контроллеру, подключают термодатчик, включают перемешивание.
Определяют постоянную калориметра. Для этого стакан, в который налито 70 – 100 см3 дистиллированной воды (по заданию преподавателя), устанавливают в калориметр и закрывают крышкой с укрепленным в ней датчиком температуры. В отверстие крышки вставляют специальную пробирку, в которую предварительно насыпана навеска измельченной соли с известной теплотой растворения (KCl или NH4Cl). Проводят 10 отсчетов температуры «предварительного периода» через каждые 30 с. Затем растворяют соль и записывают еще 20 показаний термодатчика каждые 30 с. («главный период» и «конечный период»). Графическим методом определяют изменение температуры при растворении соли ∆Т и рассчитывают постоянную калориметра K по уравнению 1.6.
Определяют изменение температуры при растворении заданной навески исследуемой соли. Стакан споласкивают дистиллированной водой, вновь наливают в него 70 – 100 см3 дистиллированной воды (по заданию преподавателя) и устанавливают в калориметр. Затем проводят растворение навески соли аналогично п.2. Графическим методом определяют изменение температуры и рассчитывают интегральную теплоту растворения.
Сравнивают рассчитанную по результатам опыта интегральную теплоту растворения исследуемой соли со справочной (см. приложения 2,3).
Пример расчета теплоты растворения исследуемой соли
При определении постоянной калориметра в 500 см3 воды растворяли 5 г NH4Cl. Действительное изменение температуры, определенное графическим методом, составило –0.6 °С. При растворении 5 г исследуемой соли, действительное изменение температуры составило –0.68 °С. Температура воды 25 °С. По полученным данным проводят расчеты.
Определение постоянной калориметра
Определим моляльную концентрацию раствора, образующегося при растворении 5 г NH4Cl.
Молярная масса NH4Cl М = 53.5 г/моль. 5 г NH4Cl составляет 5/53.5 = 0,0935 молей. В 500 г воды растворили 0,0935 моль, а в 1000г будет растворено 0,187 моль. Следовательно, моляльность m = 0,187 моль/кг.
В приложении 3 для NH4Cl даны интегральные теплоты растворения: при m = 0,1 моль/кг ∆Hm = 15,1 кДж/моль
m = 0,2 моль/кг ∆Hm = 15,19 кДж/моль.
Методом интерполяции определяем интегральную теплоту растворения для m = 0.187 моль/кг. Увеличение ∆Hm при увеличении моляльности на 0,1 моль/кг составляет 15,19 – 15.1 = 0.09 кДж/моль. Для увеличения моляльности на 0.187 – 0.1 = 0.087 моль/кг увеличение ∆Hm составит 0,09 ∙ 0,087/0,1 = 0,0783 кДж/моль. Отсюда, интегральная теплота растворения NH4Cl, при образовании раствора с m = 0.187 моль/кг равна 15,1 + 0,0783 = 15,1873 кДж/моль = 15.1873 / 53.5 = 284 Дж/г.
При растворении 5 г NH4Cl поглотилось ∆H = 284 ∙ 5 = 1,42 кДж теплоты. Теплоемкость раствора приближенно равна 4,18 Дж ∙г–1∙К–1.
![]() Дж/°С.
Дж/°С.
Определение теплоты растворения исследуемой соли
Зная постоянную калориметра K и ∆T при растворении навески исследуемой соли, рассчитаем теплоту ее растворения:
∆H = –[(m1 + m2)c + K] ∆T = –[(500 + 5)4,18 + 255.76]∙(–0,68) = 1609,32 Дж. Удельная теплота растворения исследуемой соли равна
q = 1609,32 / 5 = 321,86 Дж/г.
Приложение 1
