
- •Глава 10
- •10.2. Белки и их структурные компоненты
- •10.2.1. Общая характеристика
- •10.2.2. Уровни структурной организации белков
- •10.3.1. Общая характеристика
- •10.4.1. Общая характеристика
- •10.4.2. Нейтральные жиры (триацилглицерины) и жирные кислоты
- •10.44. Гликолипиды
- •10.5. Растворы высокомолекулярных соединений
- •10.5.1. Особенности растворения высокомолекулярных соединений
Глава 10
БИОПОЛИМЕРЫ И НИЗКОМОЛЕКУЛЯРНЫЕ БИОРЕГУЛЯТОРЫ
Углеводы
Общая характеристика
Углеводы (сахара) — обширный класс органических соединений, к которому относятся полиоксикарбонильные соединения и их производные (рис. 10.1).
Углеводы входят в состав всех живых организмов и выполняют ряд функций, важнейшие среди которых:
энергодативная (углеводы — главный вид «клеточного топлива»);
структурная (углеводы — обязательный компонент большинства внутриклеточных структур);
защитная (углеводы — компоненты иммуноглобулинов).
Углеводы рибоза и дезоксирибоза входят в состав нуклеиновых
кислот.
В растениях углеводы составляют до 80 % сухой массы, в животных организмах на их долю приходится не более 2 % сухой массы.
Рис.
10.1. Классификация углеводов
Группу соединений, относимых к углеводам, разделяют на простые углеводы — моносахариды и сложные углеводы — олигосахариды и полисахариды.
Моносахариды — гетерополифункциональные соединения, содержащие карбонильную и несколько гидроксильных групп. Моносахариды, или монозы, имеют молекулярную формулу Сn(Н2O)n которая и послужила основой для образования названия данного класса соединений «углерод + вода» (приведенная формула не удовлетворяет составу дезоксисахаров, содержащих меньше атомов кислорода, например дезоксирибоза C5H10O4).
По своей структуре монозы относятся к полигидроксиальдеги- дам, или альдозам, и полигидроксикетонам, или кетозам. В зависимости от числа атомов углерода монозы делят на триозы (три атома углерода), тетрозы (четыре атома), пентозы (пять атомов), гексозы (шесть атомов) и гептозы (семь атомов). В зависимости от строения карбонильной группы каждая из таких моноз обозначается как альдотриоза, альдогексоза, кетогексоза и т. п.
Все изомеры моносахаридов по аналогии с глицеральдегидом подразделяются на D- и L-формы (см. подразд. 8.3). Природные гексозы принадлежат соединениям D-ряда.
Природные моносахариды обладают оптической активностью — свойством вращать плоскость поляризованного света (см. рис. 8.3). Любой моносахарид с конкретными физическими свойствами характеризуется специфической величиной — удельным вращением [α]. При длительном стоянии растворов сахаров удельное вращение меняется. Углеводы могут существовать в открытой (альдегидной и кетонной) и закрытой (циклической, полуацетальной) формах. При образовании полуацеталей возникает новый асимметричный центр. В случае α-изомеров полуацетальный гидроксил расположен с той же стороны, что и гидроксил, определяющий принадлежность D- или L-ряду, в случае β-изомеров — с другой стороны. В водных растворах глюкоза находится главным образом в виде α- и β-глюкопираноз, в меньшей степени — в виде α- и β-глюкофураноз и в очень малой степени — в альдегидной форме.
Цикло-оксо-таутомерия моносахаридов
В твердом состоянии и в водном растворе моносахариды существуют преимущественно в виде циклических полуацеталей. Образование полуацеталей можно рассматривать как внутримолекулярную реакцию AN, в результате которой образуются наиболее устойчивые шестичленные циклы (пиранозные) и пятичленные циклы (фуранозные). Таким образом, в растворе устанавливается
т аутомерное
равновесие между открытой формой
(оксо-формой) и циклической формой
моносахарида, причем циклическая форма
значительно преобладает (более 99,9 % в
равновесной смеси):
аутомерное
равновесие между открытой формой
(оксо-формой) и циклической формой
моносахарида, причем циклическая форма
значительно преобладает (более 99,9 % в
равновесной смеси):
Для изображения на плоскости пространственной структуры соединений в открытой форме используют проекционные формулы Фишера. Для изображения на плоскости пространственной структуры циклических соединений используют проекционные формулы Хеуорса; при этом руководствуются следующими правилами:
цикл изображают плоским;
заместители, находящиеся в оксо-форме справа, изображают под плоскостью цикла, находящиеся слева — над плоскостью цикла;
•
П окажем
в качестве примера:
окажем
в качестве примера:
В циклической форме появляется дополнительный по сравнению с открытой формой асимметрический атом углерода (центр
хиральности) у атома С1 в альдозах или у атома С2 в кетозах, называемый аномерным атомом углерода и дополнительная группа —ОН, называемая полуацетальным гидроксилом (в формуле обозначена звездочкой *). Если конфигурация аномерного атома углерода совпадает с конфигурацией атома, определяющего принадлежность соединения стереохимическому ряду, его называют а-аномером, если не совпадает — β-аномером. Таким образом,α- и β-аномеры моноз можно рассматривать как изомеры положения полуацетального гидроксила. Переход аномерных форм αβ осуществляется только через открытую оксо-форму, т. е. α оксо- форма β. Аналогично устанавливается равновесие в растворе между пиранозными и фуранозными формами. Преобладание а- или p-аномера зависит от природы монозы, природы растворителя, концентрации и других внешних условий. Равновесие между всеми формами является, таким образом, динамическим. Так, если какой-либо аномер глюкозы растворить в воде, он постепенно превращается в другой аномер, пока не образуется равновесная смесь двух аномеров, в которой содержится также очень небольшое количество открытой формы. Этот переход сопровождается изменением удельного вращения раствора. Такое явление называется мутаротацией (аномеризацией) моносахаридов. Равновесная смесь, образующаяся в результате мутаротации как α-, так и p-D-глюкопираноз, содержит 36 % а-изомера и 64 % р-формы. Доля оксо-формы в равновесной смеси очень невелика (при pH 6,9 равновесная смесь D-глюкозы содержит очень малую часть альдегидной формы). Поэтому монозы не дают характерного для альдегидов окрашивания в реакции с фуксиносернистой кислотой и не реагируют с гидросульфитом натрия. Мутаротация катализируется кислотами и основаниями. В твердом состоянии монозы находятся исключительно в циклической форме.
Химические свойства моносахаридов
В химическом отношении монозы сочетают свойства многоатомных спиртов, карбонильных соединений и полуацеталей. Наиболее химически активна полуацетальная гидроксильная группа.
Реакции с участием полуацетального гидроксила. Такие реакции характерны для циклических форм моносахаридов. В результате реакций образуются гликозиды, представляющие собой продукты конденсации циклических форм моносахаридов со спиртами и аминами с образованием гликозидной связи. При действии на моносахарид спирта, фенола или карбоновой кислоты атом водорода полуацетального гидроксила замещается на радикал с образованием О-гликозида. Выделяют также N-гликозиды, у которых гликозидная часть молекулы связана через атом азота с радикалом органического соединения, и S-гликозиды, представляющие собой производные циклических форм тиосахаров, у которых атом водорода меркаптогруппы (SH —) замещен радикалом.
Образование О-гликозидов. Моносахариды взаимодействуют со спиртами с образованием О-гликозидов. Например, при пропускании через раствор β-D-глюкозы в этаноле газообразного хло- роводорода происходит образование смеси α- и β-аномеров — этил-α,β-D-глюкопиранозы:
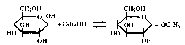
Молекула этанола выступает в данной реакции в роли нуклеофила.
Образование N-гликозидов. Монозы взаимодействуют с аминами и их производными с образованием N-гликозидов:
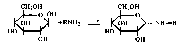
Гликозиды легко подвергаются гидролизу в кислой среде. По типу О-гликозидов образуются ди- и полисахариды, по типу N-гликозидов — нуклеозиды — структурные компоненты нуклеиновых кислот. Гликозиды играют чрезвычайно важную роль в биохимических процессах, в частности в процессах дыхания и фотосинтеза. Важнейший среди них — аденозинтрифосфат (АТФ) — сложный эфир фосфорной кислоты и аденозина — нуклеозида, являющегося продуктом конденсации аденина с рибозой. Фосфатные группы в АТФ выполняют роль своеобразного энергетического депо; при их гидролизе выделяется энергия, необходимая клеткам для мышечного сокращения. Гликозиды входят в состав многих лекарственных растений (например, сердечные гликозиды, выделенные из наперстянки, ландыша и др.), к гликозидам относятся антибиотики — аминогликозиды.
Реакции по спиртовым гидроксильным группам. Эти реакции могут протекать как для открытой, так и для циклической формы.
При взаимодействии с металлами и их гидроксидами образуются сахараты, с минеральными и органическими кислотами — сложные эфиры, с аммиаком — аминосахара.
Аминосахара входят в состав животных, растительных и бактериальных мукополисахаридов и являются углеводными компонентами гликопротеинов и гликолипидов.
При взаимодействии с кислотами и их ангидридами монозы образуют сложные эфиры. Так, при взаимодействии глюкозы с уксусным ангидридом образуется пентаацетилглюкоза. Биологически важный пример реакции данного типа — реакция фосфорилирования глюкозы — ферментативное взаимодействие глюкозы с аденозинтрифосфорной кислотой (АТФ) с образованием глю- козо-6-фосфата:

Реакция происходит на первой стадии гликолиза (процесса окисления глюкозы в пируват). Необходимо заметить, что все промежуточные продукты гликолиза представляют собой сложные эфиры моноз и фосфорной кислоты. В виде фосфорных эфиров рибоза и дезоксирибоза входят в состав нуклеиновых кислот.
Реакции с участием карбонильной группы. Данные реакции наиболее характерны для открытых форм углеводов.
Окисление моноз в кислой и нейтральной средах приводит к образованию различных кислот. Окислению может подвергаться только карбонильная группа («мягкое» окисление, например бромной водой). Окисление в мягких условиях приводит к образованию альдоновых кислот:
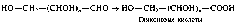
Окисляться
могут одновременно и карбонильная, и
первичная гидроксильная группы
(«жесткое» окисление, например раствором
HN03),
что приводит к
образованию гликаровых
кислот:

Наконец, при защите альдегидной группы может окисляться только первичная гидроксильная группа в мягких условиях, в этом случае образуются уроновые кислоты.
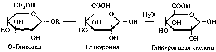
Глюконовая кислота подвергается внутримолекулярной циклизации с образованием лактонов:

В организме моносахариды под действием ферментов окисляются до уроновых кислот.
Гликурониды при нагревании легко декарбоксилируются, что приводит к образованию моноз с меньшим числом атомов углерода. Так, можно получить из D-гликуронида пентозу — D-кси- лозу.
Окисление моноз в щелочной среде сопровождается деструкцией углеродного скелета. Реакции окисления характерны не только для альдоз, но и для кетоз (в отличие от кетонов), что объясняется явлением эпимеризации моноз (см. далее). Окислению могут подвергаться и некоторые дисахариды, называемые восстанавливающими. Существуя преимущественно в форме полуацеталей, они обладают потенциально свободной альдегидной группой (в оксо-форме).
Восстанавливающие моно- и дисахариды восстанавливают ионы меди(И), содержащиеся в тартратном комплексе — реактиве Фе- линга [Cu(tart)2]2' или в цитратном комплексе — реактиве Бенедикта [Cu(cit)]~ до оксида меди(1) Сu2o, а также ионы серебра(1) в реактиве Толленса [Ag(NH3)2]OH до свободного серебра. Реакции используют как качественные на наличие восстанавливающих сахаров.
Моносахариды подвергаются химическому либо биологическому восстановлению. Восстановление моносахаридов идет путем их гидрирования по связи С=O карбонильной группы. Восстановление моноз, как и всяких карбонильных соединений, приво-
дит
к превращению карбонильных групп в
спиртовые; при этом образуются
многоатомные спирты, называемые
сахарными спиртами, или альдитами:
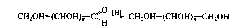
Помимо амальгамы натрия в водной (или водно-спиртовой, или спиртовой) среде для восстановления моноз используют водород в присутствии катализаторов (Pt, Pd, Ni) и гидриды металлов (особенно NaBH4). Следует иметь в виду, что при восстановлении альдоз образуется один спирт, а при восстановлении кетоз получаются два стереоизомерных полиола:

При восстановлении D-ксилозы образуется D-ксилит:
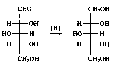
Реакции изомеризации (эпимеризации). Такие реакции происходят по α-СН*-кислотному центру моносахаридов, которым является атом углерода, непосредственно связанный с карбонильной группой. Реакция протекает под действием разбавленных растворов щелочей или ферментативно (в условиях организма) и сопровождается внутримолекулярным окислением-восстановлением (диспропорционированием) атомов углерода С1 и С2. В ходе этой перегруппировки вследствие переноса протона, осуществляющегося под влиянием гидроксильного иона, возникает промежуточное соединение — ендиол. Превращения ендиола могут привести к образованию кетозы или двух альдоз. Таким образом, в результате реакции постепенно образуется равновесная смесь
изомеров. Так, в результате эпимеризации D-глюкозы образуется D-манноза — эпимер глюкозы по С2 (I) и D-фруктоза — структурный изомер глюкозы (II):

Пример реакции изомеризации в организме — ферментативное превращение глюкозо-6-фосфата в фруктозо-6-фосфат в процессе гликолиза.
Олигосахариды и полисахариды
Олигосахариды — углеводы, молекулы которых содержат от двух до десяти остатков моносахаридов, соединенных гликозид- ными связями. В зависимости от числа моносахаридных остатков в полисахариде различают дисахариды, трисахариды, тетрасахариды и т.д.
Дисахариды (биозы) представляют собой продукт конденсации двух молекул моносахаридов, соединенных О-гликозидной связью. Наряду с полисахаридами дисахариды — один из основных источников углеводов в пище человека и животных. По своему строению дисахариды являются гликозидами, в которых две молекулы моносахаридов соединены гликозидной связью. Обязательный компонент дисахаридов — α-D-глюкоза. Например, структурную формулу мальтозы, которая является основным продуктом расщепления крахмала или гликогена в полости рта под действием фермента слюны — β-амилазы, можно представить следующим образом:
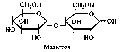
Систематическое название 4-(α-D-глюкопиранозидо)-D-глю- копираноза указывает на наличие гликозидной связи между имеющим а-конфигурацию атомом С| одного остатка глюкозы и атомом С4 другого остатка. Мальтоза образуется в результате конденсации двух молекул α-D-глюкопиранозы с образованием гликозидной связи между атомом С1 α-аномера глюкозы и атомом С4 второй молекулы глюкозы. Такая связь называется α(1 -» 4)-свя- зью.
Дисахариды, как любые гликозиды, способны к гидролитическому расщеплению в кислой среде. Наиболее биологически важными дисахаридами являются сахароза, мальтоза, лактоза и цел- лобиоза.
Сахароза (α-D-глюкопиранозидо-β-D-фруктофуранозид, α-D- глюкопиранозил-(1 -» 2)-р-фруктофуранозид) — один из самых распространенных дисахаридов; представляет собой пищевой са- хар:

Целлобиоза (4-(β-D-глюкопиранозидо)-D-глюкопираноза) представляет собой основной структурный элемент целлюлозы; образуется при ее ферментативном гидролизе:

Целлобиоза, как и лактоза, имеет 1,4-β-гликозидную связь и является восстанавливающим дисахаридом, но в отличие от лактозы при полном гидролизе дает только D-глюкозу.
Лактоза (β-D-галактопиранозил-(1 -> 4)-β-D-глюкопирано- за) содержится только в молоке; состоит из D-галактозы и D- глюкозы:
М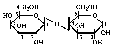 альтоза,
лактоза и целлобиоза относятся к
восстанавливающим дисахаридам, поскольку
у них имеется свободный полуацеталь-
ный гидроксил. Наряду с моносахаридами
они способны вступать в качественную
реакцию — реакцию Толленса. Сахароза
не обладает восстанавливающими
свойствами, поскольку при ее образовании
оба моносахарида участвуют своими
полуацетальными гидроксилами и
оксо-форма (открытая) не образуется. При
гидролизе сахарозы образуется
фруктоза, дающая качественную реакцию
— реакцию Селиванова:
альтоза,
лактоза и целлобиоза относятся к
восстанавливающим дисахаридам, поскольку
у них имеется свободный полуацеталь-
ный гидроксил. Наряду с моносахаридами
они способны вступать в качественную
реакцию — реакцию Толленса. Сахароза
не обладает восстанавливающими
свойствами, поскольку при ее образовании
оба моносахарида участвуют своими
полуацетальными гидроксилами и
оксо-форма (открытая) не образуется. При
гидролизе сахарозы образуется
фруктоза, дающая качественную реакцию
— реакцию Селиванова:

При гидролизе сахарозы происходит изменение угла вращения поляризованного света. Сахароза — правовращающий дисахарид (+66,5°), при гидролизе образуются фруктоза (-92°) и глюкоза (+ 52,5°). Разница между углом вращения поляризованного света сахарозы и ее гидролизата составляет 0°. Это явление называют инверсией сахара, а смесь глюкозы и фруктозы — инвертным сахаром. Природные инвертные сахара содержатся в мёде. Сладость сахарозы принята за 1,0, тогда фруктоза имеет сладость 1,73, глюкоза — 0,74, сорбит — 0,6, маннит — 0,4. Наиболее известный природный трисахарид— рафиноза, состоящая из остатков фруктозы, глюкозы и галактозы. Рафиноза в большом количестве содержится в сахарной свекле. Олигосахариды растительных тканей более разнообразны по своему составу, чем олигосахариды животных тканей.
Полисахариды — высокомолекулярные углеводы, состоящие из большого числа моносахаридных остатков, соединенных гли- козидными связями и образующими линейные или разветвленные молекулы. Моносахариды, входящие в их состав, находятся в пиранозной или фуранозной форме и соединяются друг с другом через любые гидроксильные группы. Различают линейные и разветвленные полисахариды, гомополисахариды (состоят из моносахаридов одного типа) и гетерополисахариды (состоят из моносахаридов двух и более типов).
321
Среди гомополисахаридов наиболее биологически важными являются поли-D-глюкопиранозы: амилоза, амилопектин, гликоген (дисахаридный фрагмент — мальтоза) и целлюлоза (структурный компонент — дисахарид целлобиоза). Гомополисахариды разделяют на структурные и резервные.
Крахмал — резервный материал растений; представляет собой смесь двух гомополисахаридов — линейного (амилозы) и разветвленного (амилопектина). Молекулярная масса крахмала равна 105— 107, при его частичном гидролизе образуются полисахариды с меньшей молекулярной массой — декстрины, а при полном гидролизе — глюкоза. Мономерами являются остатки D-глюкозы, соединенные в линейных цепях α-(1—» 4)-связями, а в точках ветвления — α-(1-» 6)-связями.
Амилоза — полимер неразветвленного строения (линейный полимер) молекулярной массой около 60 000; при нагревании растворяется в воде, образуя лиофильный коллоидный раствор; взаимодействует с иодом с образованием комплексного соединения включения синего цвета. Анализ методом светорассеяния и ультрацентрифугирования показал, что длина цепи молекулы амилозы часто достигает 6 000 моносахаридных звеньев:

При ферментативном гидролизе р-амилазой, которая выделяется поджелудочной железой и содержится в слюне, амилоза расщепляется на глюкозу и мальтозу; гидролиз начинается с невосстанавливающего конца амилозы и осуществляется последовательным отщеплением молекул мальтозы.
Амилопектин имеет разветвленную структуру и включает наряду с α-(1 -> 4)-связями и гликозидные α-(1 -» 6)-связи. За счет последних и образуются разветвления в структуре:

Молекула амилозы содержит в среднем около 1 000 остатков глюкозы. Отдельные участки молекулы амилопектина состоят из 20—30 звеньев. Амилоза и амилопектин не дают истинного водного раствора, а образуют связаннодисперсную систему — гель. При добавлении иода амилоза окрашивается в синий цвет, амилопектин — в красно-фиолетовый.
Смесь амилозы (-20—25 %) и амилопектина (-75 — 80 %) представляет собой полисахарид природного происхождения — крахмал.
Таким образом, природный крахмал не является индивидуальным веществом: он состоит их двух фракций, отличающихся по строению, и вследствие этого обладающих различной растворимостью в теплой воде.
Гликоген («животный крахмал») по структуре и свойствам похож на амилопектин, но имеет еще более разветвленную полимерную цепь и является резервным полисахаридом животных, запасаемым в печени и мускульной ткани. Гликоген — «двойник» крахмала в животном мире и играет роль депо питательных веществ и запасного углевода животных тканей. Молекула его состоит из ветвящихся полигликозидных цепей, соединенных а-(1 - 4)-связями, а в точках ветвления — а-(1 —> 6)-связями. Молекулярная масса гликогена составляет 105—108. При гидролизе он. расщепляется с образованием декстранов, затем мальтозы и, наконец, глюкозы.
Хитин — основной структурный компонент беспозвоночных животных (в основном членистоногих), полностью замещает целлюлозу в клеточных стенках сапрофитных растений. Мономерами его являются остатки N-ацетил-О-глюкозамина, соединенные β-(1 -> 4)-гликозидными связями:

Целлюлоза (клетчатка) — один из важнейших полисахаридов. Она образует главную составную часть стенок растительных клеток.
Целлюлоза представляет собой полимер, полностью состоящий из звеньев β-D-глюкопиранозы, которые связаны β-(1 —> 4)-гли- козидными связями. Целлюлоза — линейный полимер, цепи которой могут содержать более 10 тысяч звеньев:

Молекулярная масса целлюлозы составляет порядка 106. При ее частичном гидролизе образуется дисахарид целлобиоза, а при полном — глюкоза. Клетчатка не переваривается ферментами пищеварительного тракта человека, однако присутствие оптимальных ее количеств (2 — 3%) в пище способствует формированию кала. Целлюлоза — основной источник глюкозы у травоядных животных, в кишечнике которых присутствуют микроорганизмы, расщепляющие Р-гликозидные связи.
Чистая целлюлоза — белое волокнистое вещество, нерастворимое в воде, эфире или спирте. Такая устойчивость по отношению к растворителям объясняется уникальной структурой целлолозы. Высокоупорядоченная структура, подтвержденная данными рентгеноструктурного анализа, обусловливает необычайную прочность и упругость целлюлозы, равно как и отсутствие растворимости в большинстве применяемых растворителей. Целлюлоза растворяется в реактиве, приготовленном смешиванием Си(ОН)2 с концентрированным водным раствором аммиака (реактиве Швейцера), а также в подкисленном растворе ZnCl2 при нагревании или в концентрированной серной кислоте, т. е. в тех средах, в которых возможен разрыв водородных связей в молекулах целлюлозы и образование новых связей с растворителем. Благодаря наличию свободных спиртовых гидроксильных групп целлюлоза способна реагировать со спиртами и кислотами с образованием эфиров. Целлюлоза выполняет функции структурного полисахарида, использующегося организмом для построения остова клеточной ткани.
Переваривание и всасывание углеводов
Расщепление крахмала и гликогена начинается в ротовой полости под действием амилазы слюны. Амилаза слюны является а-амилазой, под ее влиянием осуществляются первые фазы расщепления крахмала или гликогена с образованием декстринов и небольшого количества мальтозы. Затем пища, смешанная со слюной, проглатывается и перемещается в желудок, где действие амилазы прекращается из-за кислой среды содержимого желудка (pH 1,5 —2,5). Однако в глубоких слоях пищевого комка, где среда не такая кислая, действие амилазы некоторое время продолжа
ется, что обеспечивает расщепление полисахаридов с образованием декстринов и мальтозы. Наиболее важная фаза распада крахмала и гликогена происходит в двенадцатиперстной кишке под действием амилазы поджелудочного сока, где среда близка к нейтральной, что обеспечивает максимальную активность амилазы. Фермент завершает превращение крахмала и гликогена в мальтозу, начатое амилазой слюны (а-амилаза расщепляет а-(1 -» 4)- связи). Имеющиеся в молекулах амилопектина гликозидные а-(1 -» 6)-связи гидролизуются в кишечнике другими ферментами: амило-1,6-гликозидазой и олиго-1,6-гликозидазой. Образующаяся мальтоза быстро гидролизуется под влиянием фермента мальтазы на две молекулы глюкозы. Кишечный сок также содержит активную сахарозу, под влиянием которой из сахарозы образуются глюкоза и фруктоза.
Лактоза под действием фермента кишечного сока лактазы расщепляется на глюкозу и галактозу.
В конечном итоге углеводы пищи распадаются на составляющие их моносахариды (преимущественно глюкозу, фруктозу, галактозу), которые всасываются кишечной стенкой и попадают в кровь. Скорость всасывания отдельных моносахаридов различна. Глюкоза и галактоза всасываются быстрее. Всасывание большинства моносахаридов происходит за счет активного транспорта. Для всасывания простых углеводов необходимо присутствие ионов Na+, которые активируют АТФазу, благодаря чему ускоряется распад АТФ. Всасывание обеспечивается энергией АТФ.
Более 90 % всосавшихся моносахаридов через капилляры кишечных ворсинок попадает в кровеносную систему и с током крови через воротную вену в печень; остальное количество моносахаридов поступает по лимфатическим путям в венозную систему. В печени всосавшаяся глюкоза превращается в гликоген, используемый для поддержания физиологической концентрации глюкозы в крови.
Метаболизм глюкозы начинается с ее фосфорилирования при участии АТФ и фермента гексокиназы, далее глюкозо-6-фосфат под влиянием фермента фосфоглюкомутазы переходит в глюкозо-1-фосфат. Глюкозо-6-фосфат не способен проходить через клеточную мембрану, т. е. фосфорилирование глюкозы обеспечивает ее сохранение (депонирование) в клетке.
