
- •1 Глоссарий
- •Штерн тәжірибесі
- •Интегралдың нолге тең болуы кейбір функцияның толық дифференциал екенін қөрсетеді. Яғни сол функция тек жүйенің күйімен ғана анықталадыда жүйе сол күйге келген жолға тәуелсіз болады.
- •Термодинамиканың үшінші бастамасы (Нернст теоремасы):
- •Интегралдың нолге тең болуы кейбір функцияның толық дифференциал екенін қөрсетеді. Яғни сол функция тек жүйенің күйімен ғана анықталадыда жүйе сол күйге келген жолға тәуелсіз болады.
- •Тасымалдау құбылыстарының жалпы теңдеуі
- •2. Молекулалардың өзара тартылуын ескеру
- •Эндрюс тәжірибесі
- •3. Машықтану сабақтарын жүргізуге арналған әдістемелік нұсқаулар
- •4. Зертханалық сабақтарЫн жүргізуге арналған әдістемелік нұсқаулар
- •Студенттің өздік жұмысы
2. Молекулалардың өзара тартылуын ескеру
Менделеев-Клапейрон
теңдеуіндегі ыдыс қабырғаларының газға
келтірілген
қысымы сыртқы қысым болып табылады.
Нақты газ молекулаларының өзара тартылу
күштерінің әсері газдың қосымша сығылуына
әкеледі, яғни қосымша
 ішкі қысымды туғызады. Сондықтан реал
газдың шын мәніндегі қысымы
–дан
жоғары және
ішкі қысымды туғызады. Сондықтан реал
газдың шын мәніндегі қысымы
–дан
жоғары және
 –ға
тең. Сонда
–ға
тең. Сонда
 (14.2)
(14.2)
~ ,
ал газдың
тығыздығы
көлемге кері пропорционал, сондықтан
,
ал газдың
тығыздығы
көлемге кері пропорционал, сондықтан

Олай болса бір моль газ үшін Ван-дер-Ваальс теңдеуі:
 .
.
Газдың кез келген массасы үшін Ван-дер-Ваальс теңдеуі:
 .
(14.3)
.
(14.3)
Теңдеудегі және - әр газ үшін тұрақты шамалар. Оларды тәжірибе жүзінде анықтауға болады.
В ан-дер-Ваальс
изотермалары.
ан-дер-Ваальс
изотермалары.
Ван-дер-Ваальс
теңдеуін
–ға қатысты жазайықта оның
 -координатадағы
графиктерін әр түрлі температура үшін
тұрғызайық. (14.1-сурет)
-координатадағы
графиктерін әр түрлі температура үшін
тұрғызайық. (14.1-сурет)

14.1-сурет
Эндрюс тәжірибесі
В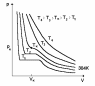 ан-дер-Ваальс
изотермалары тәртібінің физикалық
мағынасын анықтау үшін ағылшын химигі
Эндрюстің 1869ж. қойған тәжірибесінің
нәтижелерін пайдаланған жөн. Эндрюс
көмірқышқыл газдың изотермаларын
зерттеген.
ан-дер-Ваальс
изотермалары тәртібінің физикалық
мағынасын анықтау үшін ағылшын химигі
Эндрюстің 1869ж. қойған тәжірибесінің
нәтижелерін пайдаланған жөн. Эндрюс
көмірқышқыл газдың изотермаларын
зерттеген.
Тәжірибелік изотермалардың 14.2-сурет
горизонталь аймақтары тұрақты қысымда өтетін газдың сұйық күйге
14.2-сурет айналу кезеңіне сәйкес келеді. Басқаша айтқанда, осы аймақта екі фаза - сұйық және газ - бірдей тіршілік етеді.
Өз сұйығымен динамикалық тепе-теңдікте болатын бу қаныққан бу деп аталады.
Қысымның сол жағдайдағы мәні қаныққан бу қысымы деп аталады.
Қаныққан бу қысымы көлемге тәуелсіз. Қаныққан бу қысымының температураға тәуелділігі төмендегі 14.3-суретте көрсетілген

14.3-сурет
Ауадағы су буының мөлшері ауаның ылғалдылығы деп аталады.
Ауаның абсолют ылғалдылығы дегеніміз ауа құрамындағы су буының парциал қысымы (Па).
Берілген
температурада ауа құрамындағы су буының
 парциал қысымының, сол температурадағы
қаныққан будың
парциал қысымының, сол температурадағы
қаныққан будың
 қысымына, пайызбен өрнектеліп алынған
қатынасы, ауаның
салыстырмалы ылғалдылығы
деп аталады:
қысымына, пайызбен өрнектеліп алынған
қатынасы, ауаның
салыстырмалы ылғалдылығы
деп аталады:
 (14.4)
(14.4)
Кризистік параметрлер
Берілген
газ үшін кейбір
 температурадан жоғары теапературадағы
газды сығу арқылы сұйыққа айналдыру
мүмкін емес. Сол
температураны кризистік
температурадеп
атайды. Сонда бу дегеніміз кризистік
температурадан төмен температурадағы
газ.
температурадан жоғары теапературадағы
газды сығу арқылы сұйыққа айналдыру
мүмкін емес. Сол
температураны кризистік
температурадеп
атайды. Сонда бу дегеніміз кризистік
температурадан төмен температурадағы
газ.
Кризистік температурадағы нақты газдың
изотермасындағы К бүгілу нүктесіне
сәйкес келетін көлеммен қысымды
 кризистік көлем және
кризистік көлем және
 кризистік қысым деп атайды.
кризистік қысым деп атайды.
Газдың кризистік параметрлері және түзетулерімен байланысқан:
 ,
,
 ,
,
 .
(14.5)
.
(14.5)
Нақты газдың ішкі энергиясы.Джоуль-Томсон эффектісі.Нақты
газ молекулаларының арасындағы өз ара әсерлердің нәтижесінде олардың өз ара потенциялық энергиясы Ерпайда болады да, бұл энергия газ молекулаларының Екқозғалыс кинетикалық энергиясымен қатар газдың ішкі энергиясының құрамына кіреді:
U =Ek + Ep.
Бізге газдың киломоліндегі молекулалардың кинетикалық энергиясы
Е k = CVТ,
яғни температура функциясы екені белгілі.
Молекулалардың өз ара потенциялық энергиясы, олардың бір-бірінен
орташа ара қашықтықтарына байланысты. Сондықтан Ергаз көлемінің функциясы болуға тиіс. Демек, нақты газдың ішкі энергиясы мына екі параметрдің функциясы екен: Т және V.
Газ ұлғайған кезде молекулалардың арасындағы тартылыс күштерді жеңуге кеткен жұмыс істелуге тиіс. Механикадан ішкі күштерде қарсы істелетін жұмыс системаның, потенциялық энергиясын арттыруға жұмсалатыны белгілі. Сыртқы күштерді жеңуге кеткен жұмыстың

өрнек арқылы анықталатыны сияқты киломоліндегі молекулалардың арасында әсер етуші ішкі күштерді жеңу жұмысын да
 түріндежазуымызғаболады,
түріндежазуымызғаболады,
мұндағырi-Ван-дер-Ваальстықгазжағдайында -ғатеңішкіқысым.
-ғатеңішкіқысым.
 -.нымолекулалардыңөзарапотенциялықэнергиясының
-.нымолекулалардыңөзарапотенциялықэнергиясының
dЕрөсімшесіне теңестіре отырып, мынаны аламыз;

Бұл өрнекті интегралдау потенциялық энергия үшін мынаны береді:

Интегралдау тұрақтысының мәнін Uішкі энергияға арналған өрнек шекті жағдайда, яғни көлем шексіздікке дейін ұлғайған жағдайда идеал газдың ішкі энергиясына арналған өрнекке айналатындай етіп алуымыз керек (көлемді ұлғайтқан кезде нақты газдардың бәрі өздерінің қасиеттері жөнінен идеал газға жуықтайтынын еске салайық). Осы пікірлерге сүйеніп, интегралдау тұрақтысын нольге тең деп алу керек. Сонда нақты газдың ішкі энергиясы үшін мынадай өрнек шығады:
 (1)
(1)
бұдан біз ішкі энергияның температураны арттырған жағдайда да, көлемді арттырған жағдайда да өсетінін көреміз.
Егер газ қоршаған ортамен жылу алмаспай-ақ және сыртқы жұмыс жасамай-ақ ұлғаятын, не сығылатын болса, онда оның іщкі энергиясы термодинамиканың бірінші бастамасына сәйкес тұрақты болып қалуға тиіс. Мұндай жағдайда энергиясы (1) ф.ормуласы бойынша анықталатын газ үшін мына шарт сақталуға тиіс:

бұдан
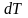 мен
мен
 таңбалары
қарама-қарсы екені шығады.
таңбалары
қарама-қарсы екені шығады.
Демек, бұл сияқты жағдайларда газ ұлғайған кезде әрқашан сууға тиіс, ал сығылса қызуға тиіс.Яғни Ван-дер-Ваальс теңдеуіне бағынатын газ.
Сыртқы
ортаменен энергияның алмасуы болмаса,
көлемі өзгергенде газдың ішкі энергиясының
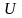 қоры
тұрақты болып қалады.
қоры
тұрақты болып қалады.
Олай болса

яғни, нақты газдың көлемі өзгергенде потенциалдық энергияның өзгерісі салдарынан молекулалар қозғалысының кинетикалық энергиясыда өзгереді.
 теңдігі
нақты газ үшінде орындалады, себебі
теңдігі
нақты газ үшінде орындалады, себебі
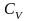 оның молекулалар қозғалысының кинетикалық
энергиясымен ғана анықталады.
оның молекулалар қозғалысының кинетикалық
энергиясымен ғана анықталады.
Сонда

Сыртқы денелермен жұмыс атқарылмаса және олармен жылу алмасуы болмаса, көлемі өзгергенде нақты газдың температурасыда өзгереді.
Тек нақты газдарда болатын бұл құбылысты Джоуль-Томсон эффектісі дейді. Егер ұлғаю кезінде газдың температурасы төмендесе, Джоуль-Томсон эффектісін оң дейді, ал егер газдың температурасы жоғарласа – теріс дейді.
Зер
салып қараса, Ван-дер-Ваальс тендеуі
мен Джоуль - Томсон
эффектісінің арасында байланыс бары
байқалады. Ван-дер-Ваальс
теңдеуіндегі «а»
және
«в»
тұрақтыларының ара қатынасына
байланысты газдың кызуы немесе сууы
мүмкін. Атап айтканда қысымға
енгізілген « »
- түзетуі, көлемге енгізілген «в»түзетуге
қарағанда еске алмайтындай өте аз
болатын болса, онда көлемі
ұлғайғанда газ қызады (Джоуль — Томсон
эффектісі теріс деп
аталады). Ал көлемге енгізілген түзету«в»)
қысымға
енгізілген
түзетуге «
»
қарағанда өте аз шама болса, онда көлемі
ұлғайғанда
газ суыйды (Джоуль — Томсон эффектісі
оң деп аталады).
»
- түзетуі, көлемге енгізілген «в»түзетуге
қарағанда еске алмайтындай өте аз
болатын болса, онда көлемі
ұлғайғанда газ қызады (Джоуль — Томсон
эффектісі теріс деп
аталады). Ал көлемге енгізілген түзету«в»)
қысымға
енгізілген
түзетуге «
»
қарағанда өте аз шама болса, онда көлемі
ұлғайғанда
газ суыйды (Джоуль — Томсон эффектісі
оң деп аталады).
Газдарды сұйыққа айналдыру үшін оң Джоуль - Томсон эффектісі негізінде жұмыс істейтін Линде машинасы пайдаланылады. Машина арқылы сұйық ауа алуға болады. Сұйық ауа биология мен химияда кеңінен пайдаланылады. Айталық, сұйық ауа көмегімен қатырылған қарапайым организмдер өзінің өмір сүргіштік қабілетін сақтап қалады. Мұнай, жер май (керосин) мен сұйық. ауаны бір-біріне араластырғанда оксиликвит деп аталатын жарылғыш зат алуға болады.
Джоуль-Томсон эффектісінің таңбасы және түзетулерінің қайсысы үлкенірек роль атқаратынына байланысты.
Екі жағдайды жеке алып қарастырайық:
1. Ван-дер-Ваальс теңдеуіндегі түзетуді елемеуге болады,
2. Ван-дер-Ваальс теңдеуіндегі түзетуді елемеуге болады.
Б ірінші
жағдайда тек тебілу күштері есепке
алынады. Сонда
ірінші
жағдайда тек тебілу күштері есепке
алынады. Сонда
 Олай
болса
Олай
болса

.
Екінші
жағдайда тек тартылу 1 4.4-сурет
4.4-сурет
күштері есепке алынады 14.4-сурет.
Сонда
Олай
болса

Температурамен қысымға байланысты берілген бір газ үшін немесе , немесе түзетуінің 14.5-сурет
ролі
үлкенірек болады. Қысыммен температураның
кейбір мәндерінде
және
түзетулерінің
рольдері бірдей болады. Бұл жағдайда
Джоуль-Томсон эффектісі нөлге тең. Нақты
газдың осы күйін инверсия
нүктесі
деп атайды. Инверсия нүктелерінің
жиынтығы инверсия қисығын түзейді. 14.6-сурет
14.6-сурет
Тақырып: Сұйықтар.Қатты заттар қасиеттері (2сағ)
Негізгі сұрақтар:
сұйық күйдің ерекшіліктері
беттік керілу
Лаплас теңдеуі
4. сұйық ерітінділер, идеал ерітінділер
Тақырып: Фазалық ауысулар (1 сағ)
Негізгі сұрақтары:
бірінші және екінші ретті фазалық ауысулар
Клапейрон-Клаузиус теңдеуі
үш фазалы жүйенің күй диаграммасы
үштік нүкте
