
- •Тема 1. Основные понятия и законы химии План занятия
- •Теоретическая часть
- •Примеры решения типовых задач
- •16 Г/моль
- •Задания для самостоятельной работы Индивидуальное задание «Основные понятия и законы химии» вариант №1
- •Индивидуальное задание «Основные понятия и законы химии» вариант №2
- •Индивидуальное задание «Основные понятия и законы химии» вариант №3
- •Индивидуальное задание «Основные понятия и законы химии» вариант №4
- •Индивидуальное задание «Основные понятия и законы химии» вариант №5
- •Индивидуальное задание «Основные понятия и законы химии» вариант №6
- •Индивидуальное задание «Основные понятия и законы химии» вариант №7
- •Индивидуальное задание «Основные понятия и законы химии» вариант №8
- •Индивидуальное задание «Основные понятия и законы химии» вариант №9
- •Индивидуальное задание «Основные понятия и законы химии» вариант №10
- •Индивидуальное задание «Основные понятия и законы химии» вариант №11
- •Индивидуальное задание «Основные понятия и законы химии» вариант №12
- •Индивидуальное задание «Основные понятия и законы химии» вариант №13
- •Индивидуальное задание «Основные понятия и законы химии» вариант №14
- •Индивидуальное задание «Основные понятия и законы химии» вариант №15
- •Индивидуальное задание «Основные понятия и законы химии» вариант №16
- •Индивидуальное задание «Основные понятия и законы химии» вариант №17
- •Индивидуальное задание «Основные понятия и законы химии» вариант №18
- •Индивидуальное задание «Основные понятия и законы химии» вариант №19
- •Индивидуальное задание «Основные понятия и законы химии» вариант №20
- •Индивидуальное задание «Основные понятия и законы химии» вариант №21
- •Индивидуальное задание «Основные понятия и законы химии» вариант №22
- •Индивидуальное задание «Основные понятия и законы химии» вариант №23
- •Индивидуальное задание «Основные понятия и законы химии» вариант №24
- •Индивидуальное задание «Основные понятия и законы химии» вариант №25
- •Индивидуальное задание «Основные понятия и законы химии» вариант №26
- •Индивидуальное задание «Основные понятия и законы химии» вариант №27
- •Индивидуальное задание «Основные понятия и законы химии» вариант №28
- •Индивидуальное задание «Основные понятия и законы химии» вариант №29
- •Индивидуальное задание «Основные понятия и законы химии» вариант №30
- •Контрольные вопросы
16 Г/моль
Ответ: = 16 г/моль.
Задача №5.
а) В раствор, в котором содержалась соляная кислота массой 4 г, опустили кусочек цинка массой 2 г. Определите, какая масса соли образовалась в результате реакции, и какой объем газа выделился в результате реакции (условия нормальные).
Алгоритм решения
1.Запишем уравнение реакции:
Zn+2HCl = ZnCl2 + H2
Т.к. даны массы обоих исходных реагентов (Zn и HCl), необходимо определить, какой из них находится в недостатке. Рассчитаем количество вещества цинка ν(Zn) и соляной кислоты ν(HCl) по формуле:
где - количество вещества, моль; – масса,г; – молярная масса, г/моль.
Молярная масса цинка М(Zn) = 65 г/моль; молярная масса М(HCl) = 36,5 г/моль.
ν(Zn)
=

ν(HCl)
=

Исходя из стехиометрических коэффициентов в уравнении реакции (1Zn: 2HCl), делаем вывод, что цинк и соляная кислота реагируют в соотношении 1:2. Т.е. 1 моль Zn полностью расходуется при реакции с 2 моль HCl. Составим пропорцию, чтобы определить, какое количество Zn необходимо для реакции с 0,11 моль HCl:
1 моль Zn – 2 моль HCl
x моль Zn – 0,11 моль HCl
Находим отсюда x:

Таким образом, на реакцию с 0,11 моль HCl необходимо 0,055 моль Zn. По условию задачи, нам дано 0,03 моль Zn. 0,03 моль < 0,055 моль, следовательно данного количества Zn недостаточно для реакции. Отсюда можно сделать вывод, что Zn находится в недостатке, а HCl - в избытке. Соответственно, дальнейшие расчеты необходимо делать по цинку, т.к. он расходуется полностью и определяет выход продукта. Согласно уравнению реакции, из 1 моль Zn образуется 1 моль ZnCl2. Составим пропорцию, чтобы определить какое количество вещества ZnCl2 образуется из 0,03 моль Zn.
1 моль Zn – 1 моль ZnCl2
0,03 моль Zn – x моль ZnCl2
Находим
отсюда x =
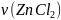 :
:
x
=
=

Итак, в результате реакции образуется 0,03 моль ZnCl2.
Массу соли можно вычислить, используя формулу:
где - количество вещества, моль; – масса,г; – молярная масса, г/моль.
Выразим отсюда массу:
m = ν·M
Молярная масса хлорида цинка М(ZnCl2) = 136 г/моль
m(ZnCl2) = 0,03 моль ·136 г/моль = 4,08 г
Определим объем газа, выделившегося в результате реакции V(H2).
Согласно уравнению реакции, из 1 моль Zn образуется 1 моль H2. Составим пропорцию, чтобы определить какое количество вещества H2 образуется из 0,03 моль Zn.
1 моль Zn – 1 моль H2
0,03 моль Zn – x моль H2
Находим
отсюда x =
 :
:
x = =
Таким
образом, в результате реакции образуется
0,03 моль
 .
.
При нормальных условиях 1 моль любого газа будет занимать объем = 22,4 л. Составим пропорцию:
1 моль H2 – 22, 44 л
0,03 моль H2 – х л
Отсюда находим х = V(H2):
х
= V(H2)
=

Можно также воспользоваться для расчета объема формулой:
где - количество вещества, моль; – объем газа, л; – молярный объем газа, равный 22,4 л/моль.
Выразим отсюда объем:
V
= 0,03 моль ·22,4 л/моль =

Ответ:
m = 4,08 г;
 .
.
б) Сплав меди с алюминием массой 1,2 г обработали раствором соляной кислоты. При этом выделилось 0,2 л водорода (условия нормальные). Определить процентное содержание алюминия в сплаве.
Алгоритм решения
Составим уравнение реакции, учитывая, что медь является малоактивным металлом, и не вытесняет водород из разбавленных кислот. Таким образом, водород будет выделяться только при реакции алюминия с кислотой:
2Al + 6HCl = 2AlCl3 + 3H2↑
Т.к. даны нормальные условия, можно вычислить количество вещества водорода по формуле:
где - количество вещества, моль; – объем газа, л; – молярный объем газа, равный 22,4 л/моль.
 моль
моль
Согласно уравнению реакции, из 2 моль Al образуется 3 моль H2. Составим пропорцию:
2 моль Al - 3 моль H2
x моль Al - 0,0089 моль H2
Отсюда находим х = (Al):
х
=
(Al)=
 = 0,0059 моль
= 0,0059 моль
Массу алюминия m(Al) можно найти исходя из формулы:
где - количество вещества, моль; – масса,г; – молярная масса, г/моль.
Выразим отсюда массу:

Молярная масса алюминия M(Al) = 27 г/моль. Рассчитаем массу алюминия, который вступил в реакцию:

Таким образом, масса алюминия в сплаве составила 0,159 г.
Рассчитаем процентное содержание алюминия ω% (Al) в сплаве. Учитывая, что общая масса сплава составляет 1,2 г, составим пропорцию:
1,2 г – 100%
0,159 г – х %
Отсюда находим х = ω%:
х
= ω% =
 =
13,25%
=
13,25%
Для расчета можно также воспользоваться формулой:

где
 - процентное содержание алюминия в
сплаве;
- процентное содержание алюминия в
сплаве;
 - масса алюминия в сплаве;
- масса алюминия в сплаве;
 - масса сплава.
- масса сплава.

Ответ: =13,25%.
