
- •Тема 1. Основные понятия и законы химии План занятия
- •Теоретическая часть
- •Примеры решения типовых задач
- •16 Г/моль
- •Задания для самостоятельной работы Индивидуальное задание «Основные понятия и законы химии» вариант №1
- •Индивидуальное задание «Основные понятия и законы химии» вариант №2
- •Индивидуальное задание «Основные понятия и законы химии» вариант №3
- •Индивидуальное задание «Основные понятия и законы химии» вариант №4
- •Индивидуальное задание «Основные понятия и законы химии» вариант №5
- •Индивидуальное задание «Основные понятия и законы химии» вариант №6
- •Индивидуальное задание «Основные понятия и законы химии» вариант №7
- •Индивидуальное задание «Основные понятия и законы химии» вариант №8
- •Индивидуальное задание «Основные понятия и законы химии» вариант №9
- •Индивидуальное задание «Основные понятия и законы химии» вариант №10
- •Индивидуальное задание «Основные понятия и законы химии» вариант №11
- •Индивидуальное задание «Основные понятия и законы химии» вариант №12
- •Индивидуальное задание «Основные понятия и законы химии» вариант №13
- •Индивидуальное задание «Основные понятия и законы химии» вариант №14
- •Индивидуальное задание «Основные понятия и законы химии» вариант №15
- •Индивидуальное задание «Основные понятия и законы химии» вариант №16
- •Индивидуальное задание «Основные понятия и законы химии» вариант №17
- •Индивидуальное задание «Основные понятия и законы химии» вариант №18
- •Индивидуальное задание «Основные понятия и законы химии» вариант №19
- •Индивидуальное задание «Основные понятия и законы химии» вариант №20
- •Индивидуальное задание «Основные понятия и законы химии» вариант №21
- •Индивидуальное задание «Основные понятия и законы химии» вариант №22
- •Индивидуальное задание «Основные понятия и законы химии» вариант №23
- •Индивидуальное задание «Основные понятия и законы химии» вариант №24
- •Индивидуальное задание «Основные понятия и законы химии» вариант №25
- •Индивидуальное задание «Основные понятия и законы химии» вариант №26
- •Индивидуальное задание «Основные понятия и законы химии» вариант №27
- •Индивидуальное задание «Основные понятия и законы химии» вариант №28
- •Индивидуальное задание «Основные понятия и законы химии» вариант №29
- •Индивидуальное задание «Основные понятия и законы химии» вариант №30
- •Контрольные вопросы
Тема 1. Основные понятия и законы химии План занятия
Предмет химии. Атомно-молекулярная теория. Основные понятия: атом, молекула, химический элемент, химическая формула, химическое уравнение, стехиометрические коэффициенты. Простые и сложные вещества. Аллотропия. Молекулярная масса. Моль. Молярная масса. Эквивалент. Эквивалентная масса. Закон эквивалентов. Закон постоянства состава химических соединений. Закон объемных отношений. Закон Авогадро. Молярный объем газа. Уравнение Менделеева-Клапейрона. Периодический закон. Теория химического строения Бутлерова.
Теоретическая часть
Атом – это наименьшая частица химического элемента, сохраняющая все его химические и физические свойства.
Химический элемент – это определенный вид атомов, характеризующихся одинаковым зарядом ядра.
Молекула – наименьшая частица индивидуального вещества, которая обладает его химическими и физическими свойствами и может состоять из одинаковых или из различных атомов.
Химические соединения состоят из химических элементов и их состав изображается при помощи химических формул. Подстрочные индексы в химических формулах указывают на число атомов данного элемента, входящего в состав химического соединения. Например, формула H2O показывает, что в состав химического соединения воды входят 2 атома водорода и 1 атом кислорода.
Химическое уравнение – это выражение химической реакции, в котором записаны в левой части химические формулы исходных реагентов, а в правой части химические формулы веществ, образующихся в результате реакции. Число атомов элементов в правой и в левой частях уравнения должно быть одинаковым. Коэффициенты перед формулами веществ в уравнении реакции называются стехиометрическими коэффициентами. Они показывают число молей веществ, участвующих и образующихся в данной реакции.
Например, в реакции:
2H2 + O2 = 2H2O
из 2 моль водорода и 1 моль кислорода образуется 2 моль воды.
Количество вещества – число структурных элементов (атомов, молекул, ионов) в системе, измеряется в моль.
Моль — количество вещества системы, которое содержит столько структурных элементов (молекул, атомов, ионов), сколько атомов содержится в 12 г изотопа 12С.
Установлено,
что данная масса углерода содержит
6·1023 атомов углерода. Таким образом,
1 моль вещества содержит число частиц,
равное числу Авогадро
 = 6·1023 моль-1.
= 6·1023 моль-1.
Относительная
атомная масса элемента
 – отношение абсолютной массы атома
к 1/12 абсолютной массы изотопа 12С.
(1/12 массы 12С = 1,66·10-27 кг, эта
величина называется атомной единицей
массы – 1 а.е.м.). Относительные атомные
массы элементов можно определить по
таблице Менделеева.
– отношение абсолютной массы атома
к 1/12 абсолютной массы изотопа 12С.
(1/12 массы 12С = 1,66·10-27 кг, эта
величина называется атомной единицей
массы – 1 а.е.м.). Относительные атомные
массы элементов можно определить по
таблице Менделеева.
Относительная
молекулярная масса
 – отношение абсолютной массы молекулы
к 1/12 массы изотопа 12С. Относительная
молекулярная масса определяется как
сумма относительных атомных масс всех
элементов, входящих в состав молекулы,
с учетом подстрочных индексов. Например,
(Н2О)
= 2·
(Н)
+
(O)
= 2·1+16 =18.
– отношение абсолютной массы молекулы
к 1/12 массы изотопа 12С. Относительная
молекулярная масса определяется как
сумма относительных атомных масс всех
элементов, входящих в состав молекулы,
с учетом подстрочных индексов. Например,
(Н2О)
= 2·
(Н)
+
(O)
= 2·1+16 =18.
Молярная
масса вещества
 – это масса 1 моля вещества, измеряется
в г/моль. Численно молярная масса вещества
равна молекулярной массе. Молярная
масса вещества определяется аналогично
молекулярной массе, по таблице Менделеева.
Например,
(Н2О)
= 2·
(Н)
+
(O)
= 2·1 г/моль+16 г/моль =18 г/моль.
– это масса 1 моля вещества, измеряется
в г/моль. Численно молярная масса вещества
равна молекулярной массе. Молярная
масса вещества определяется аналогично
молекулярной массе, по таблице Менделеева.
Например,
(Н2О)
= 2·
(Н)
+
(O)
= 2·1 г/моль+16 г/моль =18 г/моль.
Количество
вещества
 можно рассчитать, используя следующее
соотношение:
можно рассчитать, используя следующее
соотношение: ,
где
,
где
 – масса в г,
– молярная масса в г/моль. Учитывая, что
1 моль вещества включает число частиц,
равное
= 6·1023, количество вещества
также рассчитывается по формуле:
– масса в г,
– молярная масса в г/моль. Учитывая, что
1 моль вещества включает число частиц,
равное
= 6·1023, количество вещества
также рассчитывается по формуле:
 ,
где
,
где
 – это число частиц в системе.
– это число частиц в системе.
Эквивалент
(фактор эквивалентности)
 - реальная или условная частица вещества,
которая соединяется с одним молем атомов
водорода или может замещать 1 моль атомов
водорода в химических реакциях. В
качестве условной частицы может выступать
доля от реальной частицы вещества, т.е.
фактор эквивалентности
- реальная или условная частица вещества,
которая соединяется с одним молем атомов
водорода или может замещать 1 моль атомов
водорода в химических реакциях. В
качестве условной частицы может выступать
доля от реальной частицы вещества, т.е.
фактор эквивалентности
 .
.
Эквивалентная
масса вещества
 -
молярная масса одного эквивалента
вещества, измеряется в г/моль и
рассчитывается по формуле:.
-
молярная масса одного эквивалента
вещества, измеряется в г/моль и
рассчитывается по формуле:.

где – молярная масса, – эквивалент (фактор эквивалентности) вещества.
Для отдельных классов неорганических соединений эквивалентные массы веществ определяются по формулам:
эквивалентная масса оксида:

где
-
молярная масса оксида,
 – это число атомов элемента, который
входит вторым в состав оксида, помимо
кислорода,
– это число атомов элемента, который
входит вторым в состав оксида, помимо
кислорода,
 – валентность этого элемента.
– валентность этого элемента.
эквивалентная масса кислоты:

где
- молярная масса кислоты,
 – это основность кислоты, т.е. число
атомов водорода в составе кислоты.
– это основность кислоты, т.е. число
атомов водорода в составе кислоты.
эквивалентная масса основания:
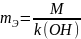
где
- молярная масса основания,
 – это кислотность основания, т.е. число
гидроксогрупп в составе основания.
– это кислотность основания, т.е. число
гидроксогрупп в составе основания.
эквивалентная масса соли:

где
- молярная масса соли,
 – это число атомов металла в составе
соли,
– это число атомов металла в составе
соли,
 – валентность этого металла.
– валентность этого металла.
Одним из фундаментальных законов химии является закон сохранения массы вещества: масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Закон постоянства состава химических соединений: каждое химическое соединение независимо от способа получения имеет один и тот же химический состав; стехиометрические коэффициенты в молекулярной формуле всегда целочисленны и постоянны. Например, соединение H2O, независимо от способа получения, всегда содержит в своем составе 2 атома H и 1 атом O.
Закон эквивалентов: массы реагирующих веществ пропорциональны их эквивалентам или их эквивалентным массам:


Закон Авогадро: в равных объемах различных газов при одинаковых внешних условиях содержится одинаковое число молекул.
Из
закона Авогадро следует, что одинаковое
число молекул различных газов при равных
условиях занимает одинаковый объем.
При нормальных условиях (температуре
273 К и давлении 1·105 Па) 1 моль любого
газа, в котором содержится 6·1023
структурных единиц (атомов, молекул,
ионов) занимает объем, равный 22,4 л. Этот
объем называется молярным объемом
газа ( = 22,4 л/моль).
= 22,4 л/моль).
В условиях, отличных от нормальных, объем любого количества газа может быть рассчитан по уравнению состояния идеального газа (уравнение Менделеева-Клапейрона):

где
 - давление (Па);
- давление (Па);
 - объем газа (м3),
- объем газа (м3),
 - температура (К);
- температура (К);
 - универсальная газовая постоянная
(8,31 Дж/моль·К).
- универсальная газовая постоянная
(8,31 Дж/моль·К).
Закон объемных отношений (закон Гей-Люссака): объёмы вступающих в реакцию газов относятся друг к другу и к объёмам образующихся газообразных продуктов как небольшие целые числа. Например, в реакции
H2 + Cl2 = 2HCl
1 моль водорода реагирует с 1 моль хлора, в результате образуется 2 моль хлороводорода.
При этом объемы газов пропорциональны количеству газов и их соотношение равно:
1V(H2): 1V(Cl2): 2V (HCl).
Одним из фундаментальных законов химии является также периодический закон: свойства элементов и их соединений находятся в периодической зависимости от заряда ядра атомов или порядкового номера элемента. К основополагающей теории химии относится теория химического строения Бутлерова, согласно которой свойства молекулы определяются природой, количеством составляющих ее атомов, а также порядком их расположения или строением молекулы.
