
- •Квантовая теория света.
- •Свойства теплового излучения
- •Фотоэффект
- •Эффект Комптона
- •Теория Бора атома водорода
- •Со второго уровня на первый.
- •Квантово-волновой дуализм
- •Волновая функция. Соотношение неопределенностей
- •Уравнение Шредингера.
- •Туннельный эффект
- •Квантовый гармонический осциллятор
- •Размер и форму электронных орбит определяют квантовые числа?
- •Принцип Паули. Таблица Менделеева
- •Рентгеновское излучение
- •Молекулярные спектры
- •Лазеры.
Квантовый гармонический осциллятор
Какие значения энергии может принимать квантовый гармонический осциллятор?
1)
![]() 2)
2)
![]() 3)
3)
![]()
n=1, 2, 3,… n=0, 1 , 2, 3,….. n=0, 1, 2, 3,….
Какое уравнение Шредингера описывает поведение квантового гармонического осциллятора?
1)![]() ,
2)
,
2)
![]() ,
3)
,
3)
![]() .
.
Что такое нулевая энергия гармонического осциллятора ?
это полная энергия гармонического осциллятора, равная нулю,
это энергия гармонического осциллятора при Т = 0 К, равная нулю,
это энергия гармонического осциллятора при Т = 0 К, равная 1/2hν.
Какие частоты может излучать гармонический осциллятор, излучающий колебания с минимальной частотой νо ?
1) ν1 = νо , ν2 = 1,5νо, ν3 = 3νо ,
2) ν1 = νо , ν2 = 2νо, ν3 = 3νо,
3) ν1 = νо, ν2 = 2,5νо, ν3 = 3νо.
Квантовомеханическая модель атома водорода
Размер и форму электронных орбит определяют квантовые числа?
1) n, m, 2)n, l, 3) n, s.
Сколько значений может принимать орбитальное квантовое число l ,если n = 2?
1) 3, 2) 2, 3) 1.
Сколько значений может принимать магнитное квантовое число m, если атом находится в состоянии n = 2, l = 1 ?
1) 2, 2) 3, 3) 4.
Что определяет спин электрона?
собственный магнитный момент электрона,
собственный механический момент импульса электрона,
орбитальный механический момент импульса электрона.
Атомы газообразного водорода находятся в состоянии с n = 5. Сколько всего линий будет в спектре излучения этого газа ?
1) 4, 2) 7, 3) 10.
.Какое уравнение Шредингера описывает атом водорода?
1) , 2) , 3) .
.Какой уровень энергии называется основным?
1) уровень энергии, на котром частица может находиться длительное время,
2) самый нижний уровень, отвечающий минимально возможной энергии,
3) самый верхний уровень, отвечающий максимально возможной энергии.
В опыте Штерна и Герлаха на атомы, движущиеся в неоднородном магнитном поле действует сила:
1)F
=![]() , 2) F =qB
, 2) F =qB![]() Sin
Sin![]() , 3)F = IBlSin
, 3)F = IBlSin
Какое уравнение Шредингера справедливо для стационарных состояний в потенциальном поле?
1)
![]() 2)
2)
![]() 3)
3)
Решая уравнение Шредингера для атома водорода мы приходим к выводу, что орбита электрона это
кривая, по которой движется электрон под действием электрического поля ядра,
геометрическое место точек, где электрон может быть с наибольшей вероятностью,
кривая, которую описывает электрон, двигаясь вокруг ядра атома водорода.
Решая уравнение Шредингера для атома водорода, какие можно ввести квантовые числа ?
1) n , l , s , 2) n , l , m , 3) n , m , s.
Какие возможны ориентации орбит электронов в состоянии n = 2, l = 1, если атом находится во внешнем магнитном поле?


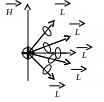
1) 2) 3)
Какие квантовые числа определяют волновую функцию и состояние электрона в поле ядра атома водорода при решении уравнения Шредингера?
1) n, l, m, 2) n, s, l, 3)n, m, s.
Решая уравнение Шредингера для атома водорода, какое можно получить выражение для момента импульса электрон?
1) L=
mvr , 2)
![]() 3)
3)![]()
Каким опытом был определен спин электрона?
1) Штерна и Герлаха, 2) Франца и Герца, 3) Резерфорда.
Максимальное число электронов, которые находятся в состоянии со значением главного квантового числа n = 3, равно
1) 18, 2) 9, 3) 6.
Некоторому значению главного квантового числа n соответствует число возможных значений орбитального квантового числа
1) n , 2) 2n +1 , 3) n – 1. .
Решая уравнение Шредингера для атома водорода, мы узнаем, что главное квантовое число определяет
момент импульса электрона, радиус орбиты электрона,
радиус орбиты электрона, энергию электрона,
энергию электрона.
Какое максимальное число электронов может находиться в состоянии, определяемом главным квантовым числом n ?
1) n , 2) n2 , 3) 2n2 ,
Сколько значений может принимать магнитное квантовое число, если атом находится в состоянии n = 3, l = 2 ?
1 ) 3, 2) 5 , 3) 7.
Сколько значений может принимать орбитальное квантовое число l , если n = 3?
3, 2) 4, 3) 5.
Как вероятность нахождения электрона в атоме водорода зависит от расстояния его до ядра?

1) 2) 3)
